日本幽门螺杆菌感染管理指南(2016修订版)解读
王 芬
中南大学湘雅三医院消化内科,湖南 长沙 410013
1 介绍
日本幽门螺杆菌研究学会于2000年首次出版了《日本幽门螺杆菌感染管理指南》[1],并于2010年进行了修订[2],本版本是第三次修订,是近7年来的第一次修订。由于根除幽门螺杆菌性胃炎的治疗已列入2013年的日本医疗保险涵盖疾病名单,日本对幽门螺杆菌的根除已经成为预防胃癌的基础举措,这一背景促使我们对指南进行了现行修订。与以前的版本修订类似,根据新的证据,在适应证、诊断和治疗方面对指南进行了修订。除了上述修订的临床指南外,还增加了关于胃癌预防的建议,这在日本至关重要。世界卫生组织的国际癌症研究机构(IARC)在2014年建议根除幽门螺杆菌作为预防胃癌的措施[3],目前日本已经在国家层面应对胃癌预防。在这项建议中,我们将预防胃癌的措施按年龄从青少年到老年进行划分(这些人群的胃癌风险增加),并提出了预防胃癌的措施,主要包括根除幽门螺杆菌的策略。筛选和治疗幽门螺杆菌已经由一些地方政府从初中或高中生发起。这些措施可能成为胃癌预防的核心,并使幽门螺杆菌感染的清除成为可能。我们预计这些预防措施在未来会得到更为广泛的应用。
2 方法
由于幽门螺杆菌诊治的医疗环境发生了变化,自上次修订7年后开始了指南修订工作。编辑和评估委员会由日本螺旋杆菌研究学会理事会成员组成。工作组分为适应证组、诊断组、治疗组和胃癌预防组。指南的目标群体为幽门螺杆菌感染患者。该指南适用于负责幽门螺杆菌感染患者诊治的日本临床医师。在PubMed和日本医学文摘社数据库中使用关键词“幽门螺杆菌”、“根除”、“诊断”、“胃癌”和等效的日语术语搜索文献。对2009年指南制定期间至2016年3月期间发表的文章根据证据级别进行了审查和分类。
指导委员会于1995年4月至1996年5月共举行了10次会议,在本次审查的基础上对这些声明进行了修订。在征求公众意见后,采用德尔菲法最终确定了修订后的声明。在这些指南中,陈述基于证据水平、证据数量、治疗结果、临床疗效、可行性(医师技能、区域可用性、医疗资源和健康保险系统)、伤害证据和成本。在为这些指南制定声明时,未考虑到日本国民健康保险是否覆盖。如果有多个不同级别的证据,则可以接受更高质量的证据。推荐等级和证据等级基于等级体系[4-6]。推荐等级分为三类:强(推荐1)、弱(推荐2)和不足(推荐3);证据等级分为四个等级:高(A级)、中(B级)、低(C级)和极低(D级)。

表1 幽门螺杆菌根除指征的推荐等级和证据水平Tab 1 Grade of recommendation and evidence level in indication of Helicobacter pylori eradication
3 陈述
3.1 幽门螺杆菌根除治疗陈述幽门螺杆菌感染是治疗的适应证。个体幽门螺杆菌相关疾病分为以下几类:(a)有高水平证据的疾病,强烈建议采用根除疗法;(b)尚未积累足够数据的疾病,但假定与幽门螺杆菌感染有关。
3.2 幽门螺杆菌感染根除幽门螺杆菌不仅有助于治疗胃/十二指肠溃疡,也有助于治疗和预防幽门螺杆菌相关疾病(如胃癌),以及抑制感染的传播。幽门螺杆菌可感染胃黏膜并引起胃炎(幽门螺杆菌性胃炎)[7-9],是各种上消化道疾病发生的原因,也被认为与非胃肠道疾病有关。在日本约35%的人群感染幽门螺杆菌;尽管与以前的发病率相比有所下降,但感染人口仍相当可观[10-11]。成功根除幽门螺杆菌可改善胃组织学胃炎,并有望预防幽门螺杆菌相关疾病(胃十二指肠溃疡和胃癌)[12-14]。因此,从预防医学的角度来看,整个感染人群即为治疗的目标人群。
在日本,幽门螺杆菌性胃炎自2013年起被批准为医疗保险报销的疾病。因此,幽门螺杆菌性胃炎几乎等同于幽门螺杆菌感染,被认为是一种疾病个体,诊断和治疗幽门螺杆菌相关疾病现在可以在临床上同时进行。这可能有助于治疗和预防幽门螺杆菌感染相关疾病和胃癌,这是日本最大的流行病学问题。此外,从阻断幽门螺杆菌传播途径的角度来看,根除疗法作为一种决定性的治疗手段也是非常必要的,并且有望大大减少未来的医疗费用。在某些情况下,由于耐药性根除无法实现,而且由于各种不良反应,治疗可能不得不中止。因此,应对根除治疗进行充分解释,并在开始根除治疗前确认患者接受根除治疗的意愿。
3.3 强烈推荐幽门螺杆菌相关疾病的感染根除
3.3.1 幽门螺杆菌胃炎(推荐等级:1,证据等级:A)
通过根除幽门螺杆菌,有望改善胃黏膜炎症,从而改善胃黏膜萎缩[15-16],抑制肠化生的进展[17],并最终预防胃癌[18]。因此,强烈推荐根除幽门螺杆菌以治疗这种疾病。幽门螺杆菌性胃炎的感染根除治疗也在2014年的京都全球共识会议上得到强烈推荐[19-20]。
3.3.2 胃/十二指肠溃疡(推荐等级:1,证据等级:A)
根据高等级证据,包括日本和其他国家多次发表的荟萃分析,已经证明,通过对感染幽门螺杆菌合并胃溃疡和十二指肠溃疡的治疗,可以防止溃疡复发和减少溃疡相关并发症(如出血)[21-25]。所以根除治疗应该是幽门螺杆菌感染合并消化性溃疡(包括溃疡疤痕)的首选疗法,除非患者对用于根除的药物过敏或有严重并发症阻碍根除治疗。
3.3.3 早期胃癌内镜治疗后残留胃黏膜(推荐等级:1,证据等级:A)
早期胃癌内镜切除术后可观察到复发或异时多发性癌。在日本进行的一项随机试验表明,根除组中异时癌的发生率显著降低,但由于不完全切除术,残余复发率无显著差异[14]。一项荟萃分析也证实了幽门螺杆菌根除治疗可以显著降低异时癌发病率(优势比:0.42;95%CI:0.32~0.56)[26]。然而,根除幽门螺杆菌并不能完全消除异时胃癌,这种情况在一定程度上仍在持续。因此,非常重要的一点就是即使在根除后,仍应通过内窥镜进行定期监测。
3.3.4 胃黏膜相关淋巴组织淋巴瘤(MALT)(推荐等级:1,证据级别:A)
当发现MALT时,应确认其局限于胃的位置和分期。根除幽门螺杆菌可改善组织病理学和内镜检查结果,诱导60%~80%的幽门螺杆菌阳性MALT的缓解[27-29]。此外,根除幽门螺杆菌后10年生存率高达95%[30]。因此,根除幽门螺杆菌是幽门螺杆菌阳性MALT患者的首选治疗方法。
3.3.5 胃增生性息肉(推荐等级:1,证据水平:A)
据报道,根除幽门螺杆菌后,胃增生性息肉消失或缩小[31-33],息肉体积缩小约70%[31-32]。因此,幽门螺杆菌根除被推荐为胃增生性息肉的首选治疗方法,尤其是多发性息肉。但是对于大面积病变或出血的病例,应考虑内镜切除。
3.3.6 功能性消化不良(FD)(幽门螺杆菌相关性消化不良)(推荐等级:1,证据水平:B)
荟萃分析表明,根除幽门螺杆菌可显著改善FD患者的症状[34]。根除治疗对某些幽门螺杆菌阳性消化不良病例有效,且已成为治疗FD的有效方法。这种情况不应与FD分组混淆,幽门螺杆菌相关性消化不良应作为一个独立疾病[35-37]。在幽门螺杆菌根除后,当症状消失或症状改善6~12个月时,将此类病例定义为“幽门螺杆菌相关性消化不良”[19-20],现已达成共识。2016年5月出版的《罗马Ⅳ标准》也遵循了这一定义[38]。
3.3.7 胃食管反流病(GERD)(推荐等级:1,证据等级:B)
GERD通常通过服用PPIs来治疗。在幽门螺杆菌感染个体中,有报道PPIs可以恶化胃炎[39]和胃黏膜萎缩的进展[40],这些都与致癌风险增加有关。因此,建议幽门螺杆菌感染者在长期使用PPIs前接受根除治疗。在日本进行的研究表明,幽门螺杆菌阳性的GERD患者胃酸分泌水平升高,并且在根除幽门螺杆菌后出现胃酸反流症状恶化或加重反流性食管炎[41-43]。但其他报道显示,在根除幽门螺杆菌后,消化性溃疡患者糜烂性GERD的发病率未增加[44],同时伴有十二指肠溃疡的GERD患者根除治疗可改善GERD及其症状[45]。因此,建议对GERD患者进行根除治疗。
3.3.8 免疫性(特发性)血小板减少性紫癜(ITP)(推荐等级:1,证据级别:A)
在日本,据报道,在根除幽门螺杆菌后,ITP阳性患者的血小板计数增加了40%~60%[46];因此,根除疗法应是首选疗法。
3.3.9 缺铁性贫血(推荐等级:1,证据水平:B)
尽管一些荟萃分析报道幽门螺杆菌感染是缺铁性贫血的危险因素[47-51],但潜在的致病机制仍有待阐明。根除治疗已被证明能改善儿童贫血(年龄<18岁)[52-55]。据报道,与单纯铁剂给药相比,使用铁剂给药联合根除治疗的成人患者血清中的血红蛋白水平显著提高,这些发现表明幽门螺杆菌感染与缺铁性贫血的病因有关。因此,可以考虑对缺铁性贫血的幽门螺杆菌阳性患者进行根除治疗。
3.4 推测与幽门螺杆菌感染相关的疾病
虽然无足够的证据支持以下疾病,但根除幽门螺杆菌的治疗可根据未来临床研究的结果予以考虑。
3.4.1 慢性荨麻疹(推荐等级:2,证据等级:B)
荟萃分析显示,幽门螺杆菌感染与慢性荨麻疹有显著的相关性(优势比:1.66;95%CI:1.12~2.45;P=0.01)[56],幽门螺杆菌根除治疗作为慢性荨麻疹的治疗似乎具有潜在的疗效。
3.4.2 帽状息肉病(CP)(推荐等级:2,证据级别:C)
CP是1985年首次报道的一种相对罕见的大肠慢性炎症性疾病,主要发生在直肠和乙状结肠,其组织学特征是息肉表面覆盖有帽状肉芽组织,伴有纤维蛋白渗出物[57]。2002年报道了1例幽门螺杆菌根除疗法缓解CP的病例[58],随后在日本报道数例类似病例。尽管有这些发现,但幽门螺杆菌是否直接参与CP发病机制仍不清楚,有必要进一步研究积极根除幽门螺杆菌对CP的作用。
3.4.3 弥漫性大B细胞淋巴瘤(DLBCL)(推荐等级:2,证据级别:C)
在一项相对大规模的研究中发现,在50例幽门螺杆菌阳性根除的DLBCL患者中,有一半以上的患者在胃局部出现完全的组织学缓解;所有患者存活下来,并在7.7年的中位随访期内保持缓解状态[59]。欧洲多中心前瞻性Ⅱ期试验也报道了根除的疗效,而且幽门螺杆菌根除疗法可能对胃局部病变的DLBCL患者有效[60]。相反,如果无治疗反应,根除疗法应终止并立即转为免疫化疗(也应考虑联合使用放射治疗)。
3.4.4 直肠MALT淋巴瘤(推荐等级:2,证据级别:C)
一些病例报道记录了根除幽门螺杆菌治疗直肠MALT淋巴瘤的疗效[61-62]。然而,在幽门螺杆菌阴性病例中也观察到根除的改善[62-64]。此外,易受抗生素影响的非幽门螺杆菌可能参与了病变形成。因此不建议积极根除。
3.4.5 帕金森综合征(推荐等级:2,证据等级:D)
帕金森综合征患者的幽门螺杆菌感染率为37%~59%,与普通人群无明显差异[65]。在幽门螺杆菌阳性的帕金森综合征患者中,成功根除幽门螺杆菌可显著改善左旋多巴的吸收和运动症状[65-66],但病例数量较少。
3.4.6 阿尔茨海默病(AD)(推荐等级:2,证据等级:D)
以前无关于幽门螺杆菌参与AD发病的荟萃分析。在最近的一项20多年603例患者的长期研究中报道,28.9%的幽门螺杆菌阳性个体和21.1%的幽门螺杆菌阴性个体发生了痴呆(P=0.044)[67]。
此外,成功根除幽门螺杆菌已经被报道产生了有益的影响,包括AD患者认知能力下降的减慢[68]和减少了死亡风险[69];然而,这两项研究都是小规模的,研究对象均≤50例。
3.4.7 糖尿病(DM)(推荐等级:3,证据等级:D)
据报道,DM患者的幽门螺杆菌感染率明显较高,特别是2型糖尿病(T2DM)患者[70]。幽门螺杆菌感染可增加T2DM发病和进展,包括并发症的发生风险[71-72]。然而据最近的一项荟萃分析报道,目前尚无确凿证据表明幽门螺杆菌感染导致T2DM控制恶化[73],因此尚未达成共识。关于根除幽门螺杆菌,据报道根除治疗并不能改善T2DM的控制状态[74],且在DM(包括1型糖尿病)患者中比在非糖尿病患者中更容易幽门螺杆菌根除失败[75]。此外,有报道根除治疗可改善胰岛素抵抗[76]。因此,在B型胰岛素受体异常(DM的一个亚型)患者中,根除治疗对某些病例有效,而对其他病例可能无效。
4 诊断
4.1 一般理论
4.1.1 幽门螺杆菌感染的诊断与根除幽门螺杆菌的评价
① 以下任一种检查方法均可用于根除治疗前后幽门螺杆菌感染的诊断,结合多种诊断方法可提高诊断的准确性。在了解每种检测方法的特点之后,可以做出选择。(推荐等级:1,证据级别:B)
② 根除治疗后幽门螺杆菌感染的诊断
幽门螺杆菌根除治疗的疗效评估应在治疗结束后至少4周进行。尿素呼气试验(UBT)[77]和使用单克隆抗体的粪便幽门螺杆菌抗原分析对根除判断有价值[78]。根除治疗后由于细菌数量减少可能出现假阴性试验结果,当结果不清楚时,建议在随访后重新试验。(推荐等级:1,证据级别:B)
③ 检查方式
a. 需要内镜活检组织的检查方法
(1)快速尿素酶试验;(2)病理组织学;(3)细菌培养
b. 不需要内镜活检组织的检查方法
(1)UBT;(2)血清抗体检测;(3)粪便抗原检测(推荐等级:1,证据级别:B)
4.1.2 补充说明
① 由于幽门螺杆菌可能在胃中分布不均匀,因此需要从幽门窦大弯曲处和胃体中上部两个部位进行活检[79]。(推荐等级:1,证据等级:B)
② 当对幽门螺杆菌有抑菌作用和/或抑制尿素酶活性的药物(如抗菌剂、PPIs、钾竞争性酸阻滞剂[P-CAB]和一些保护性因子增效剂)被服用时,在幽门螺杆菌感染的根除和诊断之前,最好停用这些药物≥2周[80-81]。(推荐等级:1,证据级别:B)
③ 血清抗体检测方法不受PPIs等影响,粪便抗原检测受PPIs影响不大,取决于所用试剂盒[78,82]。(推荐等级:1,证据水平:B)
4.2 个体诊断方法
4.2.1 侵入性试验
① 快速尿素酶试验
快速尿素酶试验是一种快速、简便、准确的幽门螺杆菌鉴定方法。测试本身不能作为证据保存。此外,根除后的敏感性差异很大[83-85]。在快速尿素酶试验中,最好同时采集活检组织进行组织学检查。由于特异性高,用快速尿素酶法检测阳性的样品可判定为幽门螺杆菌感染阳性[83-86]。当碳酸氢钠(碱性)用于链霉蛋白酶清除胃黏液时,应在测试前将标本仔细冲洗,以避免碳酸氢钠的作用而出现假阳性。
诊断准确率:根除前敏感性[83,85]为91.0%~98.5%,特异性为90.9%~100%。根除后敏感性[83-85]为58.8%~86%,特异性为97.8%~99.2%。
② 组织学
幽门螺杆菌检测的组织学方法具有较高的检测结果保存能力,可与组织学诊断相结合。需要结合特殊染色,如Giemsa染色和苏木精-伊红(H&E)染色[87-90]。免疫染色有助于幽门螺杆菌和其他细菌之间的区别。当细菌数量小,细菌呈球形时,以及在某些条件下,非特异性染色难以判断[87-90]。当患者服用PPIs时,幽门螺杆菌可能转变为球形并迁移到胃凹部的较深部位。此外,在细胞内小管中可观察到异常的顶叶细胞[89]。免疫染色在这种情况下是有用的[89]。
诊断准确度:根除前H&E染色敏感性[90-91]为92%~98.8%,特异性为89%~100%。
③ 培养试验及药敏试验
幽门螺杆菌的存在只能通过培养直接确认。该方法在特异性方面非常好,可用于细菌菌株的保存、分型和药敏试验,对抗菌剂的敏感性也能进行测试。虽然在药物敏感性试验中推荐使用琼脂平板稀释法来测定最小抑制浓度,但也使用了其他方法(如E试验和肉汤微稀释法)。为了保存细菌菌株,单菌落幽门螺杆菌在脑-心浸液(BHI)肉汤(1~2 ml)或类似物中振荡培养以浓缩,然后在血琼脂培养基中进行纯培养。将收集的细菌细胞悬浮在含有15%甘油的BHI肉汤中,确认细胞不是球形,然后冷冻保存。
诊断准确率:敏感性为68%~98%,特异性为100%。
4.2.2 非侵入性试验
① UBT
口服标记13C的尿素。如果幽门螺杆菌存在于胃中,它的尿素酶活性将标记的尿素分解为13CO2和氨水。13CO2从胃肠道进入血液并在呼气时排出。测定呼出气体中二氧化物的13C增加率。使用13C-尿素薄膜包衣片可降低口腔中产生尿素酶的细菌的影响,从而提高诊断准确性[91]。当服用13C-尿素薄膜包衣片时或服用之后即应用了对幽门螺杆菌的抑菌作用或对尿素酶活性的抑制作用的药物(如抗菌剂、PPIs、P-CABs和一些保护因子增效剂),将出现大量假阴性的结果[81,92-93]。假阳性结果也会出现在胃酸过少或胃酸缺乏时,以及其他细菌产生了尿素酶时[94]。诊断准确率:敏感性为98%,特异性为98%。
② 血清抗体试验
在基于抗体的测试中,本土验证很重要,因为诊断的准确性取决于提取抗原的细菌菌株以及与幽门螺杆菌感染相关的疾病发病率[95]。使用从日本发现的菌株中提取的抗原试剂盒适用于日本。
当胃黏膜中的细菌数量减少时,抗体检测是有效的,而其他检测的结果被怀疑是假阴性。试验不受PPIs或黏膜保护药物的影响,因此不需要停药。然而,感染后并不会立即显示阳性结果。当幽门螺杆菌在晚期萎缩性胃炎患者中被自发根除时,结果可能低于临界值。在诊断感染时,还应注意抗体效价;如果结果为阴性,但接近临界值,则应采用其他试验来确认是否存在幽门螺杆菌感染。
在日本有几种血清抗体检测试剂盒,且最近基于乳胶法的试剂盒也已问世。然而,乳胶法尚未对诊断准确度进行充分评估,必须注意所使用的特定试剂盒的准确度和其他特征。
在幽门螺杆菌成功根除后,血清抗体需要很长时间才能转成阴性。当抗体检测用于检查根除是否成功时,应在根除前和根除后6个月测量的水平之间进行定量比较;如果治疗后抗体滴度降低至预处理滴度的一半或更低[96],那么说明根除是有效的。
尿抗幽门螺杆菌抗体使用酶免疫分析(EIA)或免疫色谱法进行分析。对于后一种方法,判断有些主观,所以必须谨慎。在用EIA测量尿抗体时,虽然获得了数值结果,但它们是半定量的,不建议用于确定是否成功根除。当使用高蛋白样本(如清晨尿)时,可能会出现假阳性结果。根除的诊断准确率[97-98]:血清抗体:敏感性为88%~100%,特异性为50%~100%;尿抗体敏感性为85%~96%,特异性为79%~90%。
③ 粪便抗原试验
这是一种直接检测粪便中幽门螺杆菌衍生抗原的方法。目前可用的试剂采用单克隆抗体,敏感性和特异性都很高[78,99]。在欧洲指南中建议将该检测作为评估根除的测试[100]。
尽管球形幽门螺杆菌对UBT产生阴性结果,但在该测定中则保留了抗原性。该方法对残余胃的诊断也有很好的准确性。
与抗体检测类似,本土验证是重要的,因为准确性取决于所用抗原和幽门螺杆菌感染相关疾病的发病率。目前日本常用的所有试剂盒都具有很高的诊断准确度[78,101-102],尽管欧洲和美国指南建议使用EIA对根除进行评估,但根据日本的结果,快速类型的试剂盒可以判断是否根除成功[102]。此外,EIA方法可以处理大量类似于血清抗体试验的标本,因此可以使用这种方法在健康检查中进行试验。
在实践操作中,对于因抗原稀释而可能产生假阴性结果的水样粪便需要谨慎。收集24~48 h后,将无法对排泄粪便进行正确评估;但使用专用取样工具收集的粪便可在室温或低于室温下储存约1周[99]。诊断准确度:根除前[99]:敏感性为96%~100%,特异性为97%~100%。根除后[101-102]:敏感性为75%~90%,特异性为96%~100%。
4.2.3 分子生物学技术
这是一种从不同标本中检测幽门螺杆菌特异性碱基序列的方法。由于可以检测到暂时性和死亡细菌,因此在诊断或评估根除的假阳性结果时,应谨慎使用该方法。在根除治疗中,该方法可用于检测与抗生素耐药性相关的基因突变。
该方法可用于幽门螺杆菌感染的诊断和致病性相关基因(如cag PAI和vac A)的研究。细菌菌株多态性/碱基序列的比较对于寻找传播途径(例如,家庭内感染)和诊断再感染也有价值[103]。即使在长期储存后,也可以从冷冻保存的细菌菌株或石蜡包埋的活组织检查组织中提取的DNA进行测试。
4.3 辅助诊断
4.3.1 血清胃蛋白酶原(PG)测定
已知PGⅠ与PGⅡ之比(以下简称PGⅠ/Ⅱ)在胃黏膜炎症时降低[104]。成功根除幽门螺杆菌后,PGⅠ与PGⅡ数值降低,且PGⅠ/Ⅱ随炎症改善而增加[105-106]。除上述特征外,最近有人提出了幽门螺杆菌感染和未感染幽门螺杆菌个体的PG参考水平,因为PG水平会因是否存在幽门螺杆菌感染而有所不同[107]。
以下情况PG水平发生了变化,当患者接受胃切除术后,心功能不全,有晚期肾功能衰竭,或服用抑酸药物(如P-CAB和PPIs),不适于幽门螺杆菌的辅助诊断。
①根除治疗前胃炎的诊断
化学发光酶免疫分析法(CLIA),PGⅠ/Ⅱ≤5.0或PGⅡ≥10 ng/ml为阳性[采用乳胶增强比浊免疫分析(LIA)法,PGⅠ/Ⅱ≤4.0或PGⅡ≥12 ng/ml为阳性]。
②根除治疗后胃炎的诊断
当治疗前的PGⅠ/Ⅱ比值<5.0时,治疗后的PGⅠ/Ⅱ增加≥25%为改善;当治疗前的PGⅠ/Ⅱ比值≥5.0时,治疗后的PGⅠ/Ⅱ增加≥10%为改善。
血清PG水平是幽门螺杆菌感染的炎症状态的标志物,但不能作为直接诊断幽门螺杆菌存在的标志物。它仅用于观察炎症状态和胃黏膜萎缩。就其临床意义而言,该方法应与传统的根除评估方法区别对待,因为它不能直接诊断细菌存在。然而通过血清PG改变根除,它可以用来辅助诊断根除治疗是否成功[105-106]。
4.3.2 内镜检查结果
在上消化道内窥镜检查中,幽门螺杆菌感染可根据胃炎的表现而疑诊。在伴/不伴有幽门螺杆菌感染的个体以及根除后,经常观察到京都分类的表现[108]。根除前和根除后图像之间的变化有助于评估根除情况。当感染诊断为阴性时,内镜检查结果也有助于区分未感染者和感染者。
4.3.3 胃X线检查
在胃X线检查中,幽门螺杆菌感染可根据胃黏膜表面的特征以及胃黏膜的性质和分布(萎缩)而疑诊[109]。当使用5 g发泡剂时,幽门螺杆菌感染的皱褶肿胀≥3.9 mm,当使用3.5~4.0 g时,幽门螺杆菌感染的皱褶肿胀≥4 mm。如果怀疑幽门螺杆菌感染,应进行内窥镜检查,并通过适当的诊断试验检测感染情况。
5 治疗
5.1 日本根除幽门螺杆菌的标准治疗方法是7 d三联疗法,PPIs或P-CAB联合阿莫西林、克拉霉素或甲硝唑。(推荐等级:1,证据级别:A)
虽然在比较奥美拉唑(OPZ)、兰索拉唑(LPZ)和雷贝拉唑(RPZ)的研究[110]中未观察到差异,但据报道7 d三联疗法(包括克拉霉素和阿莫西林)与沃诺拉赞(VPZ)的根除率明显高于与PPIs治疗的根除率[111-112]。在耐克拉霉素的幽门螺杆菌感染的患者中,VPZ的优点更大。在日本的主要研究中,使用OPZ、LPZ、RPZ、EPZ和VPZ二次根除疗法的根除率在90%左右[111,113-114]。
5.2 根除治疗使用的抗菌药物应根据抗菌药物敏感性试验选择使用,以达到最高的根除率。(推荐等级:1,证据级别:A)
选择预期能提供最高根除率的根除方案。在全球范围内,要求根除方案应达到≥90%的根除率[100],因此除日本的三联疗法外,多使用铋/非铋剂四联方案。然而,这些根除疗法在日本尚无相对应的足够的使用数据。
PPIs/阿莫西林/克拉霉素三联疗法是日本一级根除疗法的标准疗法,其根除率随克拉霉素耐药菌株频率的增加而降低[115]。因此,如果患者已经感染了克拉霉素耐药菌株,即使是首次根除治疗,也不应使用克拉霉素。故应预先测试克拉霉素耐药性。克拉霉素应用于克拉霉素敏感菌株,甲硝唑用于克拉霉素耐药菌株代替克拉霉素,其中94.3%可根除[116]。建议根据抗菌药物敏感性试验的结果选择抗生素。
如果不进行药敏试验,应选择三联PPIs或P-CAB/阿莫西林/甲硝唑治疗,因为对于初次治疗的病例,PPIs/阿莫西林/甲硝唑组合在一项研究中表现出比PPIs/阿莫西林/克拉霉素明显更高的根除率[117]。
5.3 幽门螺杆菌对各种抗菌药物产生耐药性,当使用幽门螺杆菌耐药的抗菌药物进行根除治疗时,根除率降低。(推荐等级:1,证据级别:A)
PPIs/阿莫西林/克拉霉素方案的根除率随克拉霉素耐药比例的增加而降低。根除失败进一步促进了耐药细菌的出现[115]。尽管日本在2000年左右的克拉霉素耐药率为7.1%,但在2002年、2003年、2010-2011年和2013-2014年,克拉霉素的耐药率已逐渐上升到18.9%、21.1%、31%和38.5%[118]。
当细菌对根除方案中涉及的某种抗生素具有耐药性时,使用该方案难以成功根除细菌。由于目前抗菌药物耐药率较高,建议进行抗菌药物敏感性试验,以选择最合适的抗菌药物。
5.4 关于根除治疗的持续时间,据报道,需要7 d的给药时间,并结合PPIs/阿莫西林/克拉霉素。(推荐等级:1,证据级别:A)
一项研究比较了阿莫西林750 mg bid+克拉霉素400 mg bid的5 d和7 d给药,前者的根除率为66%(46/70),显著低于后者的根除率84%(58/69)[119]。此外,一项比较7 d和14 d疗法的研究中,一项报道发现14 d疗法根除率明显升高[120],而另一项研究报道则认为两者根除率相当[117];然而,在2周治疗中观察到不良反应的频率增加。因此,建议7 d疗法。报告使用VPZ 20 mg bid,克拉霉素200或400 mg bid和阿莫西林750 mg bid 7 d的三联方案所达到的根除率为92.6%[111]。因此,7 d治疗被认为是足够的。
5.5 根除幽门螺杆菌治疗推荐克拉霉素剂量为200 mg bid
在三联PPIs或P-CAB/阿莫西林/克拉霉素方案的初次根除中,200 mg bid克拉霉素与400 mg bid克拉霉素的剂量在根除率上无差异[111,122]。关于不良反应,一项大规模研究发现,不良反应的发生随着克拉霉素剂量的增加而显著增加[123]。因此,权衡根除率和不良反应,日本建议剂量为200 mg bid。
5.6 根除幽门螺杆菌需要充分抑制胃酸分泌。(推荐等级:1,证据级别:A)
在根除幽门螺杆菌治疗过程中,必须充分抑制胃酸分泌,以增加幽门螺杆菌对抗菌剂的敏感性和胃中抗菌剂的稳定性[124]。LPZ、OPZ、RPZ、EPZ和VPZ可作为PPIs和P-CAB。PPIs剂量越高,根除率越高[125]。
血浆水平和PPIs对胃酸分泌的抑制作用受CYP2C19(一种主要负责PPI代谢的酶)多态性的影响。在具有广泛代谢基因型CYP2C19的个体中,根除率降低;但通过增加PPIs剂量或添加H2受体拮抗剂可以提高根除率[126-127]。此外,VPZ对胃酸分泌的抑制作用和含VPZ方案的根除率不受CYP2C19多态性的影响[111]。
5.7 用于根除疗法的药物通过抑制胃酸分泌和对药物代谢酶、药物转运体和肠道细菌的影响来影响使用药物的药代动力学。(推荐等级:1,证据水平:A)
在根除药物中,PPIs和P-CAB抑制胃酸分泌,从而影响其他药物的吸收。它们还可以通过P450对药物相互作用产生影响[128]。
克拉霉素是一种CYP3A4和MDR1的抑制剂,也会影响由同一种酶或转运体代谢或转运药物的药代动力学。甲硝唑影响CYP3A4,并影响作为这种酶底物药物的药代动力学。
抗菌剂减少肠道细菌产生维生素K,从而增加华法林的作用。由于通过P450的药物相互作用,华法林也会受到PPIs、克拉霉素和甲硝唑的影响,因此在服用华法林的患者中根除治疗需要谨慎。
在药物相互作用方面,在仔细检查每种药物的包装说明书后,必须充分注意安全性,进行根除治疗。
5.8 在根除过程中,会出现一定频率的不良反应(如腹泻、大便稀散、舌炎、排尿困难、休克、过敏反应、皮疹、肝功能紊乱和肾功能紊乱等)。(推荐等级:1,证据级别:A)
与根除治疗相关的不良反应发生率为4%~5%,具体不良反应主要包括腹泻、大便稀散和排便困难[111,122-123]。当腹泻严重时,据报道同时使用益生菌可预防腹泻[129]。不良反应相关的风险因素包括女性、大剂量克拉霉素和过敏史。老年人的不良反应风险未增加[123];因此老年人不需要担心不良反应而停止根除治疗。
5.9 应提前向患者充分解释关于根除治疗的问题,并应包括根除期间的药物依从性、潜在不良反应和根除后的随访观察。实施根除治疗的医师还应负责根除后患者的后续治疗。(推荐等级:1,证据级别:B)
接受根除治疗的患者应收到充分的根除幽门螺杆菌的解释,并至少了解以下内容:
1. 药物依从性:对于标准治疗,应指导患者正确服用药物,2次/d,持续7 d,共14次。
2. 饮酒:指导患者服用甲硝唑时避免饮酒。
3. 不良反应的解释:应充分解释根除过程中的不良反应和发生时应采取的措施。
4. 根除后GERD:解释反流性食管炎或GERD症状可能在根除治疗后暂时发生或加重。然而,这些症状并不影响根除治疗。
5. 根除后的营养状况:由于成功根除后,生活方式相关疾病(如肥胖和胆固醇升高)的风险增加[130],患者即使成功根除后也应接受生活方式指导。
6. 复燃:解释一些病例报道根除后幽门螺杆菌复燃[131],其发生频率为每年0~2%。
7. 根除后的随访:据报道,即使根除成功,也有胃癌的发生[132],同时也存在幽门螺杆菌复发的问题。因此,建议患者即使在成功根除后也要定期接受胃部检查。
5.10 二线根除治疗后的补救治疗包括使用西塔沙星和大剂量PPIs/阿莫西林治疗根除。(推荐等级:1,证据级别:B)
当二线根除失败时,报道了PPIs/阿莫西林/西塔沙星和PPIs/西塔沙星/甲硝唑等三线根除治疗方案[133]。
大剂量PPIs/阿莫西林治疗是一种通过增加阿莫西林口服剂量(因为它是一种时间依赖的抗菌剂)和PPIs剂量来强烈抑制胃酸分泌,从而最大限度地提高阿莫西林疗效的根除方法[134]。
5.11 对于青霉素过敏者,采用不含青霉素抗生素(如阿莫西林)的治疗方案进行根除治疗。(推荐等级:1,证据级别:B)
如果克拉霉素敏感,建议使用PPIs/克拉霉素/甲硝唑组合;如果是未知抗药性细菌,建议使用PPIs/西塔氟沙星/甲硝唑或PPIs/米诺霉素/甲硝唑组合[135-136]。
5.12 对于肾功能下降的患者,应减少抗菌剂的剂量,并仔细考虑适应证。(推荐等级:1,证据级别:A)
当患者肾功能受损时,应仔细考虑阿莫西林的使用[137]。如有需要,最好咨询肾脏科医师。由CYP3A4代谢的克拉霉素代谢物也通过肾脏排出,一般建议对肾功能晚期损伤的患者每日服用200 mg。建议250 mg qd的甲硝唑。不应使用剂量不能调整的包装配方。由于根除疗法可能对肾功能产生不可逆转的不良影响,因此需要充分考虑根除的适应证(如风险-效益平衡)。
5.13 对于透析患者,应减少抗菌药物的剂量,透析后应给予透析当天的剂量(推荐等级:1,证据水平:A)
在透析患者中,阿莫西林的最高血药浓度极高,半衰期也较长。此外,由于阿莫西林是可透析的,因此在透析后当天,应服用250 mg qd阿莫西林。肝脏中的克拉霉素代谢产物也通过肾脏排出,建议透析后当天透析患者服用1次200 mg克拉霉素和250 mg甲硝唑。不应使用不能调整剂量的包装配方。
5.14 对肝功能下降的个体给予常规剂量的根除,但必须注意不良事件。(推荐等级:2,证据级别:B)
根据一份关于慢性肝炎和肝硬化患者根除的报道,对于肝功能受损的患者来说,根除无特殊问题[138];但肝脏参与了许多用于其他疾病的药物代谢。因此,使用此类药物时应充分注意不良事件。
5.15 益生菌在幽门螺杆菌根除治疗中的作用。(推荐等级:1,证据级别:B)
在荟萃分析中,某些益生菌对根除幽门螺杆菌具有加强效应[139]。此外,另一项荟萃分析表明,联合使用益生菌可显著降低不良反应(例如腹泻和恶心),虽然在根除效果上呈现出加强效应,但差异无统计学意义[140]。
6 建议:胃癌预防
6.1 一般理论
我们从幽门螺杆菌感染控制角度,分别针对青少年、低胃癌风险和高胃癌风险阶段描述如何预防胃癌。
6.1.1 目前在日本,感染幽门螺杆菌主要发生在婴儿期,主要感染途径为家庭感染。(推荐等级:1,证据级别:B)
一项对国外[141]未受感染儿童和日本[142-143]未受感染儿童进行的研究表明,幽门螺杆菌感染主要发生在婴儿期,在成年后较少见。感染儿童的细菌株/细菌基因常常与家庭成员相同,与母亲的匹配率最高,其次是与父亲的匹配率[103,144-145]。此外,受感染儿童的父母有很高的阳性率[143]。
6.1.2 日本的幽门螺杆菌感染率(患病率)一直在下降。(推荐等级:1,证据级别:A)
由于供水和污水系统的改善,日本幽门螺杆菌感染率持续下降[146-150]。70年代和80年代出生的个体的感染率分别为20%和12%,明显低于1950年之前出生的个体,即>40%[150]。这一减少应考虑到胃癌对策中。
6.1.3 在日本,大多数胃癌病例的病因是幽门螺杆菌感染,未感染幽门螺杆菌的患者胃癌风险极低。幽门螺杆菌感染增加了未分化胃癌的风险,也增加了分化胃癌的风险。(推荐等级:1,证据级别:B)
持续感染者的胃癌风险至少是未感染者的15倍[151-152]。据报道,日本幽门螺杆菌阴性胃癌的发病0.42%是经内镜治疗的早期分化胃癌[153],0.66%是经内镜或手术治疗的病例,包括未分化胃癌[154]。
因为幽门螺杆菌感染增加分化和未分化胃癌的风险[148,151-152],所以预防幽门螺杆菌感染对胃癌的预防有重大影响。
6.1.4 胃癌的风险因幽门螺杆菌感染的存在或不存在以及胃黏膜萎缩的程度而有很大差异。因此,建议尽早进行幽门螺杆菌感染试验。(推荐等级:1,证据级别:B)
幽门螺杆菌感染的状态包括未感染的个体、持续感染的个体以及以前感染但目前未感染的个体。尽管成功根除可降低胃癌风险,但胃癌的发病率仍高于未感染者[132]。持续感染者的胃黏膜萎缩较严重,胃癌风险随着胃黏膜的进展而增加[151,155]。胃癌的风险因幽门螺杆菌感染和胃黏膜萎缩的程度而变化很大。因此,在感染早期进行幽门螺杆菌感染试验是评估胃癌风险的理想方法。有幽门螺杆菌感染史的个体,当他们处于胃癌高风险期时,还应检查胃黏膜萎缩。
6.1.5 根除可降低胃癌风险。(推荐等级:1,证据级别:A) 早期根除感染对预防胃癌更有效。(推荐等级:1,证据级别:B)
一项幽门螺杆菌性胃炎幽门螺杆菌根除治疗的随机研究表明,胃癌的发病率低了0.61倍,55岁以上的受试者发病率低了36%,死亡率低了26%[156]。一项荟萃分析表明胃癌的风险在根除组显著降低0.66倍[157]。一项评估日本早期胃癌内镜切除术后异时癌发病率的随机研究表明,根除可将胃癌风险降低34%[14]。类似的荟萃分析研究表明[158],如果分析仅限于前瞻性研究,胃癌风险将降低42%或39%。幽门螺杆菌感染在青少年胃癌中也有重要作用,其中80%是未分化癌[159]。随着幽门螺杆菌感染率的下降,从1970年至2010年,40岁以下人群因胃癌死亡的人数减少了1/6[160]。幽门螺杆菌感染对年轻人胃癌发病率也有很大影响。
如果在萎缩进展之前的早期进行根除幽门螺杆菌治疗,胃癌的预防效果会更好[13,161-163]。对于青少年来说,尚无结果可以证明对人类胃癌的直接预防作用,因为在胃癌发展之前需要长时间的观察;然而,动物实验[164]结果表明,早期感染的根除对胃癌有更大的预防作用。
6.1.6 根除后,用内窥镜和其他方法进行随访观察是必要的。(推荐等级:1,证据级别:A)
即使在根除后胃癌的风险仍然很高(一般理论4),在高胃癌风险期(见图1),有必要使用内窥镜和其他方法进行随访观察[165]。在青春期和低胃癌风险期,有必要根据胃黏膜状况进行治疗。
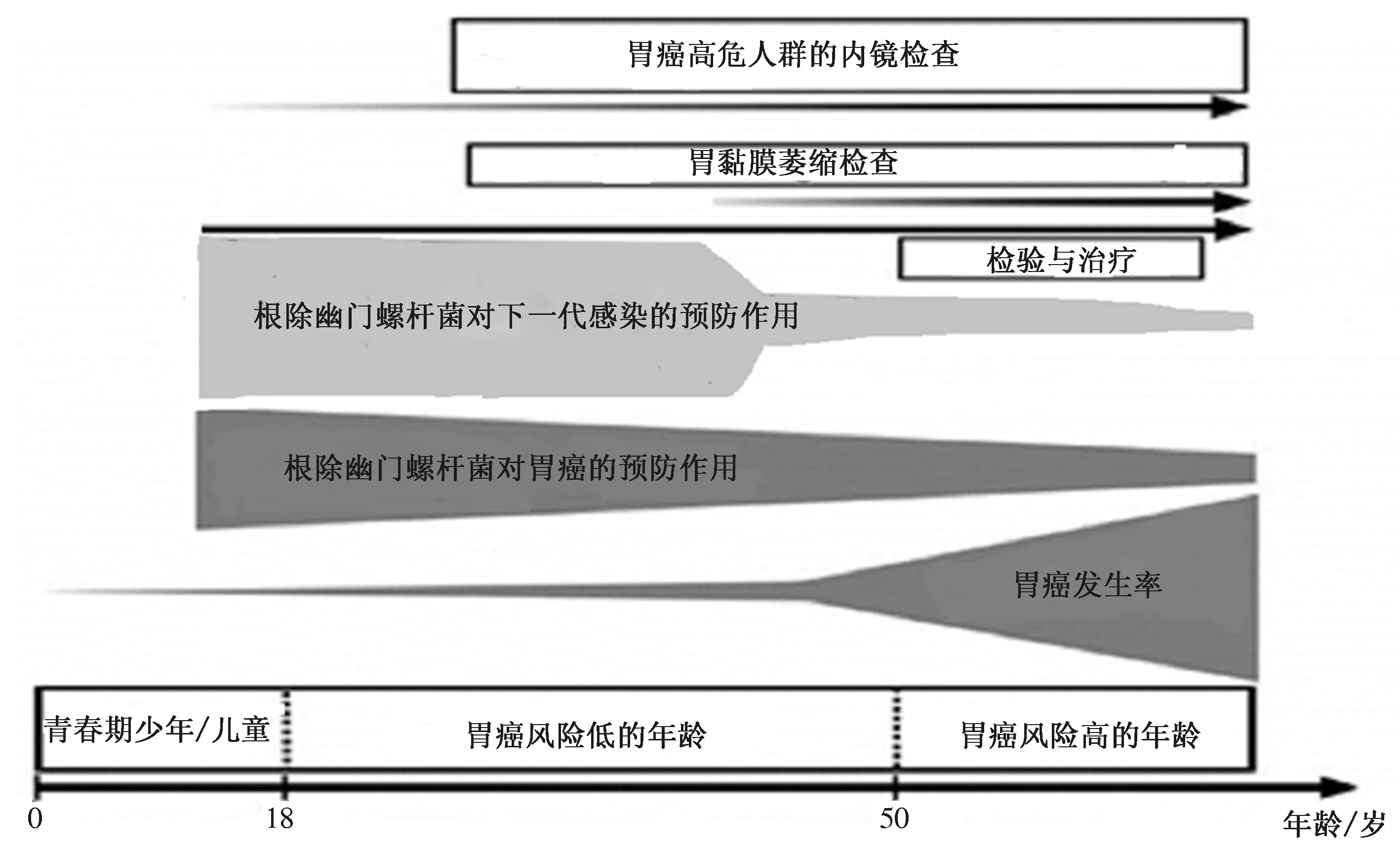
图1 幽门螺杆菌与胃癌关系预防胃癌的方案 Fig 1 Schema of gastric cancer prevention utilizing the relationship between H.pylori and gastric cancer
6.2 青春期人群
在这个年龄对幽门螺杆菌感染的筛查和治疗被认为是降低终生胃癌风险的措施。这些措施应作为政策由政府实施。
6.2.1 对中学生和稍年长者进行幽门螺杆菌感染的筛查是可行的。(推荐等级:1,证据级别:B)
在幼儿中,再次感染的风险很高[166-168],使用抗体测量试剂盒进行感染诊断的敏感性较低[169-171]。在中学生或更大年龄的学生中,抗体测试的准确性与成人相当[172],筛选感染也是可能的。由于中学教育是义务教育,所以如果由地方政府实施,那么中学生代表了一个理想的筛选目标群体。对于确认感染幽门螺杆菌的学生,建议在权衡根除治疗的获益和风险及学生和监护人的偏好后,尽快进行幽门螺杆菌根除治疗。请注意,目前日本的医疗保险制度不包括儿童幽门螺杆菌根除治疗。
6.2.2 青少年幽门螺杆菌根除治疗是下一代感染控制的有效方法。(推荐等级:1,证据级别:B)
在成为父母之前接受幽门螺杆菌根除疗法可以通过预防家族内感染来防止传染给下一代。这在日本是有效的,再感染不常见[173]。
6.2.3 尿抗体或粪便抗原被推荐作为青少年幽门螺杆菌感染的筛查试验。(推荐等级:2,证据级别:C)
在日本,所有儿童和学生都要做尿液分析。因此,利用尿液进行幽门螺杆菌感染筛查是一种无创、低成本的方法,可实现高筛查率。同样,也建议进行无创粪便抗原试验;但该试验与以下问题有关:该年龄段的儿童不愿意收集粪便样本,以及在运输过程中样本暴露于高温下会增加的假阳性结果。
6.2.4 一个高度准确的UBT被推荐作为青少年幽门螺杆菌感染的检验。(推荐等级:1,证据级别:B)
当用尿液抗体进行幽门螺杆菌感染的筛选试验时,由于尿液蛋白质和其他因素的影响,有30%~40%的假阳性率。因此,建议使用诊断准确度最高的UBT诊断感染[174-175]。
6.2.5 由于日本青少年幽门螺杆菌对克拉霉素的耐药率较高,建议在进行细菌药敏试验后确定治疗方法。(推荐等级:1,证据水平:A) 如果不能进行药物敏感性试验,则应考虑克拉霉素耐药性,选择治疗方法。(推荐等级:1,证据级别:B)
日本儿童克拉霉素耐药率为29%~43.4%[176-179]。治疗方案应基于最新的资讯,考虑包括药物敏感性、根除率和安全性等问题。
6.3 低胃癌风险期(50岁以下成人)
6.3.1 在此阶段,应结合使用幽门螺杆菌感染试验和胃黏膜萎缩试验。(推荐等级:2,证据级别:C)
通过内镜检查评估胃黏膜萎缩的程度是很重要的。对于胃癌风险较高的胃黏膜,建议根据风险水平进行内镜检查,即使年龄小于50岁。
6.3.2 现阶段的根除治疗可有效防止传播给下一代。(推荐等级:1,证据级别:B)
为防止子女受到感染父母的传染,建议幽门螺杆菌感染者在生孩子前接受幽门螺杆菌根除治疗。
6.4 高胃癌风险期(年龄≥50岁)
6.4.1 幽门螺杆菌根除治疗在现阶段仍有望对胃癌有预防作用。(推荐等级:1,证据级别:A)
幽门螺杆菌根除治疗前,必须通过内镜仔细确认胃癌的存在。即使年龄>70岁,幽门螺杆菌根除对于胃癌的预防也是有效的[14]。
6.4.2 在这个阶段,血清幽门螺杆菌抗体试验和胃蛋白酶原试验可能产生假阴性结果。(推荐等级:1,证据级别:B)
由于幽门螺杆菌自发消失的病例或根除后的病例出现晚期胃黏膜萎缩,幽门螺杆菌抗体试验和胃蛋白酶原试验通常会在持续或过去感染的个体中产生假阴性结果。请注意,尤其是当年龄≥65岁的群体进行这些测试时,会存在假阴性结果。

