PBC患者血清学指标与肝组织活检病理分期的关系及进展期PBC危险因素的Logistic回归分析
杨晓玲, 庄 琳, 和海玉, 王梅莲, 常 江
昆明医科大学第二附属医院消化内科,云南 昆明 650101
原发性胆汁性胆管炎(primary biliary cholangitis,PBC)是一种自身免疫介导、以肝内小胆管破坏为特征的慢性胆汁淤积性肝病,组织学从最初的小叶间胆管炎逐步发展为汇管区周围炎、小叶间隔纤维化,最终发展为胆汁淤积性肝硬化[1]。不同PBC患者疾病进展速度不一,不同发病阶段采取相应的治疗措施对于延缓或逆转PBC病情进展具有重要的临床意义[2]。目前通常根据胆汁淤积的表现及抗线粒体抗体(AMA)阳性即可诊断PBC,鉴于血清学标志物的特异性较强,肝组织活检对PBC的诊断已不是必要条件,然而PBC患者肝脏病变的分期对评估病情进展、指导治疗及预测疗效都有重要意义,血清学指标及一些无创诊断模型可用于PBC疾病分期和疾病进展的监测[3]。本文通过分析87例PBC患者肝组织活检不同病理分期(Ⅰ期、Ⅱ期、Ⅲ期、Ⅳ期)与同期生化、血细胞分析、凝血功能、免疫球蛋白、抗核抗体(ANA)及AMA等临床检验指标的相关性,为无创检验指标是否能替代有创的肝组织活检鉴别PBC不同病理分期提供参考依据。
1 资料与方法
1.1 研究对象选取2013年1月至2018年4月昆明医科大学第二附属医院消化内科确诊PBC并行肝穿活检分期的87例患者为研究对象,诊断参照2009年美国肝病学会的PBC诊断标准[4]:(1)碱性磷酸酶(ALP)升高等反映胆汁淤积的生化学证据;(2)AMA或抗线粒体抗体M2(AMA-M2)阳性;(3)穿刺活检示非化脓性破坏性胆管炎和小叶间胆管损毁的组织学证据;符合其中2项即可确诊。收集记录所有PBC患者的性别、年龄、BMI、血细胞分析[包括红细胞(RBC)、血红蛋白(HGB)、红细胞压积(HCT)、红细胞分布宽度(RDW)、血小板(PLT)、血小板平均体积(MPV)]、生化[白蛋白(ALB)、球蛋白(GLO)、白球比(A/G)、前白蛋白(PAB)、丙氨酸氨基转移酶(ALT)、天冬氨酸氨基转移酶(AST)、碱性磷酸酶(ALP)、谷氨酰转肽酶(GGT)、胆汁酸(TBA)、总胆红素(TB)、胆碱酯酶(CHE)、胆固醇(CHOL)、甘油三脂(TG)]、凝血功能[包括凝血酶原时间(PT)、国际标准化比率(INR)、活化部分凝血活酶时间(APTT)]、免疫球蛋白(IgG、IgA、IgM)、ANA及AMA-M2等血清学指标。本研究经医院伦理委员会批准(PJ-201841),所有患者均签署知情同意书。
1.2 排除标准排除各种急慢性肝炎、合并自身免疫性肝病、系统自身免疫性疾病、长期大量饮酒、半年内使用可疑肝损伤药物及临床资料不完整者。
1.3 研究方法
1.3.1 肝组织活检及病理学诊断:采用德国Bard全自动活检针,超声引导下穿刺获取长度1.5~2.0 cm的肝脏组织,立即甲醛固定、酒精脱水、石蜡包埋切片,行HE染色、Masson染色及网织纤维染色,光学显微镜下观察。PBC病理分期参照:肝组织病理分期根据Scheuer组织学分期[5]分4期:Ⅰ期胆小管炎期;Ⅱ期胆小管增生期;Ⅲ期纤维化期;Ⅳ期肝硬化期。
1.3.2 血清学指标检测:生化指标采用美国Beckman BX800全自动生化仪检测;血常规采用美国Beckman Coulter LH780,Fullerton,C全自动血细胞分析仪检测;凝血功能采用法国血凝仪(思塔高compact)进行检测;免疫球蛋白(IgG、IgA、IgM)采用美国Beckman Coulter Array 360全自动特种蛋白分析仪检测;ANA及AMA-M2采用间接免疫荧光法及免疫印迹法检测。
1.4 统计学方法采用EpiData3.1软件进行数据录入,采用SPSS 19.0软件进行统计学分析,符合正态分布的计量资料组间比较采用单因素方差分析,偏态分布计量资料组间比较采用Kruskal Wallis H秩和检验,相关性分析采用Logistic回归法。P<0.05为差异有统计学意义。
2 结果
2.1 一般资料本次研究纳入肝穿确诊为PBC的患者87例,女71例,男16例,女性占总人数的81.61%,发病中位年龄为49.16岁,分组从Ⅰ期到Ⅳ期,年龄呈上升趋势;BMI在PBC肝组织活检不同病理分期间差异无统计学意义(P>0.05,见表1)。
2.2 PBC患者各病理分期与血清学指标的关系采用单因素方差分析(不符合正态分布者采用Kruskal WallisH秩和检验),发现PBC患者不同病理分期ALB、GLO、A/G、PAB、PLT、ALP、GGT、TBA、TB、CHE、IgG、IgA、IgM组间差异有统计学意义(P<0.05),以上所有指标在Ⅰ期、Ⅱ期差异均无统计学意义(P>0.05);其中ALB、IgM在Ⅱ期、Ⅲ期、Ⅳ期组间差异无统计学意义(P>0.05),但其在Ⅲ期、Ⅳ期与Ⅰ期比较,差异有统计学意义(P<0.05);PLT、PAB、CHE在Ⅲ期、Ⅳ期组间差异无统计学意义(P>0.05),但其在Ⅲ期、Ⅳ期与Ⅰ期、Ⅱ期比较,差异有统计学意义(P<0.05);A/G、TBA、TB、IgG在Ⅲ期、Ⅳ期差异无统计学意义(P>0.05),其在Ⅲ期仅与Ⅰ期差异有统计学意义(P<0.05),其在Ⅳ期与Ⅰ期、Ⅱ期比较,差异均有统计学意义(P<0.05);ALP、GGT在Ⅲ期、Ⅳ期差异无统计学意义(P>0.05),其在Ⅲ期与Ⅰ期、Ⅱ期比较,差异均有统计学意义(P<0.05),而其在Ⅳ期仅与Ⅰ期比较,差异有统计学意义(P<0.05),IgA在Ⅰ期、Ⅱ期、Ⅲ期组间差异均无统计学意义(P>0.05),其在Ⅳ期与Ⅰ期、Ⅱ期、Ⅲ期比较,差异均有统计学意义(P<0.05,见表2~4)。
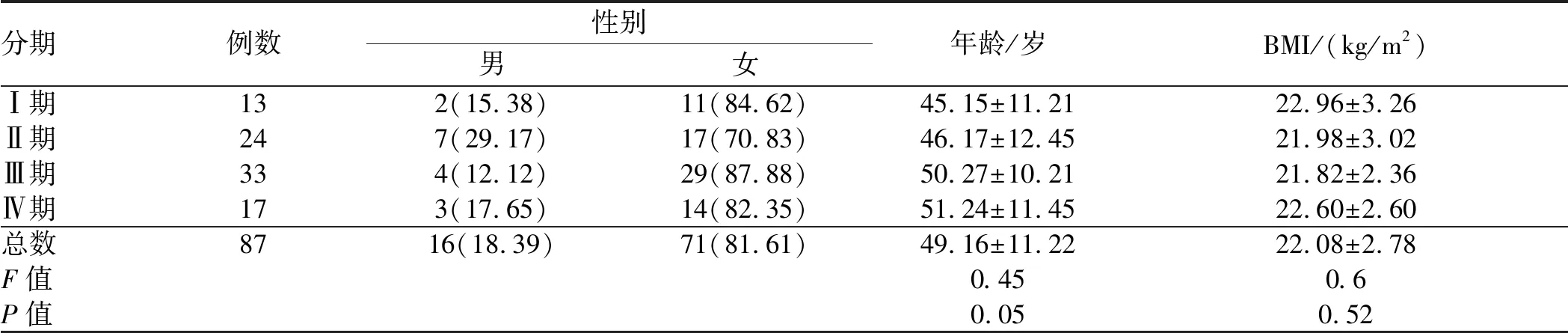
表1 PBC各病理分期基本情况比较Tab 1 Comparison of the basic information of different pathological stages of PBC
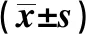
表2 PBC患者各病理分期血常规指标的比较Tab 2 Comparison of blood routine indexes in different pathological stages of PBC patients
注:与Ⅰ期相比,*P<0.05;与Ⅱ期相比,#P<0.05。
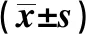
表3 PBC患者各病理分期生化指标的比较Tab 3 Comparison of biochemical indexes in different pathological stages of PBC patients
注:与Ⅰ期相比,*P<0.05;与Ⅱ期相比,#P<0.05。
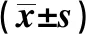
表4 PBC患者各病理分期凝血和免疫指标的比较Tab 4 Comparison of coagulation and immune indexes in different pathological stages of PBC patients
注:与Ⅰ期相比,*P<0.05;与Ⅱ期相比,#P<0.05;与Ⅲ期相比,S|P<0.05。
2.3 PBC患者各病理分期与ANA、AMA-M2的关系所收集的87例行肝组织活检确诊为PBC的患者中,77例行ANA检验,83例行AMA-M2检验。采用χ2检验进行分析,发现四组患者ANA(χ2=5.67,P=0.13)和AMA-M2(χ2=5.61,P=0.16)的阳性率在不同病理分期组间差异均无统计学意义(见表5)。
2.4 PBC患者进展期(Ⅲ期、Ⅳ期)的独立预测指标分析以早期(Ⅰ~Ⅱ期)和进展期(Ⅲ~Ⅳ期)分组为因变量,筛选单因素分析有统计学意义的变量作为自变量,自变量采用逐步引入法,进入α=0.05,剔除α=0.1,建立Logistic回归方程进行影响因素分析,发现A/G、TB、IgM是PBC患者病理进展的独立危险(见表6)。
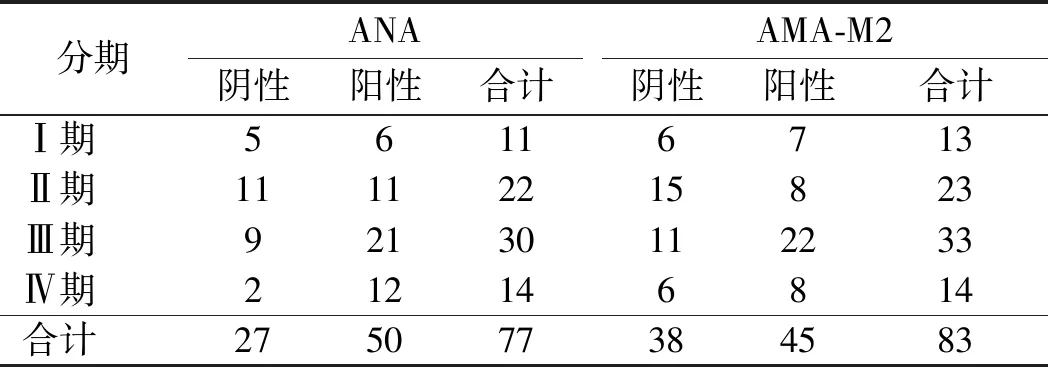
表5 PBC各病理分期ANA、AMA-M2的比较Tab 5 Comparison of ANA、AMA-M2 in different pathological stages of PBC patients
3 讨论
PBC在普通人群中的每年发病率为4.9/10万人,女性的发病率更高,估计10年生存率为76%,发病中位年龄为50岁[6]。在本研究中,女性占总人数的81.61%,发病中位年龄为49.16岁,分组从Ⅰ期到Ⅳ期,年龄呈上升趋势,可能与随着年龄增长病程延长、病理分期不断进展有关。
ALB、PAB、CHE均来源肝脏,在一定程度上反映肝脏合成功能,随着肝组织病变从Ⅰ期进展至Ⅳ期,正常肝细胞的数量相对逐渐减少,肝脏合成功能下降,血清ALB、PAB、CHE随着PBC的病情进展而下降,与相关研究一致[7]。在本研究中随着PBC患者组织学病理分期的进展PLT呈下降趋势,其原因可能为:随着病情的进展,血小板生成素(TPO)在肝脏合成水平不断下降,导致PLT降低。进展至肝硬化时,患者脾功能亢进,脾脏储存及滤过功能呈病理变化,引起PLT减少[8]。肝脏合成能力下降可使Ⅱ、Ⅴ、Ⅶ、Ⅸ等维生素K依赖性凝血因子合成减少,故理论上凝血功能可反映肝脏病变的严重程度,但本研究凝血指标PT、APTT、INR与病理分期无明显相关性,考虑以下原因:(1)与本研究样本量小;(2)为避免出现肝穿并发症部分凝血功能轻度异常者于肝穿检查前输注新鲜冰冻血浆纠正凝血功能;(3)本研究不包含临床严重肝功能异常、凝血功能极差不适宜肝穿检查的PBC患者。

表6 Logistic回归分析PBC患者进展期(Ⅲ期、Ⅳ期)的独立预测指标Tab 6 Logistic regression analysis of PBC patients with adanced stage (Ⅲ, Ⅳ) independent predictors
ALP、GGT主要来源于肝细胞的毛细胆管侧及胆管系统,胆汁淤积时刺激肝细胞产生过多的ALP、GGT,并随胆汁反流入血,故早期二者从一定程度上反映肝胆系统疾病病变的程度,本研究从Ⅰ期~Ⅲ期,ALP、GGT呈上升趋势,随着病情的进展,晚期小胆管减少和消失,Ⅳ期ALP、GGT较Ⅲ期下降,与相关研究一致[9],也有研究表明,ALP、GGT随着疾病分期的进展不断升高,可以部分反映PBC组织学改变的严重程度[10]。目前是否能依据ALP、GGT的高低评估PBC组织学改变程度观点尚未统一,故临床上ALP、GGT升高虽有助于诊断PBC,但不宜仅凭二者的高低评估组织学改变的严重程度。
TBA的摄取主要由肝细胞窦膜上的两种转运蛋白介导,许多因素可引起肝细胞摄取和转运功能失常,导致胆汁淤积[11]。当胆汁淤积时,TB也升高,胆盐介导的毒性作用将导致“上游”的肝实质损伤。但肝脏对胆汁淤积有一定的代偿能力,这就造成了临床上常见的无症状间期,实际TBA、TB水平已上升[12]。本研究显示,随着PBC病理分期的进展,TBA、TB的浓度逐渐升高,与相关研究一致[13]。TBA诱导的肝损伤是由应激肝细胞引发的炎症反应介导的,故减少胆汁酸池大小、阻断TBA进入肝细胞、减少线粒体损伤、或阻断细胞因子的产生或其炎症反应都可能减少胆汁淤积损伤[14]。故临床上及时发现并处理胆汁淤积的问题,对延缓PBC病程的进展有一定意义。
本研究中,GLO水平随着PBC病理分期的进展不断升高,目前关于GLO与PBC病理分期关系的研究较少,考虑随着PBC病情的进展,肝微循环受损至肝脏分流,使抗原进入全身循环系统后刺激增加抗体产生,抗体与星状细胞结合后使之激活并增殖后产生较多GLO[14],随着PBC疾病的进展,GLO的逐渐增多与ALB的逐渐减少,使A/G逐渐下降。PBC患者常有细胞免疫及体液免疫的异常, 还常合并其他自身免疫性疾病,体液免疫标志蛋白IgM明显升高是PBC的重要特征之一[15]。本研究发现,随着PBC病情的进展,IgG、IgA、IgM均呈不断升高趋势,尤其以IgM的升高最为显著,与相关文献报道一致[16]。
PBC患者AMA阳性率为95%,约50%的患者ANA和抗平滑肌抗体(SMA)阳性,5%~10%的患者AMA阴性或滴度≤1/80。AMA存在与否对诊断非常重要,但AMA水平与疾病严重程度无关[17]。本研究结果也提示PBC患者不同病理分期之间阳性率无明显差异,与相关研究一致[18]。故不能以AMA、AMA-M2是否阳性及滴度高低评估病理分期。当AMA阴性而高度怀疑PBC时,因完善ANA及ANCA(抗中性粒细胞胞浆抗体)检测并随访观察有助于确诊,必要时可完善肝组织活检有利于早期诊断[19]。
在本研究中多因素Logistic回归分析结果显示,A/G、TB、IgM是PBC患者病理分期进展的危险因素,研究结果TB水平与PBC病理进展呈正相关,与国内外各文献报道基本一致[9,20],但A/G、IgM是PBC病理进展危险因素报道的文献目前较少,可能与研究样本量相对较少致研究结果出现偏差有关,二者与PBC病理分期进展的关系有待扩大样本量后进一步研究。
本研究显示,PBC患者Ⅰ、Ⅱ期纳入的血清学指标差异无统计学意义,而ALB、GLO、A/G、PLA、PLT、ALP、GGT、TBA、TB、CHE、IgG、IgA、IgM仅部分在不同病理分期组间差异有统计学意义,但仍不能仅凭个例相关临床指标推断病理分期,目前肝组织活检仍是明确PBC病理分期的金标准,在无法获得肝脏病理组织学资料时,定期检测血常规、肝功能、凝血功能、自身免疫性抗体、免疫球蛋白等临床指标有助于了解PBC病情程度,但不能对肝脏病理分期进行判定。近期有研究表明,肠道微生物菌群的紊乱通过肠肝循环促进PBC疾病的进展[21],肠屏障功能的循环标志物(肠脂肪酸结合蛋白、可溶性CD14、脂多糖和脂多糖结合蛋白的水平)未来可能用于预测PBC的严重程度[22]。也有研究表明,LAMP2与PBC肝脏病理分期呈正相关,且LAMP2与GGT、ALP、DBIL等反映胆管病变程度的生化指标间也存在正相关关系[18]。虽然一些无创检测指标及无创诊断模型研究结果提示对PBC病理分期的诊断有一定前景,但尚未在临床中广泛运用及开展,目前仍缺乏随机大样本研究证实其准确性,无创指标或无创诊断模型对PBC病理分期的推断仍需进一步研究探讨。

