水稻穗顶部小穗退化突变体paa1-2的表型与等位基因序列分析
林秋云 丁西朋 谢振宇 贺治洲


摘 要 水稻穗顶部小穗退化在水稻生产中普遍存在,严重影响了水稻产量。本文对水稻穗顶部小穗退化突变体paa1-2进行表型观察,同时测序分析突变体paa1-2中已报道的TUTOU1和PAA1基因序列。结果表明,突变体paa1-2穗顶部退化表型是在幼穗发育6期后产生的。突变体paa1-2和野生型的TUTOU1基因序列一致,然而其PAA1基因存在突变,在第1512~1515 bp处存在4个碱基缺失,导致基因移码突变并使得蛋白翻译提前终止,PAA1-2可能是已报道PAA1基因的新等位突变基因。
关键词 水稻;穗顶部小穗退化突变体;paa1-2;表型;基因中图分类号 S511.2+1 文献标识码 A
Phenotype and Alleles Sequence Analysis of paa1-2, a Panicle Apical Abortion Mutant in Rice (Oryza sativa L.)
LIN Qiuyun, DING Xipeng, XIE Zhenyu, HE Zhizhou
Tropical Crops Genetic Resources Institute, Chinese Academy of Tropical Agricultural Sciences, Haikou, Hainan 571101, China
Abstract The molecular mechanism of panicle apical abortion has important theoretical and practical significance for high and stable yield breeding in rice (Oryza sativaL.). The phenotype of a rice panicle apical abortion mutantpaa1-2was observed and theTUTOU1and PAA1gene sequences in the mutantpaa1-2were sequenced. Results showed that the degraded phenotype of the mutantpaa1-2at the top of panicle was produced after the 6th stage of early panicle differentiation. TheTUTOU1 gene sequence in the mutant paa1-2 was identical to that of wild type. However, there were mutations in thePAA1 gene of the mutant paa1-2. There were four base deletions at 1512-1515 bp, which led to coding mutations and early termination of protein translation. PAA1-2maight be a new allele of PAA1gene.
Keywordsrice (Oryza sativaL.); panicle apical abortion mutant;paa1-2; phenotype; gene
DOI10.3969/j.issn.1000-2561.2019.09.012
水稻作為全球约一半以上人口的主食,是发展中国家最重要的粮食作物[1]。随着全球人口增多,耕地面积减少,生态环境逐步恶化,提高水稻产量对于满足粮食需求和保障粮食安全具有很大的意义[2-5]。每穗粒数是决定水稻产量的重要因素之一,在每株穗数不变的基础上,增加每穗粒数是提高水稻产量的重要途径之一[6-8]。然而,当水稻穗处于小花发育阶段时,已经形成的小穗容易发生退化,造成穗子体积减小,穗粒数大幅度减少,此现象被称为“开花前小花退化”(pre-flowering floret abortion)。穗部退化主要包括2种类型,分别是穗基部小穗退化和穗顶部小穗退化,而穗顶部退化现象在水稻育种过程中更为普遍。研究水稻穗顶部退化发生的分子机制,对水稻的高产、稳产、育种具有重要的理论与实践意义。
水稻穗顶部退化是一个复杂的数量性状,且易受到环境因素影响,因此加大了其研究难度。目前对穗顶部退化的研究已有一定的进展,但是大多数研究集中在QTL位点检测和突变体的精细定位[9-13]。目前仅有2个穗顶部退化相关的基因被克隆。Bai等[14]和Heng等[15]利用突变体成功克隆了2个水稻穗顶部小穗退化相关基因,分别是TUTOU1和PAA1。突变体tutou1表现出一因多效的表型,除了穗顶部发生小穗退化外,还伴随矮秆、短穗、花器官异常、根变短等特征。通过对不同组织的RT-PCR分析,结果表明该基因在根、茎、叶、小穗中均匀表达,并且表达水平在小穗中是最高的。TUTOU1基因编码一个有功能的SCAR/WAVE同源蛋白,在水稻穗的发育过程中发挥重要作用。突变体paa1是Heng等[15]从kitaake组织培养后代中鉴定得到的一个穗顶部退化突变体。经图位克隆和测序发现,突变体paa1的LOC_Os02g45160基因在一个剪切位点上存在单碱基的突变,导致编码的蛋白质氨基酸序列发生错误。PAA1基因编码一个铝激活的苹果酸转运蛋白。突变体paa1中PAA1基因的突变导致顶部小穗细胞内苹果酸含量的降低,引发细胞内的氧化还原平衡遭到破坏,从而有可能导致活性氧(ROS)爆发,引起顶部穗细胞发生死亡,导致突变体paa1顶部小穗的退化。本课题组在前期工作中利用60Co-γ射线辐照处理一个来自尼日利亚的籼稻品种SIPI干种子,辐射剂量为300 Gy,随后种植多代筛选,最终获得一个稳定遗传的水稻穗顶部小穗退化突变体paa1-2。本研究对突变体paa1-2进行表型特征观察分析,同时根据已报道的水稻穗顶部小穗退化相关基因TUTOU1和PAA1的基因组序列设计引物,对野生型和突变体paa1-2进行测序分析等位基因型,以期为控制水稻穗顶端小穗退化的分子机制研究提供参考。
1 材料与方法
1.1材料
利用60Co-γ射线300 Gy辐照籼稻品种SIPI(尼日利亚)干种子,随后多代种植筛选出稳定遗传的水稻穗顶部小穗退化突变体paa1-2。2018年春季在海南省儋州市中国热带农业科学院水稻综合试验基地种植野生型和突变体paa1-2,行距设定20 cm,株距设定13.3 cm,单株插秧,与常规大田的水肥病虫管理方法一致。
1.2方法
1.2.1 PCR扩增 PCR总反应体系为30 ?L,其中15.0 ?L Mix(2×Power Taq PCR MasterMix)、12.0 ?L ddH2O、1.0 ?L forward primer(10 mmol/L)、1.0 ?L reverse primer(10 mmol/L)、1.0 ?L模板DNA。PCR反应程序为:95 ℃ 5 min;循环(95 ℃ 30 s,58 ℃ 30 s,72 ℃ 1.5 min)35次;72 ℃ 5 min,4 ℃保存。
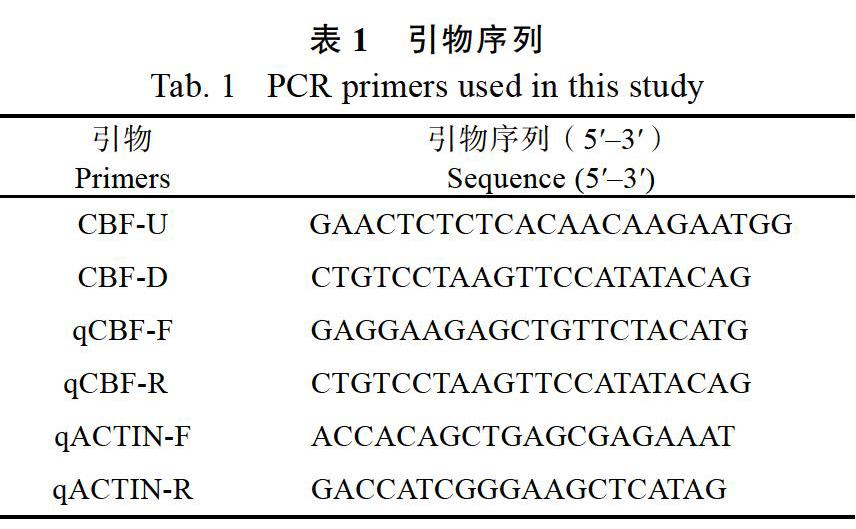
1.2.2TUTOU1和PAA1基因的等位基因序列测定 在国家水稻数据中心(http://www.ricedata. cn/gene/index.htm)检索TUTOU1和PAA1基因,基因符号分别为LOC_Os01g11040和LOC_Os02g45160,获得已公布的基因序列,利用Primer 5软件设计引物,分别扩增出野生型和突变体paa1-2中TUTOU1和PAA1等位基因的DNA片段,回收之后对DNA片段进行测序、拼接和序列比对,基因测序由广州天一辉远基因科技有限公司完成。测序结果用seqman软件拼接,用DNAman 6.0软件进行比对分析。本研究用于扩增突变体paa1-2中TUTOU1和PAA1基因的Indel标记序列信息见表1。
2 结果与分析
2.1水稻穗顶部小穗退化突變体paa1-2的表型鉴定
水稻穗顶部小穗退化突变体paa1-2在营养生长时期表现正常,与野生型相比没有明显的差异。而到抽穗期时,突变体paa1-2穗的顶部小穗出现明显的退化现象,表现为干瘪和坏死状态,而且突变体的穗一直保持着直立的形态,相反野生型的穗在开花后期就开始弯曲下垂(图1A,图1B)。

A:抽穗之后的整株表型;B:抽穗之后的穗部表型;C、D:野生型与paa1-2突变体幼穗发育6期和7期的表型;E、F:表示C、D中所对应的顶部小穗表型。
A: gross morphology of the wild-type (left) and paa1-2(right) plants after heading; B: panicle morphology of the wild-type (left) andpaa1-2 (right) after heading; C, D: phenotypic of the WT andpaa1-2at the 6th and 7th stage of early panicle differentiation, respectively; E, F: representative spikelets from the top of the corresponding panicles shown in C and D.
为了进一步了解突变体paa1-2顶部小穗发生退化的具体阶段,我们根据幼穗分化的8个发育时期对突变体paa1-2的顶部颖花进行观察。结果发现,突变体paa1-2在幼穗发育6期之前,与野生型相比无明显差异,而在幼穗发育7期时,paa1-2顶部的小穗发育停滞,仍处于浅白色的状态,而且paa1-2中部和基部的小穗生长状态和野生型基本一致(图1C,图1D,图1E,图1F)。这些结果表明突变体paa1-2穗顶部退化表型是在幼穗发育6期后产生的。突变体paa1-2顶部退化的小穗在籽粒成熟之后几乎都发生脱落,最终导致产量显著降低。
2.2水稻穗顶部小穗退化相关基因TUTOU1和PAA1在突变体paa1-2中的基因序列分析
通过对TUTOU1和PAA1这2个基因的序列分析发现,突变体paa1-2和野生型的TUTOU1基因序列一致,而突变体paa1-2的PAA1基因存在突变,测序发现其在第1512~1515 bp处存在4个碱基的缺失(图2),即第3个外显子上有4个碱基的缺失,从而引起基因移码突变,从第424位谷氨酸之后的氨基酸发生改变,蛋白翻译提前终止(图3)。且突变体paa1-2与突变体paa1在表型上相似,因此,PAA1-2可能是已被报道的PAA1基因新的等位突变基因。
3 讨论
水稻产量是一种复杂的农艺性状,主要由每株穗数、每穗粒数和千粒重3个因素所决定[16-17]。水稻育种研究者都一致追求大穗、多粒,这也是育种的主要目标之一。然而水稻育种中普遍出现水稻穗顶部颖花退化现象,导致水稻单产严重下降,因此,开展关于水稻穗部退化相关的分子机制研究工作迫在眉睫。目前认为水稻穗顶部小穗退化受环境和生理因素的影响,如外界的温度、湿度、光照、土壤中的营养条件和不同水稻品种本身的遗传背景等[18],是一个多基因控制的复杂数量性状。近年来已有很多控制水稻穗顶部退化的QTL位点被报道,但由于QTL位点很难分离,所以通过QTL精细定位找到控制水稻穗顶部退化基因的难度很大,关于水稻穗顶部小穗退化的遗传和分子机制还知之甚少[9-13]。
突变体是功能基因组学研究的重要材料,在揭示水稻重要性状的相关基因及其分子机制研究中具有重要的科学价值[19-20]。因此通过筛选与鉴定水稻穗顶部小穗退化突变体,有利于加快开展水稻穗顶部小穗退化的分子调控机制研究。本文报道的突变体paa1-2的突变表型与突变体paa1表型相似,其在PAA1基因序列上比野生型少4个碱基,从而引起基因移码突变并使得蛋白翻译提前终止,说明PAA1-2很有可能是PAA1的复等位基因。田间表型观察发现,突变体paa1-2在抽穗前与野生型比较,在外观上无任何差异,抽穗后明显表现出穗顶部退化,籽粒成熟之后,突变体顶部退化的小穗几乎都发生脱落,最终造成株高、穗长、每穗粒数都显著降低,与突变体paa1的表型一致。
参考文献
- Terao T, Nagata K, Morino K, et al. A gene controlling the number of primary rachis branches also controls the vascular bundle formation and hence is responsible to increase the harvest index and grain yield in rice[J]. Theoretical and Applied Genetics, 2010, 120: 875-893.
- Zhu K M, Tang D, Yan C J, et al. ERECT PANICLE2 Encodes a novel protein that regulates panicle erectness in indica rice[J]. Genetics, 2010, 184: 343-350.
- 朱德峰, 陈惠哲, 张玉屏, 等. 浙江水稻生产的现状与对策[J]. 农业现代化研究, 2006, 27(6): 470-472.
- Pushpendra K G, Rustgi S, Kumar N. Genetic and molecular basis of grain size and grain number and its relevance to grain productivity in higher plants[J]. Genome, 2006, 49: 565-571.
- 高 洁, 徐建第, 尹 亮, 等. 水稻产量性状的研究进展[J]. 山东农业科学, 2011(9): 57-60.
- Khush G S. New plant type of rice for increasing the genetic yield potential[J]. Rice Breeding and Genetics, 2000, 40: 99-108.
[7] Xu J, Yu S, Luo L,et al. Molecular dissection of the primary sink size and its related traits in rice[J]. Plant Breeding, 2004, 123: 43-50.
[8] 王昌华, 徐正進, 夏永胜, 等. 水稻穗部性状及其与产量相关分析[J]. 辽宁农业科学, 2007(3): 54-56.
[9] 徐华山, 孙永建, 周红菊, 等. 构建水稻优良恢复系背景的重叠片段代换系及其效应分析[J]. 作物学报, 2007, 33(6): 979-986.
[10] 王 斌, 刘贺梅, 毛毕刚, 等. 水稻顶部小穗退化性状的QTL分析[J]. 中国水稻科学, 2011, 25(5): 561-564.
[11] 高素伟, 张 玲, 毛毕刚, 等. 水稻穗顶部退化突变体L-05261的遗传分析[J]. 作物学报, 2011, 37(11): 1935-1941.
[12] Tan C J, Sun Y J, Xu H S,et al. Identification of quantitative trait locus and epistatic interaction for degenerated spikelets on the top of panicle in rice[J]. Plant Breeding, 2011, 130: 177-184.
[13] Cheng Z J, Mao B G, Gao S W,et al. Fine mapping of qPAA8, a gene controlling panicle apical development in rice[J].Journal of Integrative Plant Biology, 2011, 53: 710-718.
[14] Bai J, Zhu X, Wang Q,et al. RiceTUTOU1encodes a suppressor of cAMP receptor-like protein that is important for actin organization and panicle development[J]. Plant Physiology, 2015, 169: 1179-1191.
[15] Heng Y Q, Wu C Y, L Y,et al. OsALMT7 Maintains panicle size and grain yield in rice by mediating malate transport[J]. Plant Cell, 2018, 30(4): 889-906.
[16] 邢永忠, 徐才國, 华金平, 等. 水稻穗部性状的QTL与环境互作分析[J]. 遗传学报, 2011(5): 439-446.
[17] Xing Y, Zhang Q. Genetic and molecular bases of rice yield[J]. Annual Review of Plant Biology, 2010, 61: 421-442.
[18] Yao Y, Yamamoto Y, Yoshida T,et al. Response of differentiated and degenerated spikelets to top-dressing, shading and day/night temperature treatments in rice cultivars with large panicles[J]. Soil Science and Plant Nutrition, 2010, 46(3): 631-641.
[19] Wang J, Yu H, Xiong G,et al. Tissue-specific ubiquitination by IPA1 INTERACTING PROTEIN1 modulates IPA1 protein levels to regulate plant[J]. Plant Cell, 2017, 29(4): 697-707.
- Duan E C, Wang Y H, Li X H, et al. OsSHI1 regulates plant architecture through modulating the transcriptional acitivity of IPA1 in rice[J]. Plant Cell, 2019, www. plantcell .org/ cgi/ doi/ 10.1105/tpc.19.00023.

