钯(Ⅱ)-吡啶二羧酸-氨基酸配合物的合成及其与DNA的相互作用
陈佳奇, 宋振峰, 杨海霞, 孙薪博, 冯文爽, 高恩军
(沈阳化工大学 辽宁省无机分子基化学重点实验室, 辽宁 沈阳 110142)
癌症,始终是危害人类生命健康的一种顽疾,据第50届世界卫生组织(WHO)组织统计,全球范围内每年有将近600万人死于肿瘤,几乎每一秒都有肿瘤患者死亡[1],因此对抗肿瘤药物的研究迫在眉睫,其相关实验必将成为医药、生物化学的研究重点.目前,铂类药物如顺铂、奥沙利铂是公认的能够有效治疗多种肿瘤疾病的一类重要药物,对食道癌,子宫癌,小细胞肺癌等具有很高的疗效,但其对机体的毒副作用和抗药性是困扰研究工作者的一大难题,迫使研究工作者寻找新型抗癌药物[2].晶体工程金属超分子结构的设计与制造在超分子化学和材料科学领域中具有重要意义,选择合适的配体在金属超分子化合物的构建中尤为重要,如多元配体中的羧酸配体和含氮配体就被广泛用于金属超分子化合物的设计与合成,含氮供体的配体由于与金属中心的结合能力很高,常常用于构建配位聚合物.此外,钯(Ⅱ)具有与铂(Ⅱ)相似的结构特征,进而表现出与铂相似的化学性质,因此,对钯(Ⅱ)配合物的研究引起了人们的研究兴趣[3].为进步一探究钯混合配体配合物与DNA的作用机理,本文以吡啶-2,3-二羧酸(2,3-H2pydc)和2-氯-L-苯丙氨酸(L-2-Cl-Phe)为配体,合成了钯配合物[Pd(2,3-H2pydc)(L-2-Cl-Phe)],通过凝胶电泳、荧光光谱法和紫外光谱法探究了钯配合物与DNA的作用机理.
1 实验部分
1.1 试剂和仪器
四氯钯酸钾,分析纯,国药试剂;吡啶-2,3-二羧酸(2,3-H2pydc),分析纯,上海麦克林;2-氯-L-苯丙氨酸(L-2-Cl-Phe),分析纯,苏州爱玛特;无水乙醇,分析纯,天津大茂;CT-DNA,生化试剂,国药试剂;pBR-322DNA、TAE缓冲溶液、Marker和Loading Buffer,生化试剂,大连TAKARA.
上海培青JS-250电泳仪;JS-380A自动凝胶图像分析仪;D-MS-I磁力搅拌器;AR2140电子分析天平;UV-240岛津近红外可见紫外分光光度计;Perkin Elmer LS55荧光分光光度计,KQ-100B型超声波清洗仪;北京科伟101-2电热鼓风干燥箱.
1.2 配合物的合成
准确称取四氯钯酸钾(0.490 g)和吡啶-2,3-二羧酸(0.250 g)置于100 mL烧杯中,加入30 mL蒸馏水,超声振荡1 h后常温搅拌2 h,再加入2-氯-L-苯丙氨酸(0.299 g),超声振荡1 h后常温搅拌3 h,置于100 ℃鼓风干燥箱中干燥24 h后取出,研磨成粉,加入30 mL无水乙醇浸泡12 h,离心,取下层沉淀,用蒸馏水和乙醇抽滤洗涤2~3次再次置于100 ℃干燥箱中烘干24 h,研磨,得到[Pd(2,3-H2pydc)(L-2-Cl-Phe)].配合物合成路线如下所示:
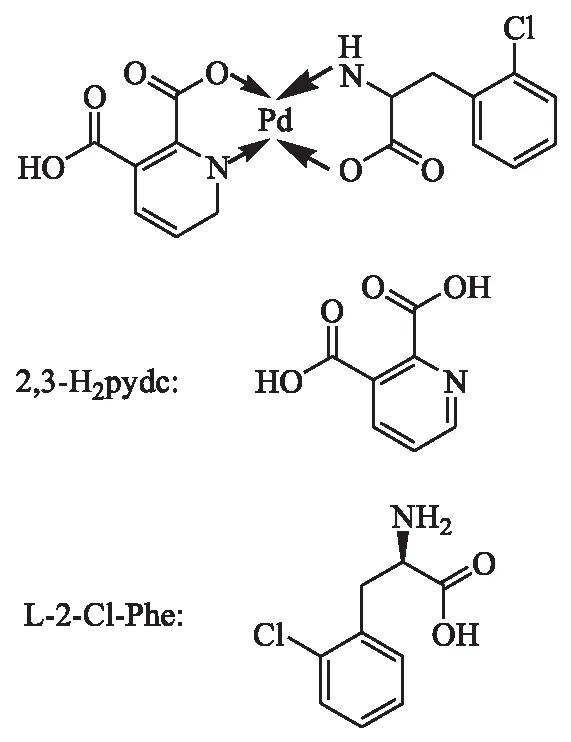
1.3 紫外光谱测定
为探究配合物与DNA的作用方式,采取紫外光谱法进行研究,这是较为直接的一种方法,同时因其价格较低,操作快捷简单,灵敏度高的特点而广泛应用于此类研究中[4].DNA分子所具备的特异性结构中包含嘧啶和嘌呤碱基的共轭双键,在紫外光下具有强吸收作用,其紫外吸收光谱会在约260 nm处产生一个强吸收峰[5],过渡金属配合物与DNA结合后,对配体所在环境产生一系列的影响,改变了吸收光谱的强度和波长,当DNA分子的双螺旋结构中各个碱基平行地紧密堆叠时,将出现“减色效应”,此时双链DNA分子在260 nm处的吸光度值要比DNA分子中各个碱基在260 nm的吸光度值的总和还要小得多.如果DNA的双螺旋结构被破坏解开,则分子的紫外吸收将增强,此种现象被称为“增色效应”[6].可以通过对配合物作用前后的吸收谱带进行对比,从而判断过渡金属配合物与DNA分子的作用效果.实验测试方法:将500 mL浓度为0.1 mol/L的Tris溶液和420 mL浓度为0.1 mol/L的HCl混合,加水定容至1 000 mL.称取0.016 g的CT-DNA,用Tris-HCl缓冲溶液定容至100 mL备用.称取0.004 7 g配合物溶于10 mL水中,然后取出1 mL配合物溶液用Tris-HCl缓冲溶液定容到100 mL备用.配制7组配合物浓度为2.0×10-6mol/L,CT-DNA浓度依次为0 mol/L、4.0×10-5mol/L、8.0×10-5mol/L、1.2×10-4mol/L、1.6×10-4mol/L、2.0×10-4mol/L和2.4×10-4mol/L的混合溶液,同时将CT-DNA加入Tris-HCl缓冲溶液中配制成上述浓度作为参比液,进行紫外光谱测试.
1.4 荧光光谱测定
除紫外光谱法外,荧光光谱法也是研究过渡金属配合物与DNA作用方式的一种光谱学技术手段,其同样具有选择性好、操作简单、灵敏度高等优点,且测试样品需求量小.当配合物与DNA键合时,其荧光光谱也会受到影响而产生变化,因此可以通过配合物与DNA作用前后的荧光光谱变化对比,分析其作用方式[7].溴化乙锭(EtBr)是最早作为荧光探针而被广泛应用于抗癌药物筛选和DNA作用研究的荧光物质,其拥有共轭芳香环平面结构,虽然溴化乙锭本身的荧光性能较弱,但却可以与DNA双链内部的碱基完全平行的插入对接,形成DNA-EtBr复合物,变成更大的堆积.DNA本身不存在荧光效果,但当EtBr分子嵌入DNA螺旋结构的碱基对之间后,EtBr分子平面刚性会显著增强,同时碰撞猝灭变弱,从而增强了荧光效果,这个效果会比游离EtBr自身的荧光效果强10倍.而当体系中存在能与EtBr竞争插入DNA分子的配合物时,EtBr会被排挤出DNA分子,形成游离EtBr,从而荧光效果显著降低.运用这一特性,EtBr可以被作为荧光探针使用[8].根据经典斯恩特-沃尔默(Stern-Volmer)方程:I0/I=1+Ksqr,其中:I,I0分别代表复合物体系(配合物/EtBr/DNA)中存在和不存在配合物时复合物的荧光强度;Ksq表示斯特恩猝灭常数,其可以定量表述配位聚合物与DNA作用强弱;r则表示复合物中配合物与DNA的浓度比.化合物与DNA作用的强弱程度可以通过Ksq值的大小定量的比较,Ksq值越大,作用强度越大,结合能力越强[9].实验测试方法:称取0.001 6 g的CT-DNA,用蒸馏水溶解定容至50 mL.称取0.004 7 g配合物用蒸馏水溶解定容至100 mL备用.在5只50 mL烧杯中分别加入1 mL CT-DNA溶液,0.4 mL浓度为0.1 mmol/L的溴化乙锭溶液,避光条件下静置反应2 h后,加入一定量配合物溶液,用Tris-HCl缓冲溶液定容至20 mL,使5只烧杯中CT-DNA浓度均为5×10-6mol/L,配合物浓度依次为0 mol/L、0.5×10-6mol/L、1.0×10-6mol/L、1.5×10-6mol/L和2.0×10-6mol/L,继续避光静置反应2 h.在激发狭缝为10 nm、发射狭缝为10 nm、激发波长λex=526 nm、发射波长λex=610 nm下,扫描配合物的荧光发射光谱,记录的发射光谱范围为540~760 nm.
1.5 凝胶电泳测定
凝胶电泳法应用广泛,常用于提纯和鉴定核酸等研究中,同时也是分析过渡金属配合物对DNA断裂、解旋或嵌入能力的常用手段,其具有操作简单、快速、灵敏等优点,以琼脂糖为支持介质的凝胶电泳技术被广泛运用于分子生物学领域[10].带电粒子在外加电场的作用下,会向着与其电性相反的电极移动,DNA在一定pH条件下带有负电能力,这主要是因为DNA分子中存在亲水性的磷酸基团,在外加电场中会向着正极泳动.与其他类型电泳不同的是,除了电荷效应外,琼脂糖凝胶介质的分子筛效应也是影响DNA分子移动的主要因素.分子筛效应与分子量的构型和大小有着紧密的关系,当分子量小时,分子构型的空间位阻就越小,迁移位置越靠前[11].本文以pBR-322质粒DNA为研究对象,其具有3种空间构型,分别为线性(linear)、共价闭环(ccc)和单链开环(oc),当ccc型DNA的双链结构的其中一条链被断裂时,产生oc型DNA,若ccc型DNA的双链结构在同一位置断裂,则产生linear型DNA,3种不同DNA构型的紧密程度不同,其电泳移动速度也有所差异,从而导致分离[12].根据这一原理,可以通过琼脂糖凝胶电泳分析过渡金属配合物对DNA的切割能力.实验测试方法如下:取50×TAE琼脂糖电泳缓冲液20 mL,加水定容至1 L制成实验用电泳缓冲溶液.配制配合物浓度依次为5 mmol/L、2.5 mmol/L和1.25 mmol/L的水溶液各20 mL备用.称取琼脂糖1.5 g置于烧杯中,加入1 mL浓度为0.1 mmol/L的EtBr溶液,再加入180 mL电泳缓冲溶液,盖上滤纸,放入微波炉中火加热6 min,使之充分溶解,微微冷却后继续加热3 min取出.待温度降至70 ℃左右,迅速倒入梳孔的平板电泳床中,待琼脂糖完全冷却,拔去梳子.用微量进样器取1 μL pBR-DNA和8μL水注入小型EP管中混合均匀作为空白试验.再分别取1μL的pBR-DNA和5 mmol/L、2.5 mmol/L、1.25 mmol/L浓度的配合物溶液各8 μL分别注入小型EP管中混匀,避光反应2 h.向每组样品中注入2 μL的loading buffer上样液,混合均匀后注入到凝胶梳孔中,然后将琼脂糖凝胶放入电泳槽中,倒入电泳缓冲液使液面微微没过凝胶.在电压80 V、电流500 mA下电泳120 min,结束后采用凝胶图像分析仪进行观察并拍照保存.
2 配合物结构
以四甲基硅烷(Tetramethylsilane,TMS)为内标,DMSO-d6为试剂测定配合物[Pd(2,3-H2pydc)(L-2-Cl-Phe)]的核磁共振,1H-NMR数据如表1所示.
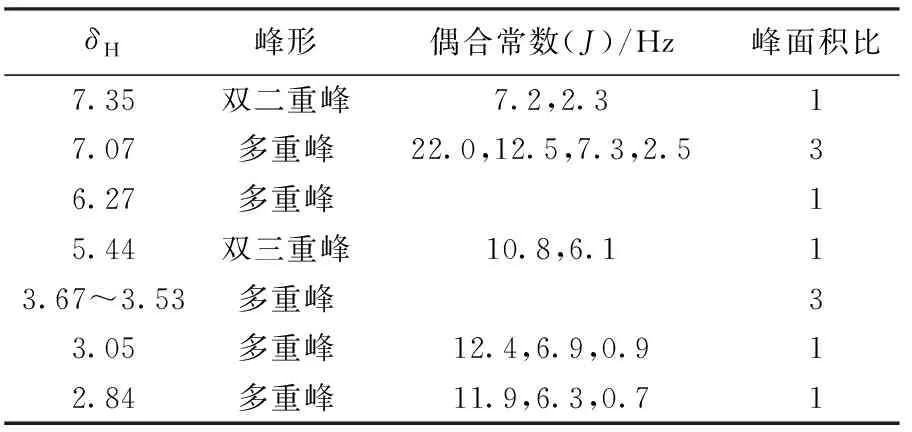
表1 [Pd(2,3-H2pydc)(L-2-Cl-Phe)]的1H-NMR数据
测定结果表明所测配合物中共含有13个氢,其中2,3-H2pydc中羧酸上的羟基—OH的氢和与钯配位的氨基—NH—的氢都是活泼氢,难以观测;δ7.35~7.07(4H)为L-2-Cl-Phe结构中苯环上的4个H,δ3.05~2.84(2H)为L-2-Cl-Phe结构中苯环侧链亚甲基—CH2—C上的2个H,δ6.27~3.53(5H)分别为吡啶环上的4个H(吡啶环上N与Pd形成配位键,N的邻位加氢生成亚甲基)和与氨基相连的—CH—.综上所述,确认所得产物为目标产物.
3 结构与讨论
3.1 配合物对CT-DNA作用的紫外光谱研究
选取CT-DNA(小牛胸腺DNA)作为研究对象,其与配合物相互作用的紫外光谱如图1所示.配合物在220~300 nm波长的紫外范围内出现明显的特征吸收峰,这是由于芳香氮碱配体内存在的π-π*电子跃迁而产生的,在加入DNA后,金属配合物的特征吸收峰出现明显的减色效应,随着DNA的浓度逐渐增大,趋势也随之明显,这是因为配合物以插入的方式与DNA螺旋碱基对结合,发生π电子堆砌作用,使其配体上π*空轨道与碱基的π电子轨道发生偶合,偶合后的π轨道因部分填充电子,导致π-π*跃迁几率降低,从而产生减色效应[13-15].
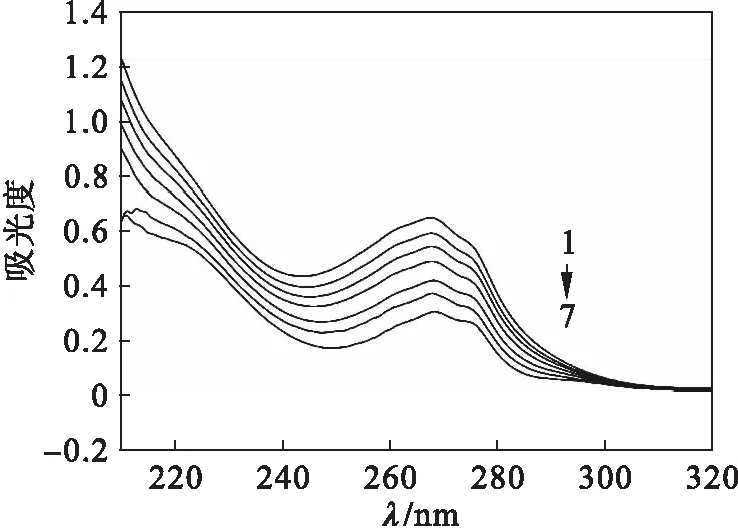
1.c(配合物)=2.0×10-6mol/L
2.c(配合物)=2.0×10-6mol/L+c(DNA)=4.0×10-5mol/L
3.c(配合物)=2.0×10-6mol/L+c(DNA)=8.0×10-5mol/L
4.c(配合物)=2.0×10-6mol/L+c(DNA)=1.2×10-4mol/L
5.c(配合物)=2.0×10-6mol/L+c(DNA)=1.6×10-4mol/L
6.c(配合物)=2.0×10-6mol/L+c(DNA)=2.0×10-4mol/L
7.c(配合物)=2.0×10-6mol/L+c(DNA)=2.4×10-4mol/L
图1 金属配合物与CT-DNA作用的紫外光谱
Fig.1 UV spectra of coordination polymer with CT-DNA
3.2 配合物对CT-DNA作用的荧光光谱研究
配合物与CT-DNA作用的荧光猝灭图如图2所示.金属配合物对CT-DNA/EtBr复合物体系产生了影响,激发波长为526 nm时,CT-DNA/EtBr复合物在623 nm处出现荧光发射峰,当金属配合物加入后,可以观察到荧光强度明显降低,且随着加入配合物浓度的增高,荧光猝灭现象也愈发明显,由此说明金属配合物以插入方式与CT-DNA结合在一起.图3猝灭曲线说明金属配合物能与CT-DNA结合,其与EtBr竞争,并对CT-DNA/EtBr复合物体系发生猝灭效应,其荧光猝灭常数用Ksq(Ksq=0.179)表示,说明金属配合物与CT-DNA发生了插入作用.
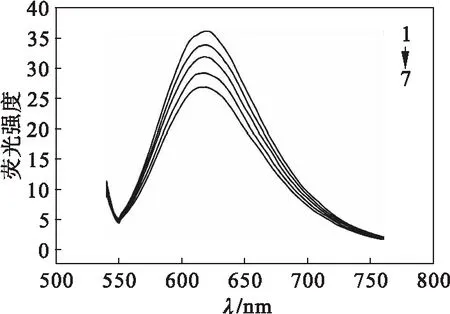
1c(配合物)=0 mol/L
2c(配合物)=0.5×10-6mol/L
3c(配合物)=1.0×10-6mol/L
4c(配合物)=1.5×10-6mol/L
5c(配合物)=2.0×10-6mol/L
图2 金属配合物与CT-DNA/EtBr复合物作用的荧光光谱
Fig.2 Fluorescence spectrum of coordination polymer with CT-DNA/EtBr
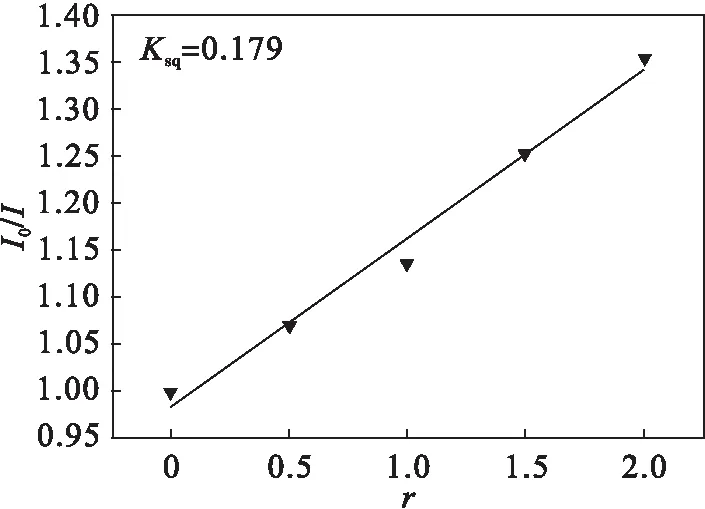
图3 金属配合物与CT-DNA/EtBr复合物作用的猝灭常数Fig.3 Quenching constant of coordination polymer with CT-DNA/EtBr
3.3 配合物对pBR-322质粒DNA的断裂能力研究
配合物与pBR-322质粒DNA的电泳图如图4所示.Lane0没有加入金属配合物,Lane1~3加入了金属配合物,浓度依次为1.25 mmol/L、2.5 mmol/L和5 mmol/L.由图4可以观察到,在Lane0中只有少量DNA切割分离,形成FormⅡ;在Lane1~3中,随着金属配合物浓度的依次递增,其FormⅡ也随之依次递增,同时FormⅠ依次递减;由此可以说明:金属配合物对pBR-322质粒DNA存在一定的断裂能力,与紫外和荧光效果一致.
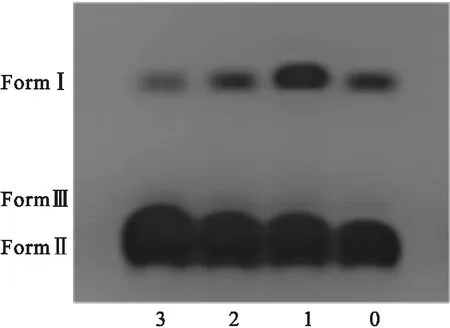
图4 金属配合物对pBR322质粒DNA的断裂效果Fig.4 Coordination polymer cutting plasmid pBR-322 DNA renderings
4 结 论
实验合成了钯(Ⅱ)与吡啶-2,3-二羧酸、2-氯-L-苯丙氨酸的配合物[Pd(2,3-H2pydc)(L-2-Cl-Phe)],通过核磁手段对金属配合物进行了表征,证明合成的金属配合物确为预期目标产物.紫外光谱图研究表明配合物与CT-DNA产生嵌插作用.荧光光谱图研究表明配合物能与EtBr竞争嵌入DNA碱基对中.琼脂糖凝胶电泳实验表明配合物对pBR-322质粒DNA有一定的切割断裂作用,这与紫外和荧光光谱测定的结论一致.

