花生MAPK13基因的克隆及表达分析研究
梁 丹,张朝昕,王 冕*,吴正锋,陈 娜,潘丽娟,王 通,陈明娜,杨 珍,禹山林,迟晓元*
(1. 山东省花生研究所,山东 青岛 266100; 2.青岛市市容环境卫生管理中心,山东 青岛 266100)
花生(ArachishypogaeaL.),是世界范围内广泛种植的油料和经济作物。我国是世界花生生产和消费大国,花生总产量和出口量均占世界第一[1]。花生适宜种植在疏松的沙土地上,适应性较强。但是因其地下结果的特性,容易受到土传病害的影响。已报道的花生土壤侵染性病害有多种,包括真菌性病害、细菌性病害和线虫病害等,其中由真菌病害感染导致的果腐病给花生生产带来极大危害,其一旦发病就造成作物成片死亡,荚果腐烂,防治艰难,给花生产量和品质带来极大威胁[2]。
研究证明植物在长期与病原物互作的进化过程中,获得了应答病原物侵染的感知和转导能力,并通过协同进化,逐渐建立了一整套防御机制来抵抗病原物的侵入,最终获得了植物的抗病性[3]。该过程中涉及到植物对病原的信号识别、传递、抗病基因的激活以及表达等[4]。
植物与病原物的信号传递与植物激素及信号分子密切相关。植物激素以一类低浓度存在的小信号分子参与到植物生物胁迫的信号传递过程[5-6]。如ABA与植物的抗旱、耐盐等非生物胁迫密切相关[7];水杨酸(SA)介导植物对病原菌的免疫翻译,是植物系统获得性抗性过程的关键激素;茉莉酸(JA)需要和乙烯(ET)信号途径的共同参与,主要调节植物对腐生菌的抗性等[8-9];赤霉素(GA)参与植物生长和发育,是一类重要的抗逆相关激素[10];H2O2作为重要的信号分子参与植物的氧化胁迫反应[11]。
研究发现,植物的抗病基因具有同源序列和保守的结构域,这些结构在外源信号识别和信号传导中起重要作用,其中序列高度保守的蛋白激酶通过蛋白质的磷酸化与去磷酸化方式参与植物细胞信号传导过程[12]。蛋白激酶根据其磷酸化底物蛋白的不同氨基酸残基类型可分为5大类,其中研究较多的是促丝裂原活化蛋白激酶家族(Mitogen-activated protein kinases,MAPKs)。MAPKs存在高度保守的T-X-Y基序,是一类保守的Ser/Thr/Tyr双重特异性蛋白激酶[13]。植物MAPK分为四个家族(A-D),其中以拟南芥中的MAPKs为例,AtMAPK3、AtMAPK6、AtMAPK10属于A组,含有TEY保守基序;AtMAPK4、AtMAPK5和AtMAPK11-13属于B组,含有TEY保守基序;AtMAPK1-2、AtMAPK7和AtMAPK14属于C组含有TEY保守基序;AtMAPK8-9和AtMAPK15-20属于D组含有TDY保守基序,不同结构决定MAPKs参与不同的生物学过程[14]。
许多研究表明,MAPK参与各种植物激素(ABA、JA、ET、SA等)、低温、高盐、干旱、UV等非生物胁迫信号的传递、病原体信号的传导、植株的生长和发育等生物学过程[15]。其中拟南芥MAPK13基因在其各组织中的表达量都很低;黄瓜中MAPK13基因在受到病原物侵染时表达量下降,在热诱导时表达量上升[16];棉花中MAPK13基因被证明参与病原菌的信号传递过程[17]。
目前关于MAPK的研究依旧是逆境信号转导方向的热点,MAPK级联途径在不同的植物、动物和微生物中的功能不断得以明确。但是花生中抗性相关的基因克隆与功能研究还处于起步阶段,有关MAPK级联途径的研究报道更少,仅有少数的MAPK基因被克隆出来,尤其关于花生MAPK13基因的研究还未见报道。
前期本课题组,参考花生的两个二倍体野生种和四倍体栽培种的基因组序列信息,对果腐病花生籽仁的转录组测序结果进行分析,从花生抗病相关途径中筛选出关键基因MAPK13。对该基因进行全长克隆和序列分析发现,其氨基酸序列上存在MAPK家族典型TEY的结构域;并进行了亚细胞定位;利用RT-qPCR检测其在不同花生组织的表达量,及其在各种非生物胁迫(ABA、GA、SA、JA、ET、H2O2、高盐、干旱、低温)诱导下的表达量。本研究将为阐明花生抗病的分子调控机制提供理论依据。
1 材料与方法
1.1 植物材料与处理
供试品种花育20号,由本课题组育成并保存。花生种子经无菌水清洗,浸泡3h后,点播于水培培养箱中,置于恒温培养箱中培养,光周期为16h光照/8h黑暗,培养温度25℃。花生不同组织表达模式分析采用的材料分别为根、茎、叶、花、子叶和下胚轴,其中根、茎和叶取自花生4叶期的幼苗,花取自盛花期的花生植株花瓣,子叶取自成熟期的鲜花生种子,下胚轴取自催芽露白时的花生种子胚。
基因克隆:于水培培养箱中长到4叶期,取叶片提取RNA,反转录合成cDNA,为克隆基因的模板。不同植物激素浓度分别为SA(2mmol/L)、ET(100μmol/L)、JA(100μmol/L)、GA(100μmol/L)和ABA(100μmol/L),取样时间分别为处理后:0、4、8、12、24、36和72 h;H2O2处理时,取4叶期的幼苗,将浓度为2 mmol/L的溶液2 mL涂抹于叶片上,剩余溶液灌根;盐胁迫和干旱胁迫处理时,取4叶期的水培幼苗,将根分别浸泡于200 mmol/L NaCl和15% PEG 6000溶液中,取样时间分别为浸泡后:0、4、8、12、24、36和72 h;ABA处理下以相同浓度乙醇作为对照,其他处理则以清水作为对照。基因亚细胞定位试验采用的材料为本生烟(Nicotianabenthamiana),种子由青岛生工生物工程有限公司提供。将烟草种子播种于土壤中,在恒温培养箱中培养,光周期为16h光照/8h黑暗,培养温度25℃,待3叶期时取烟草叶片作为试验材料。
1.2 质粒和菌株
大肠杆菌(EscherichiacoliDH5α、TOP-10),农杆菌(Agrobacteriumtumefaciens、GV3101)感受态,为本实验室保存,pEasy-T购买自Transgen生物科技有限公司,PMD18-T simple、PMD19-T购自宝生物工程(大连)有限公司TaKaRa,载体pCAMBIA-1300(Kana抗性,潮霉素筛选)来自本实验室保存。
1.3 工具酶及主要实验试剂
所用分子生物学试剂和生化试剂等分别购自美国Promega、Sigma、宝生物工程(大连)有限公司TaKaRa、天根、台湾生工等公司。反转录试剂盒为TaKaRa公司生产,质粒提取试剂盒购自Omega公司,RNA提取用TRIZOL Kit为Life Technology公司产品,RNeasy Plant Mini Kit为Clontech公司产品,cDNA纯化试剂盒Wizard DNA Clean-up System购于Promega公司。其他所用RNase、抗生素和普通化学试剂均为国产分析纯。
1.4 DNA生物信息学分析软件和网络资源及数据库
DNAMAN软件进行序列分析、比对与同源性比较;MEGA 4.0软件用于构建系统进化树;GraphPad Prism软件用于数据分析作柱状图。
1.5 RNA提取和cDNA合成
按照RNeasy Mini Kit试剂盒(天根生化科技(北京)有限公司)操作步骤提取花生样品总RNA,用Pultton P100超微量分光光度计(Plextech,美国)测定提取的RNA浓度后,按照M-MLV反转录试剂盒(天根生化科技(北京)有限公司)步骤,合成第一链cDNA:将2μg RNA加入反应体系,至总体系为20μL,PCR扩增条件为42℃延伸1 h,0℃保存15 min。合成后cDNA于-20℃保存备用。
1.6 基因全长克隆
根据转录组文库中已知AhMAPK13基因的编码区序列,设计3′端特异引物k13-3P1和k13-3P2,与B26和B25进行3′ RACE巢式PCR,PCR反应体系:引物各1μL,1μL cDNA模板,10μL LATaqTMmix和7μL ddH2O,共计20μL。PCR扩增程序中第一轮扩增:94℃预变性5min;94℃变性30s,56℃退火30s,72℃延伸30s,25个循环;72℃延伸10min;15℃保存。第二轮扩增:94℃预变性5min;94℃变性30s,55℃退火30s,72℃延伸30s,35个循环;72℃延伸10min;15℃保存。
设计5′端特异引物k13-5P1和k13-5P2,与AAP和AUAP进行5′RACE巢式PCR,PCR反应体系:引物各1μL,1μL cDNA模板,10μL LATaqTMmix和7μL ddH2O,共计20μL。PCR扩增程序中第一轮扩增:94℃预变性5min;94℃变性30s,55℃退火30s,72℃延伸30s,25个循环;72℃延伸10min;15℃保存。第二轮扩增:94℃预变性5min;94℃变性30s,55℃退火30s,72℃延伸30s,35个循环;72℃延伸10min;15℃保存。将克隆片段与pEASY-T1载体连接,转化大肠杆菌DH5α,涂板后筛选阳性克隆,由上海生工生物工程有限公司进行测序。将测序结果与中间片段进行序列比较,确定所得片段为目的基因的两端片段。
根据序列拼接结果设计引物,利用RT-PCR从花育20号中扩增目的基因的全长序列。PCR反应体系:引物各1μL,1μL cDNA模板,10μL LATaqTMmix和7μL ddH2O,共计20μL。PCR扩增程序:94℃预变性5min;94℃变性30s,58℃退火30s,72℃延伸1.5min,35个循环;72℃延伸10min;15℃保存。PCR产物经凝胶电泳后回收纯化。纯化产物连接至pEASY-T1载体,送至上海生工生物工程有限公司进行测序。测序结果进行序列比对,确认翻译的氨基酸序列无错误后,进行序列BLAST并分析序列信息。
1.7 序列分析及系统发育树的构建
将克隆的基因序列在NCBI(http://www.ncbi.nlm.nih.gov/)网站上利用BLAST工具进行基因序列的相似性及同源性查找,利用DNAMAN软件的Multiple Alignment对这些序列进行基因同源性的比较,用MEGA 4.0软件的Neighbour-Joining法构建系统发育树。
1.8 RT-qPCR基因表达分析
根据序列设计荧光定量引物: K13-QF和K13-QR。提取处理好的花生组织材料的RNA,经反转录得到cDNA,并稀释到8ng/μL作为模板,利用荧光定量试剂盒(Everbright®Inc.,美国)进行定量PCR检测基因表达图谱。反应体系:10μL 2SYBR Premix,2μL cDNA模板,200nmol/L引物各0.4μL和7.2μL ddH2O,共计20μL。PCR反应用罗氏的荧光定量PCR仪Light Cycler 2.0 instrument system(Roche,Germany)进行,反应程序:95℃预变性10s;95℃变性 5s,60℃退火30s和72℃延伸10s,40个循环;60℃退火30s;72℃延伸10s。PCR反应在65℃下绘制溶解曲线,温度每10s上升0.5℃。由LightCycler软件自动生成Baseline和quantification cycles(Cq)。每个PCR反应均进行三次重复实验,每次PCR反应均设定无模板的阴性对照。所用内参基因为花生Actin11,本研究中所有使用的引物详见表1。
1.9 植物表达载体的构建
用带有酶切位点的引物扩增基因序列,PCR产物回收后与pMD18-T simple载体进行连接,转化大肠杆菌DH5α,挑取阳性克隆进行测序验证。序列正确的菌株进行扩大培养后提取质粒,用BamHI/XbaI双酶切质粒和空载体质粒,将酶切产物与pCAMBIA-1300空载体用T4连接酶连接在一起,构建pCAMBIA-1300-AhMAPK13表达载体,连接后转化大肠杆菌,挑取阳性克隆进行测序验证。验证阳性的菌株扩大培养后提取质粒,转化农杆菌备用。DNA片段与pMD18-simple载体的连接体系:pMD18-simple 1μL,DNA回收片段4μL(-50ng),SolutionI(TaKaRa,日本)5μL,共10μL,反应混和液于16℃下连接过夜(约12~16h)。PMD18-T simple和pCAMBIA-1300载体的酶切反应体系:质粒10μL,Buffer 5μL,XbaI 1μL,HamHI 1μL,ddH2O 34μL,共计50μL。将反应混和液于37℃温育6h。取1μL酶切反应液,用1%琼脂糖凝胶电泳检测酶切结果,并估测载体和DNA片段的大小,该酶切反应液可直接用作连接。
1.10 烟草叶片瞬时表达及亚细胞定位分析
将准备好的农杆菌扩大培养至100mL,在培养基中加入150μmol/L乙酰丁香酮(acetosyringone,AS),按照1:100转接,于28℃培养16h。收集菌体,用Infiltration Buffer(MS,10mmol/L MES medium,pH5.6,150μmol/L AS)重悬农杆菌至OD600=0.5~0.6。取培养好的3叶期烟草叶片,用一次性注射器将农杆菌菌液注射到烟草叶片背面,于阴暗处放置约2~5 d后进行观察。于注射部位周围取约1cm2的材料,于Olympus FV300激光共聚焦显微镜(Olympus,日本)下观察,使用Olympus DP26数码相机(Olympus,日本)拍照。

表1 AhMAPK13基因克隆引物
2 结果与分析
2.1 AhMAPK13基因的克隆
本研究基因筛选来自转录组测序数据,所有序列保存成FASTA格式(GeneBank Accession No. PRJNA302339)。根据KEGG富集通路中的结果,筛选出MAPK途径进行克隆,为花生抗果腐病研究提供基因基础。根据已知序列设计引物(K13-F和K14-R)进行编码区克隆。利用RACE-PCR扩增出3′端DNA片段约600 bp和5′端DNA片段约150 bp(图1)。两端片段与编码区片段进行序列比较表明所得片段为目的基因的两端片段。根据所获得的中间片段、5′片段和3′片段拼接出AhMAPK13基因的全长cDNA序列,PCR扩增得到2000 bp左右的片段。同时得到编码区全长1000 bp片段。序列分析结果表明,该PCR片段为目的基因片段(图2)。

图1花生MAPK133′和5′片段的PCR扩增
Fig.1 Isolationof3′and5′fragmentofgeneAhMAPK13inpEasy-T
图2花生AhMAPK13全长和ORF全长的PCR扩增
Fig.2 IsolationofgenefulllengthandfullORF fragmentofgeneAhMAPK13inpEasy-T
注:QC:基因全长;M:Marker;ORF:基因编码区。
Note:QC:thefulllengthofgene;M:Marker;ORF:theORFsequenceofgene.

图3 AhMAPK13与其他物种中MAPK13蛋白质序列的同源比较Fig.3 Alignment of the deduced AhMAPK13 protein sequence with other known plant MAPK13s注:大豆(GmMAPK13:XP_003538034.1),柑橘(CcMAPK13:XP_006424692.1),梨(PbMAPK13:XP_009358274.1),拟南芥(AtMAPK13:NP_001030990.1),花生(AhMAPK13:KP329552),野生花生(AiMAPK13:XP_016187360.1)。用DNAman软件进行序列比对,相同的氨基酸序列用黑色部分表示。I~XI表示MAPK的11个保守的催化结构域。A-Loop用下划线标出。
Note:Glycinemax(GmMAPK13:XP_003538034.1);Citrusclementina(CcMAPK13:XP_006424692.1);Pyrusxbretschneideri(PbMAPK13:XP_009358274.1);Arabidopsisthaliana(AtMAPK13:NP_001030990.1);Arachishypogaea(AhMAPK13:KP329552);Arachisipaensis(AiMAPK13:XP_016187360.1).ThesesequenceswerealignedusingtheDNAmanprogram.Identicalandsimilaraminoacidswereshadedinblack.Theportionkinasesubdomainsareshownwithnumerals(ItoXI)onthebottomofthesequences.Activation-loopwasunderlined.
2.2 AhMAPK13基因编码的蛋白序列分析
对获得全长序列进行分析表明,序列全长1818 bp,含有3′非编码区593 bp,5′非编码区122 bp,编码区全长1104 bp,编码一条含有368个氨基酸的蛋白序列。预测其分子量为42.5kDa。氨基酸的序列比对发现其序列中含有MAPK家族典型的特异性11个保守区域,和特异性的N端T-Loop保守基序和TEY基序,与B组的MAPK13同源性较高,达到80%以上,认为AhMAPK13属于B组,因此将基因命名为AhMAPK13,并且序列提交到GenBank,获得序列号:KP329552。利用DNAman软件,对不同来源的MAPK13蛋白进行同源性分析,结果显示AhMAPK13与已知的野生种花生AiMAPK13、拟南芥中的AtMAPK13、大豆中的GmMAPK13、梨中的PbMAPK13和柑橘中的CcMAPK13的同源性较高,分别为100%、91.42%、88.47%、84.82%和81.13%(图3)。利用MEGA软件对来自于不同植物的MAPK13蛋白进行分子聚类分析,构建同源进化树(图4)。结果显示,栽培种花生MAPK13基因与野生花生、大豆中的MAPK13基因的亲缘关系最近,同时与拟南芥、柑橘等植物中的亲缘关系也较近,说明该基因在同源进化上具有高度的保守性。
2.3 AhMAPK13蛋白亚细胞定位
观察GFP基因的定位结果显示,转入空载体的GFP在细胞的核和质中均有定位,且AhMAPK13-GFP在细胞核和细胞质中均有绿色荧光,表明AhMAPK13基因可能在细胞核和细胞质中都发挥重要功能(图5)。
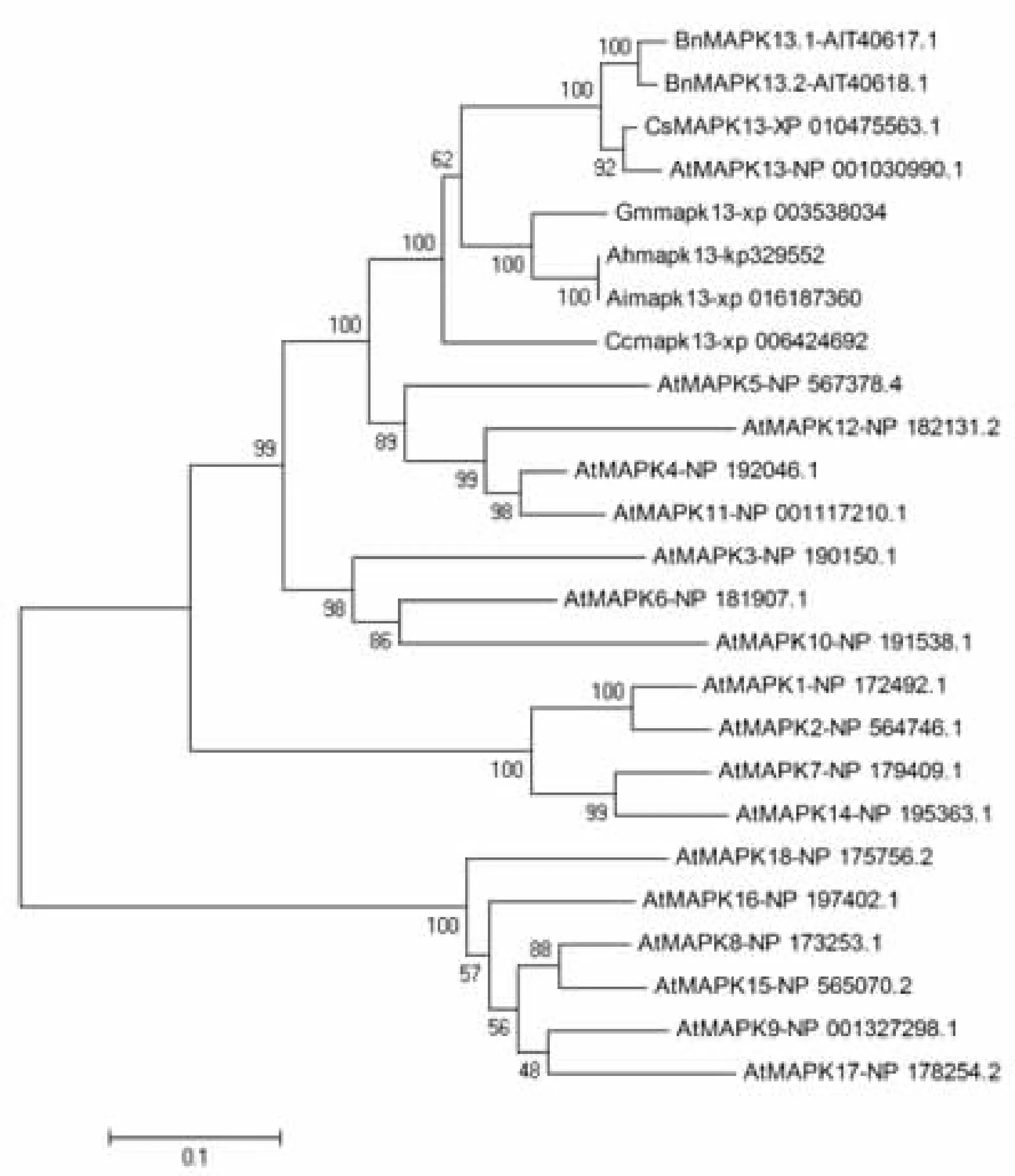
图4 AhMAPK13与其他物种中MAPK13蛋白质序列的聚类分析Fig.4 Alignment and dendrogram of the deduced AhMAPK13 protein sequence with other known plants MAPK13s注:At,拟南芥;Gm,大豆;Cc,柑橘;Ai:野生花生;Pb,梨;Cs,亚麻荠;Bn,油菜;Ah:花生。Note: At:Arabidopsis thaliana; Gm:Glycine max; Cc:Citrus clementina; Ai:Arachis ipaensis; Pb: Pyrus x bretschneideri; Cs: Camelina sativa; Bn: Brassica napus; Ah:Arachis hypogaea.

图5 AhMAPK13-GFP在烟草叶片中的亚细胞定位 Fig.5 Subcellular localization of AhMAPK13-GFP in the leaves of tobacco 注:空载体GFP蛋白的表达为对照。Note: The expression of GFP was used as control.
2.4 AhMAPK13基因的组织特异性分析
RT-qPCR检测结果显示,AhMAPK13基因在茎中表达最高,在根和叶中表达次之,在花、子叶和下胚轴中表达量极低,这说明该基因可能在花生茎、根和叶等组织中发挥重要的作用(图6)。

图6 AhMAPK13基因在花生不同组织中的表达分析Fig.6 The expression analysis of AhMAPK13 in different peanut tissues
2.5 AhMAPK13基因在植物激素和信号分子诱导下的表达分析
图7-A可知,在ET诱导下,AhMAPK13基因的表达量呈现显著上调的表达模式,在处理8h表达量达到最高,上调倍数在15倍以上;在JA诱导下,AhMAPK13基因的表达量呈先上调再下调的表达模式,在诱导处理4 h时表达量达到最高,上调倍数在5倍以上;在SA、GA诱导下,AhMAPK13基因的表达量均呈上调的表达模式,在诱导处理12 h时表达量均达最高,上调倍数分别在5倍和10倍以上;在信号分子H2O2处理下,AhMAPK13基因的表达量表现为下调的表达模式。这些结果表明该基因可能参与ET、JA、SA、GA的激素调控网络,不参与或者负调控参与信号分子H2O2的调控网络。
2.6 AhMAPK13基因在ABA诱导、低温、干旱和盐胁迫下的表达分析
由图7-B可知,在ABA诱导下,AhMAPK13表现为上调,且在诱导处理8 h时表达量最低,推测该基因可能参与ABA介导的干旱调控途径中,并可能起到负调控作用。
在PEG模拟干旱胁迫处理下AhMAPK13基因表达量表现为下调模式,胁迫处理1 h时表达量最低;在NaCl胁迫处理下AhMAPK13基因表达量呈先上调后下调的变化趋势,且在胁迫处理2h时表达量最高。综上表明,AhMAPK13基因在干旱和盐胁迫下的表达模式存在差异,且对盐胁迫更敏感。
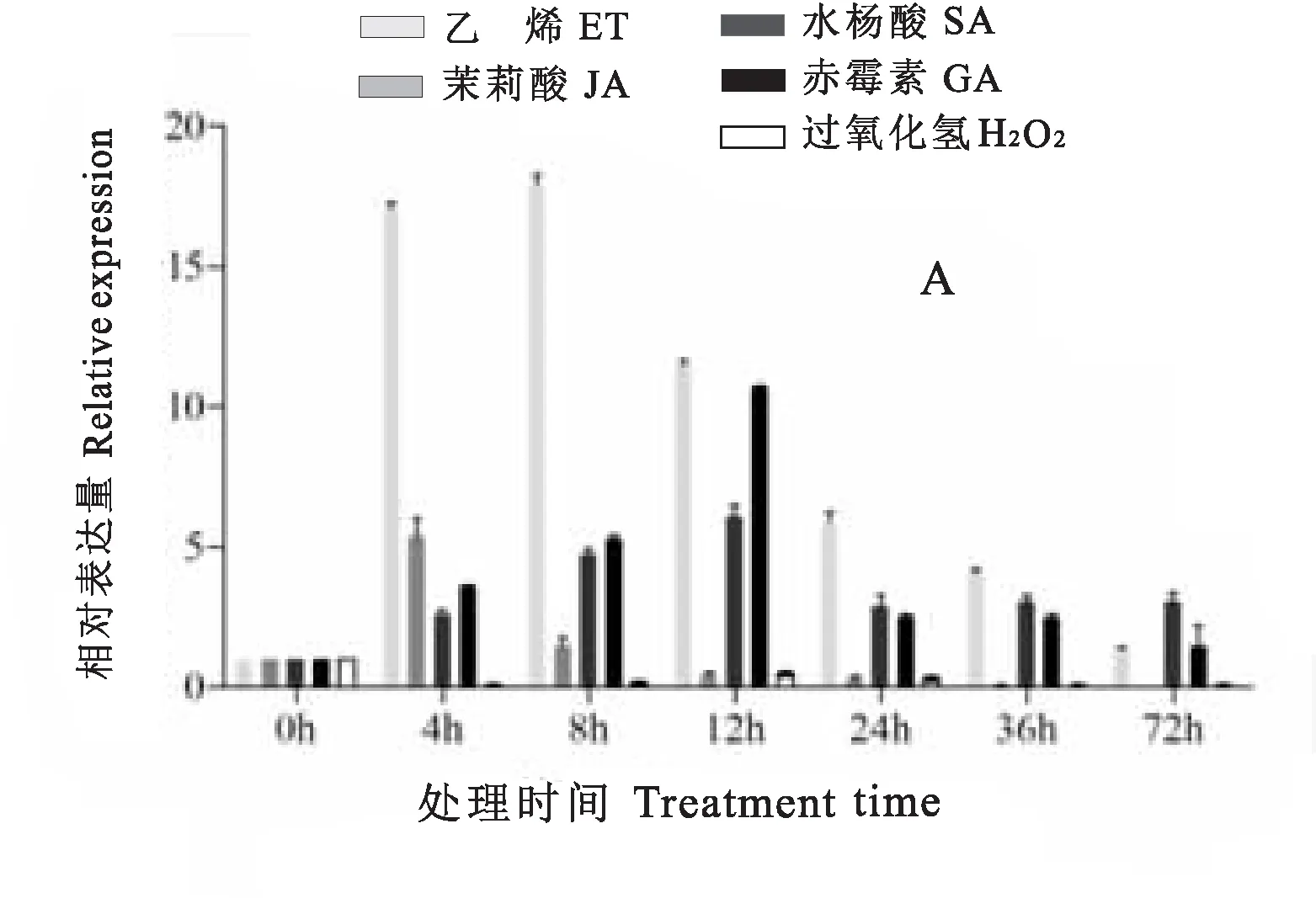

图7 花生AhMAPK13基因表达特异性分析Fig.7 Expression patterns of AhMAPK13
3 讨 论
前期本课题进行了花生果腐病转录组测序,测序结果上传GenBank数据库(GeneBank Accession No. PRJNA302339)。从差异表达基因的功能注释发现,花生响应果腐病过程中,MAPK家族中差异表达的基因有11个,其中MAPK13在棉花、黄瓜抗逆过程中的功能已有报道[16-17],参与植物与病原物互作,因此本研究推测其可能在响应花生果腐病过程中具有重要作用。已有研究表明,在拟南芥中已经克隆得到20个MAPK家族基因,它们被证明参与植物生长的各个方面[18]。
目前已经从植物中成功分离到了很多MAPK基因,例如:拟南芥、棉花、水稻、杨树、玉米中分别有20、28、17、21、21个MAPK基因[18-22]。本研究克隆得到的AhMAPK13序列含有MAPK家族特异的11个保守结构,并且与B组的MAPK13同源性较高,达到80%以上,认为AhMAPK13属于B组。分析其序列发现,该基因与野生花生序列基本相同,与其他植物的MAPK13序列相似性很高,说明该基因的序列具有高度保守性,因此推测该基因在功能上也与其他植物中MAPK13基因的功能相似。
植物MAPK参与多种信号的传递,对MAPK基因的亚细胞定位研究有利于了解其在信号转导中的作用。由于MAPK序列N端的特殊结构,使得MAPK的定位也不同。已有研究表明,MAPK可以定位于细胞核和细胞质中,例如:棉花MAPK2基因定位于细胞核[23]。本研究构建了AhMAPK13的GFP表达载体,在烟草的瞬时表达过程中发现,该基因定位在细胞核和细胞质中,这表明该基因可能在细胞质和细胞核中起作用。
研究表明,植物MAPK作为MAPK级联途径中的下游组分,容易受到多种环境的刺激,引起植物的自身免疫反应来应答刺激。本研究结果表明,花生AhMAPK13基因在茎和根、叶等组织中高表达,而在花、子叶和下胚轴中表达极低,这可能是花生的根和茎在花生发生果腐病病原菌侵染时更为敏感,当土壤中病原菌数量超标,茎和根系最先感知并且传递信号。植物应答环境变化过程中内源激素水平也发生变化[7,10,24]。AhMAPK6a在ABA诱导下,表达量上调;GhMAPK2受JA诱导时,表达量上调[23];黄瓜中MAPK13基因在受到病原物侵染时表达量下降,在热诱导时表达量上升[16]。
本研究中用ABA、NaCl、PEG6000和低温处理时,该基因的表达量都相应上调,说明该基因在花生响应外界胁迫时可能具有重要功能,并且可能参与到ABA介导的非生物胁迫过程。用SA、ET、JA、GA3等激素处理花生幼苗后,AhMAPK13基因的表达量均上调,不同处理条件的上调倍数和最大倍数产生时间略有差异,这说明该基因可能参与花生的生长发育过程,也可能参与花生的生物胁迫过程,而且该基因在SA和JA处理下的表达量都上调,也进一步说明该基因可能同时参与SA和JA介导的生物胁迫过程。这些结果将为进一步研究该基因的生物学功能提供理论依据。

