168例胚胎停育患者绒毛组织染色体核型分析
宋志琴,王雪松,朱雅娟,朱海燕,张海荣
胚胎停育是指在妊娠早期胚胎发育至一个阶段,由于受精卵缺陷、母体或外界等不利因素的影响而导致胚胎停止发育,超声检查常表现为枯萎卵、胚芽无心管搏动,可发展为自然流产或稽留流产,发生率占临床妊娠的15%~20%[1]。胚胎停育病因复杂,包括染色体异常、母体内分泌失调、生殖道感染、母体生殖道异常、不健康的生活方式等[2],其中环境因素和某些未知因素导致染色体畸变是其重要原因[3]。本研究通过对胚胎停育患者绒毛组织染色体核型分析,探讨胚胎停育和染色体异常的关系。
1 资料与方法
1.1 一般资料 选择2013年1月—2014年3月中国人民解放军总医院第六医学中心妇产科经B超证实胚胎停止发育的孕妇168例,其中自然受孕流产样本106例,辅助生殖受孕流产样本62例。年龄(32.9±2.4)岁,孕龄7~12周。胚胎停止发育纳入标准:①有停经史;②血尿人绒毛膜促性腺激素阳性;③B超检查:宫腔内有空孕囊或宫腔内可见胚芽或胚胎样组织,未见胎心搏动,或曾检测到胎心搏动之后消失。研究开展征得患者的知情同意并签署知情同意书,同时经过中心伦理委员会审查通过。
1.2 材料与试剂 Greiner Bio-One培养瓶(规格:25 cm2,尺寸:50 mL,德国);离心机(型号:Thermo ST16R,德国);CO2培养箱(型号:HERAcell 150i,德国);显微镜(型号:OLYMPUS CK41,日本);显微镜(型号:Leica Microsystems GSL120,德国)。完全培养基(Amnio MAX-Ⅱ 11269,美国GIBCO公司),完全培养基(BIO-AMF-2,以色列BI公司);胰蛋白酶-EDTA消化液(0.25%Trypsin-EDTA,美国GIBCO公司);双抗(Pen strep,美国GIBCO公司)。
1.3 方法
1.3.1 组织培养前处理 无菌条件下对患者进行清宫手术,得到绒毛组织标本。绒毛组织标本于超净工作台中,用无菌生理盐水洗涤3次(第1次加入10 000 U Pen strep双抗0.5 mL),去除红细胞与蜕膜组织,在倒置显微镜下观察,除去任何可疑的非绒毛组织,确认所接种的组织为绒毛。每例10~30 mg,用眼科剪将绒毛组织剪成0.5~1 mm3小块,直接加入5 mL培养液制备成细胞悬液,分别移入2个培养瓶,补充培养液至5 mL(在吸入细胞悬液时尽量避开大块组织)。
1.3.2 细胞培养 种于37 ℃ 5% CO2培养箱;培养至第6天,显微镜下观察,换新鲜培养液并传代;以后每天观察,可见较多梭形细胞聚集至少达5~6个细胞集落时,换液并继续培养24 h收获。
1.3.3 细胞收获、玻片制备及染色体核型分析 收获:秋水仙素终浓度为0.2 μg/mL,作用时间为4 h;以0.075% kcl低渗液37 ℃水浴处理5 min;3∶1固定液(甲醇∶冰醋酸)固定3次(预固定1次)。制片:取细胞固定液于每张玻片3~4滴,每个样本滴3张玻片。75 ℃烤片3 h。常规G显带:0.25% Trypsin-EDTA胰蛋白酶消化数秒;过水清洗;晾干玻片;于pH 6.7磷酸缓冲盐溶液稀释Giemsa原液(1:10稀释)进行染色。染色体核型分析:将样本于Leica Microsystems GSL120扫描,人工计数并进行分析。每例计数20个中期分裂相,分析5个细胞核型。如遇嵌合型样本加倍计数并分析。
1.4 统计学处理 采用SPSS 16.0统计分析软件,计算胚胎停育异常染色体所占比率;2组间计数资料比较采用χ2检验,以P<0.05为差异比较具有统计学意义。
2 结果
2.1 胚胎停育绒毛组织染色体培养情况 共收集168例绒毛组织,2例存在污染,1例因绒毛坏死变性,细胞生长不佳导致培养失败,165例培养成功,培养成功率为98.21%。在培养成功的165例标本中,检出异常核型90例,异常检出率为54.55%。异常核型中,常染色体三体48例,共涉及2、3、4、5、6、8、9、10、13、14、15、16、17、18、20、21、22号染色体,其中,16号染色体三体15例,占常染色体三体的31.25%(15/48);常染色体单体1例;常染色体双重三体3例;性染色体单体15例;性染色体多倍体20例;常染色体结构异常3例。
2.2 低龄孕妇与高龄孕妇异常核型分布情况 165例培养成功样本中,低龄孕妇126例,异常核型67例;高龄孕妇39例,异常核型23例;异常率分别是53.17%和58.97%,2组异常核型异常率差异比较无统计学意义(χ2=0.404,P>0.05)。但2组间异常染色体分布差异比较有统计学意义(χ2=20.236,P<0.05),其中高龄孕妇异常核型主要为常染色体三体,异常核型常染色体三体22例,占比95.65%(22/23);低龄孕妇异常核型常染色体三体28例,占比41.79%(28/67);常染色体三体异常占比高龄孕妇与低龄孕妇差异比较具有统计学意义(χ2=20.117,P<0.05)。表1。
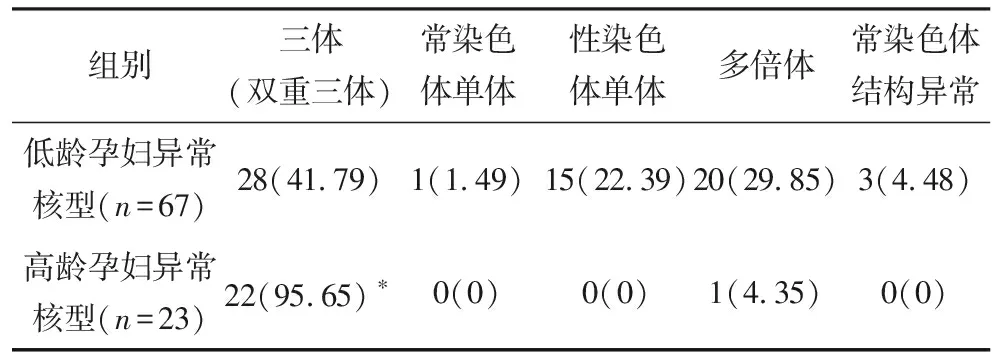
表1 低龄孕妇与高龄孕妇异常核型分布情况[n(%)]
注:与低龄孕妇比较,*P<0.05
2.3 自然受孕与辅助生殖受孕流产标本染色体异常情况 165例培养成功样本中,自然受孕流产样本103例,染色体异常58例,染色体异常率为56.31%;辅助生殖受孕流产样本62例,染色体异常33例,染色体异常率为53.23%,2组染色体异常率差异比较无统计学意义(χ2=0.181,P>0.05)。
3 讨论
鉴于早孕期胚胎停育的绒毛组织不同程度上存在变性坏死,本研究在胚胎停育绒毛组织的培养前处理过程中,没有采用以往报道的胶原酶或胰酶处理方法[4-6],而是采用机械剪碎法直接进行绒毛细胞培养、制备染色体,培养成功率达98.21%(165/168)。证明该方法既操作简便、结果稳定,又可以省去胶原酶或胰酶的高额费用,凡具有CO2培养箱的实验室都可以进行,有利于在基层医院开展。
复发性流产和胚胎停育是妇产科常见疾病,其中50%~60%的早期自然流产与胎儿的染色体异常有关,也有报道认为染色体异常的实际情况可能明显高于这个比例,只是受常规细胞遗传学方法的局限影响了检出率[7-9]。本研究培养成功的绒毛组织染色体核型分析中异常发生率为54.55%,包括多倍体、三体、单体以及结构异常。其中,非整倍体核型占77.78%,常染色体三体占56.67%,是染色体数目异常的最主要表现形式,稍高于孙义锡等[10]研究中的41.58%。常染色体三体中,以16、20、21和22号染色体三体最多见,其中,16号染色体三体最多,约占常染色体三体的31.25%。分析原因为大多数染色体三体会在胚胎时期死亡,即使存活的病例中也会出现各种畸形、智力低下、生育力异常等表现。一般来说,常染色体异常比性染色体异常对基因组的组成以及胚胎的发育所造成的影响大很多。因16号染色体比20、21和22号染色体携带更多的基因,一旦出现16号染色体三体,胚胎常常在较早期就会停止发育而导致胚胎死亡,有人称这种染色体是高度致死的三体。而部分20、21和22号染色体三体却可以继续发育甚至到足月儿分娩,所以在胚胎停育的流产中,常以16号染色体三体为多见。本研究中有12例三倍体,主要是由于双雄或双雌受精后,因有丝分裂分离失调而形成异常受精卵所致,多在胚胎期死亡而流产。通过流产绒毛组织染色体核型分析,可以明确胚胎遗传物质异常的类型,为遗传咨询提供准确地分析依据,对帮助不良妊娠史夫妇建立自信并指导其再次妊娠有重要意义。
非整倍体大多由卵母细胞减数分裂中染色体不分离造成,即在减数分裂I期或减数分裂Ⅱ期成对的染色体不分离,孕妇年龄是明确的高危因素之一[11]。表1可见,本研究中高龄孕妇染色体异常率高于低龄孕妇,从异常核型分布看,高龄孕妇的异常核型主要为常染色体三体,占比95.65%(22/23);低龄孕妇异常核型常染色体三体28例,占比41.79%(28/67);但常染色体三体异常占比高龄孕妇与低龄孕妇差异比较具有统计学意义,与文献报道相符[12-13]。提示年龄风险作为高危因素应该受到产科临床的关注,在母婴保健法中将年龄作为产前诊断的惟一风险因素是非常重要的。
X染色体单体(Turner综合征)在活产女婴中的发生率为1/(2 500~3 000),在早期自然流产中较为常见,占流产组织异常的20%,仅次于常染色体三体(50%~55%),其发生的原因是性染色体不分离,但与母亲年龄无关。研究证实,绝大多数单条的X染色体来源于母亲,提示染色体不分离的事件发生于父方,与母亲年龄无关[14]。本研究检测到90例异常核型中,X单体核型15例,占总异常妊娠的16.67%;值得注意的是,15例X单体均发生在低龄孕妇中,占低龄孕妇异常妊娠的22.39%,也证明了与母亲年龄无关。本研究在自然受孕与辅助生殖受孕流产标本中,异常染色体率比较差异无统计学意义,与文献报道一致[15]。
综上所述,自然流产的发病率日趋升高,原因是多方面的,其主要原因为胚胎染色体异常。目前,由于操作难度大、成本高等原因,仅有少数实验室能够开展。随着这一技术的不断完善,操作难度及成本都在下降,基层医院的普通临床实验室均可以开展。建议不孕不育门诊或产科医生提示自然流产夫妇进行胚胎停育绒毛组织的染色体检查,寻找胚胎停育病因,进而明确胚胎遗传物质异常的类型,为遗传咨询提供依据。

