IGF-1和PPARγ在不同猪种皮下脂肪中的差异表达研究
陶 璇,顾以韧,梁 艳,杨雪梅,钟志君,杨跃奎,陈晓晖,曾 凯,吕学斌
(四川省畜牧科学研究院,动物遗传育种四川省重点实验室,四川 成都 610066)
脂肪组织不仅是动物机体能量储存的一种形式,还参与调节包括食欲和能量消耗等多个机体功能,且对繁殖、炎症和免疫反应等多个复杂的生理过程也有重要调控作用[1]。研究猪的脂肪代谢不仅有利于改善其胴体和肉质性能,还有助于推动人类肥胖和代谢性疾病的研究。
研究证实,胰岛素样生长因子1(IGF-1)是与动物生长、发育等密切相关的主要内分泌激素之一[2],它能刺激多种细胞的增殖和分化,包括前脂肪细胞[3],促使体脂的合成,而且前脂肪细胞和脂肪细胞都能分泌IGF-1。通过对脂肪形成的调节作用,IGF-1被认为是对脂肪组织起调节作用的主要因子之一[4]。过氧化物酶体增殖物激活受体γ(PPARγ)也是脂肪生成的重要调节因子,它可增强脂滴聚集,促进脂肪细胞分化、增殖和成熟脂肪的形成,对维持动物体内脂类代谢内环境的稳定具有重要作用[5-7]。
鉴于此,本试验以外种猪大约克夏猪和四川省地方猪种丫杈猪、内江猪、成华猪、青峪猪、雅南猪、藏猪为研究对象,采用荧光定量PCR技术检测IGF-1和PPARγ在不同猪种背部皮下脂肪中的表达差异情况,研究其与胴体及肉质相关性状的相关性,为进一步探明不同猪种脂肪沉积能力及肉质差异形成的分子机制、改善猪胴体和肉质性能提供基础数据。
1 材料与方法
1.1 试验材料
试验于2015年4—10月在四川省畜牧科学研究院种猪科研基地进行。7个猪种包括引进猪种大约克夏猪和6个四川省地方猪种(丫杈猪、内江猪、青峪猪、雅南猪、成华猪、藏猪),每个猪种随机选取3头健康断奶仔猪(30日龄),共计21头,同一时间开始组建群体,相同品种同栏饲养,采用相同营养水平和饲喂方式,达到6月龄进行屠宰,屠宰前停食24 h,自由饮水。屠宰后迅速采集倒数3~4肋骨间对应处的背部皮下脂肪组织和背最长肌。
1.2 表型指标测定
体脂率和3点平均背膘厚参照“《猪胴体性状测定技术规范》(NY/T 825—2004)”的方法测定并计算,肌内脂肪含量采用瑞士步琪(BUCHI)全自动快速抽提仪,参照国家标准“《肉与肉制品游离脂肪含量测定》(GB/T 9695.1—2008)”要求进行测定,单不饱和脂肪酸、多不饱和脂肪酸含量按“《食品安全国家标准食品中脂肪酸的测定》(GB 5009.168—2016)”的方法测定。
1.3 总RNA提取和QRT-PCR
脂肪组织的RNA按照miRNeasy Mini Kit(Qiagen,China)的操作说明书提取,QRT-PCR采用miS-cript II RT Kit(Qiagen,China)根据操作说明将RNA转录成cDNA,采用miScript SYBR®Green PCR Kit(Qiagen,China)在 CFX96 Real-Time PCR Detection System(Bio-Rad,USA)仪器上进行荧光定量检测,每个反应体系20 μL。ACTB和TOP2B作为mRNA定量的内参基因,引物信息见表1。所有目的mRNA定量结果均通过熔解曲线分析验证PCR产物的特异性,确保产物无引物二聚体,每个样本重复3次,每次检测含3个阴性对照。采用2-ΔΔCt法计算目的mRNA的相对表达量。
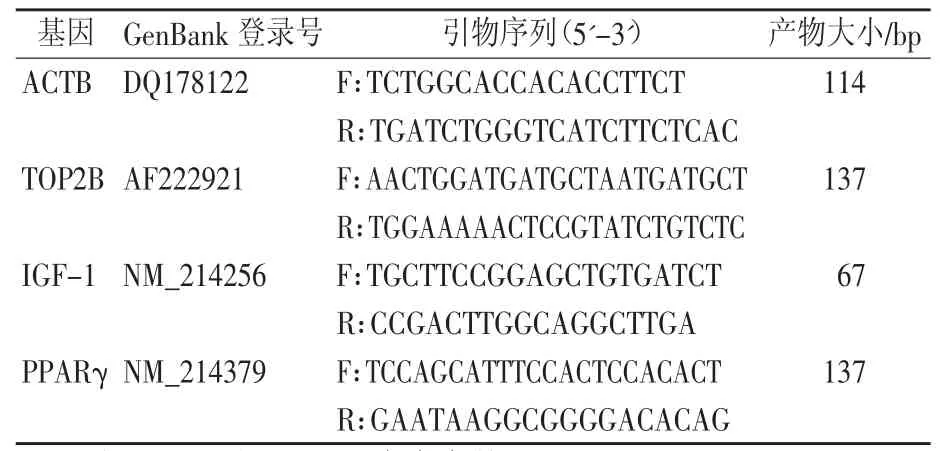
表1 引物信息
1.4 数据统计分析
运用GeNorm软件计算看家基因的归一化因子NF(Normalization factor)值,以目的基因的拷贝数与对应样本的NF值的比值表示基因的相对表达量。采用SigmaPlot 12.5软件对性状指标和基因相对表达量进行统计分析(ANOVA),结果以“平均数±标准差”表示,并分析胴体及肉质性状和基因相对表达量间的相关性。
2 结果与分析
2.1 胴体及肉质性状测定
由表2可知,在7个猪种中,大约克夏猪体脂率最低,极显著低于其它6个地方猪种(P<0.01),地方猪种之间差异不显著(P>0.05),丫杈猪最低,内江猪最高;大约克夏猪平均背膘厚最小,雅南猪其次,内江猪最大,大约克夏猪平均背膘厚显著或极显著小于青峪猪(P<0.05)、内江猪和藏猪(P<0.01),6个地方猪种中,雅南猪平均背膘厚显著小于内江猪、青峪猪和藏猪(P<0.05);大约克夏猪肌内脂肪含量最低,极显著低于除青峪猪和成华猪之外的地方猪种(P<0.01),6个地方猪种中内江猪肌内脂肪含量最高,青峪猪最低;单不饱和脂肪酸含量丫杈猪最高,青峪猪其次,大约克夏猪最低,显著或极显著低于除雅南猪之外的其余5个地方猪种(P<0.05或P<0.01),6个地方猪种中,丫杈猪、青峪猪极显著高于雅南猪(P<0.01);多不饱和脂肪酸含量大约克夏猪极显著高于地方猪种(P<0.01),6个地方猪种间差异不显著(P>0.05)。
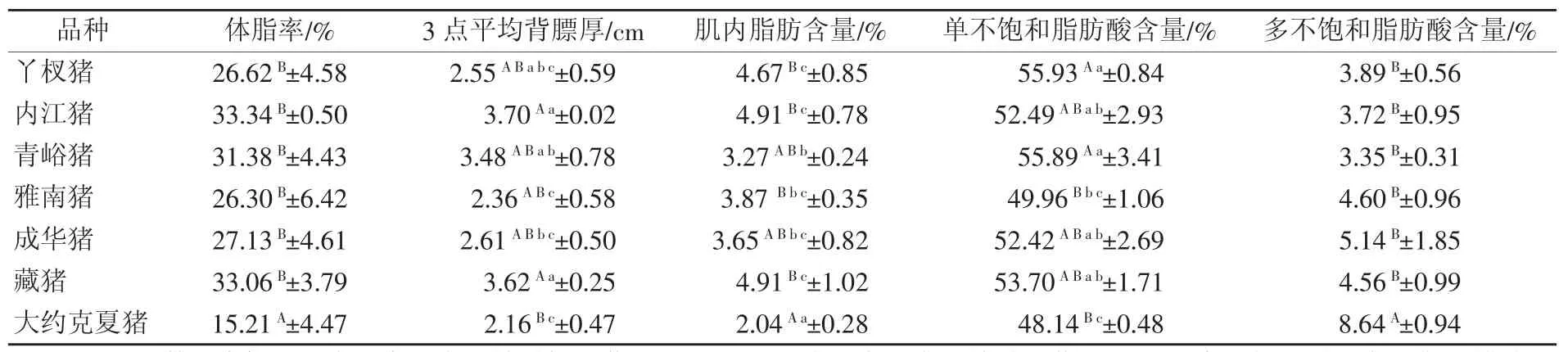
表2 不同猪种相关胴体及肉质性状测定结果
2.2 IGF-1、PPARγ表达量
由表3可知,大约克夏猪IGF-1相对表达量显著高于藏猪(P<0.05),极显著高于其余地方猪种(P<0.01),地方猪种中藏猪IGF-1相对表达量显著高于丫杈猪、内江猪、青峪猪(P<0.05),内江猪最低;大约克夏猪PPARγ相对表达量极显著高于青峪猪、藏猪(P<0.01),显著高于雅南猪(P<0.05),与其余地方猪种差异不显著(P>0.05),地方猪种中成华猪最高,青峪猪最低,成华猪、丫杈猪显著高于青峪猪和藏猪(P<0.05)。
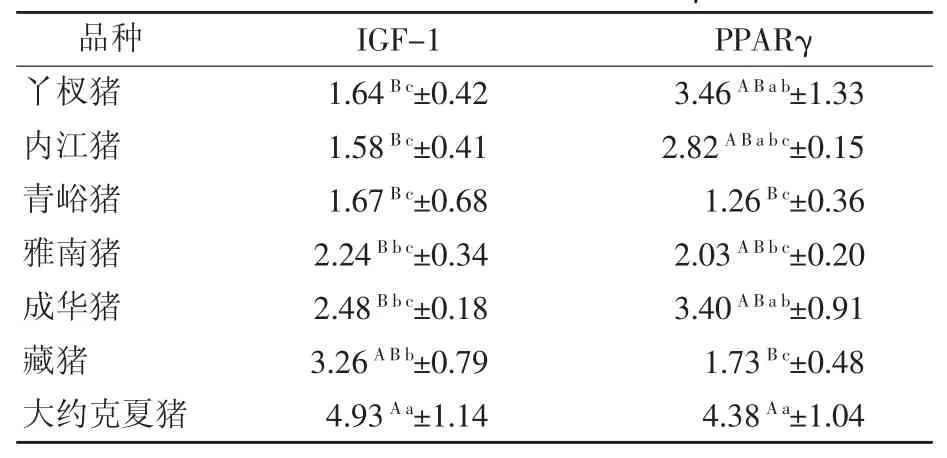
表3 不同猪种背部皮下脂肪IGF-1、PPARγ相对表达量
2.3 IGF-1、PPARγ表达量与胴体、肉质性状的相关性
采用SigmaPlot 12.5分析了2种mRNA表达量与胴体、肉质相关性状的相关性。由表4可知,IGF-1与体脂率和单不饱和脂肪酸含量呈极显著负相关(P<0.01),与平均背膘厚呈负相关(P>0.05),与多不饱和脂肪酸含量呈极显著正相关(P<0.01),与肌内脂肪含量呈负相关(P>0.05);PPARγ与多不饱和脂肪酸含量呈极显著正相关(P<0.01),与平均背膘厚呈负相关(P>0.05),与体脂率和肌内脂肪含量呈显著负相关(P<0.05),与单不饱和脂肪酸含量呈负相关(P>0.05)。

表4 IGF-1、PPARγ表达量与胴体、肉质性状的相关性分析
3 讨论
脂肪组织不仅是动物机体能量储存的一种形式,还参与调节包括食欲和能量消耗等多个机体功能,且对繁殖、炎症和免疫反应等多个复杂的生理过程也有重要调控作用[8-9]。在猪上,脂肪还是影响猪经济价值和肉质风味的重要因素[10-11]。因此,研究猪的脂肪代谢不但有利于改善胴体和肉质性能,还有助于推动人类肥胖和代谢性疾病的研究。研究发现,多不饱和脂肪酸含量高则猪肉品质变差,在贮存、加工过程中易氧化酸败,单不饱和脂肪酸含量高则肉品质较好。本研究中6个地方猪种属脂肪型猪种,脂肪沉积多,单不饱和脂肪酸含量除雅南猪外均显著或极显著高于大约克夏猪,多不饱和脂肪酸含量极显著低于大约克夏猪,这与Wood等[11]研究发现背膘厚度与皮下脂肪中多不饱和脂肪酸含量呈反比的结果一致。说明地方猪种肉质优良,口感风味俱佳,是培育优质风味猪的优良素材。
IGF-1和PPARγ是脂肪生成的重要调节因子,具有促进脂肪细胞增殖、分化和体脂沉积的作用[3]。周杰等[12]研究发现,6月龄大白猪公猪皮下脂肪中IGF-1表达量显著低于我国地方猪种二花脸公猪。盘道兴等[13]发现,6月龄大白猪皮下脂肪中PPARγ表达量显著低于我国地方猪种江口萝卜猪、从江香猪。本研究中,6月龄大约克夏猪IGF-1表达量极显著高于地方猪种青峪猪、雅南猪、丫杈猪、成华猪、内江猪,显著高于藏猪,PPARγ相对表达量极显著高于青峪猪、藏猪,显著高于雅南猪,与丫杈猪、成华猪、内江猪差异不显著,这与周杰等[12]和盘道兴等[13]的研究结果有较大差异,其原因尚不明确。
本研究相关分析结果表明,IGF-1、PPARγ与体脂率呈极显著和显著负相关,与多不饱和脂肪酸含量呈极显著正相关,这与IGF-1、PPARγ促进脂肪细胞增殖、分化和体脂沉积的作用不相符;此外IGF-1与单不饱和脂肪酸含量呈极显著负相关,PPARγ与肌内脂肪含量呈显著负相关,与盘道兴等研究发现同一品种猪PPARγ基因表达量与肌内脂肪含量呈正相关的结果也相反[13],产生这些差异的具体原因还不清楚。

