依达拉奉对海水淹溺性大鼠急性肺损伤治疗作用的影响
陈卓 山淇 李宏
[摘要] 目的 觀察依达拉奉对海水淹溺性大鼠急性肺损伤的治疗作用,并探讨其作用机制。 方法 根据随机数字表法将40只健康雄性SD大鼠分为空白对照组(C组)、依达拉奉组(E组)、海水淹溺组(S组)和治疗组(SE组),每组10只。气管内注入人工海水建立动物模型:C组暴露气管后尾静脉注射2 mL/kg生理盐水;E组暴露气管后尾静脉注射2 mL/kg依达拉奉注射液;S组暴露气管后于气管内注入4 mL/kg人工海水+尾静脉注入2 mL/kg生理盐水;SE组暴露气管后于气管内注入4 mL/kg人工海水+尾静脉注入2 mL/kg依达拉奉注射液。造模6 h后处死大鼠,检测各组大鼠肺组织湿/干比、支气管肺泡灌洗液蛋白含量、血清白细胞介素(IL)-6、IL-10、肿瘤坏死因子-α(TNF-α)含量和肺组织病理改变;RT-PCR及Western blot检测水通道蛋白(AQP)1和AQP5 mRNA及蛋白表达量。 结果 S组大鼠肺组织湿干比明显高于C组(P < 0.05);SE组大鼠肺组织湿干比低于S组(P < 0.05)。S组大鼠支气管肺泡灌洗液蛋白含量明显高于C组(P < 0.05);SE组大鼠支气管肺泡灌洗液蛋白含量低于S组(P < 0.05)。S组和SE组大鼠血清IL-6、IL-10、TNF-α含量均明显高于C组(P < 0.05);SE组大鼠血清IL-6、TNF-α含量明显低于S组,血清IL-10含量明显高于S组(P < 0.05)。S组大鼠肺组织AQP1和AQP5 mRNA和蛋白表达量高于C组(P < 0.05);SE组大鼠肺组织AQP1和AQP5 mRNA和蛋白表达量低于S组(P < 0.05)。 结论 依达拉奉可通过调节AQP1和AQP5的表达减轻海水淹溺造成的急性肺损伤。
[关键词] 依达拉奉;淹溺;急性肺损伤;水通道蛋白
[中图分类号] R-332 [文献标识码] A [文章编号] 1673-7210(2019)08(b)-0016-05
[Abstract] Objective To observe the therapeutic effect of Edaravone on acute lung injury in seawater drowning rats and explore its mechanism. Methods Forty healthy male SD rats were divided into control group (group C), Edaravone group (group E), seawater drowning group (group S) and treatment group (group SE) according to random number table method, with 10 rats in each group. Artificial seawater was injected into trachea to establish animal models: group C was injected with 2 mL/kg saline via tail vein after tracheal exposure; group E was injected with 2 mL/kg Edaravone injection via tail vein after tracheal exposure; group S was injected with 4 mL/kg artificial seawater after tracheal exposure + 2 mL/kg saline via tail vein; group SE was injected with 4 mL/kg artificial saline via trachea after tracheal exposure + 2 mL/kg Edaravone injection via tail vein. Six hours after the establishment of the model, rats were killed. The wet/dry weight ratio, protein concentration in bronchoalveolar lavage fluid, interleukin (IL)-6, IL-10, serum tumor necrosis factor-α (TNF-α) content and pathological changes of lung tissue were detected. The mRNA and protein expression of aquaporin (AQP)-1 and AQP5 were detected by RT-PCR and Western blot. Results The wet-dry ratio of lung tissue in group S was significantly higher than that in group C (P < 0.05), and that in group SE was lower than that in group S (P < 0.05). The protein content of bronchoalveolar lavage fluid in group S was significantly higher than that in group C (P < 0.05); the protein content of bronchoalveolar lavage fluid in group SE was lower than that in group S (P < 0.05). The serum levels of IL-6, IL-10 and TNF-α in group S and SE were significantly higher than those in group C (P < 0.05); the serum levels of IL-6 and TNF-α in group SE were significantly lower than those in group S, and the serum level of IL-10 was significantly higher than that in group S (P < 0.05). The expression of AQP1 and AQP5 in lung tissue of rats in group S was higher than that in group C (P < 0.05); the expression of AQP1 and AQP5 in lung tissue of rats in group SE was lower than that in group S (P < 0.05). Conclusion Edaravone can alleviate the acute lung injury caused by seawater drowning by regulating the expression of AQP1 and AQP5.
[Key words] Edaravone; Drowning; Acute lung injury; Aquaporin
近年来,随着海洋领域军事、商业和娱乐活动的逐渐频繁,全球范围内因淹溺导致死亡的人数逐年升高,已经成为最常见的意外死亡原因之一[1]。相关研究证实,淹溺后海水吸入肺内,形成淹溺性急性肺损伤(SW-ALI),直至发展成急性呼吸窘迫综合征,导致死亡[2]。在临床上,目前尚无有效方法治疗SW-ALI,在机械通气的基础上,使用有效的药物抗炎治疗,可减轻肺损伤[3-4]。依达拉奉作为一种新型自由基清除剂[5],在临床上已经广泛应用于神经系统疾病的治疗,并取得了良好的疗效[6-7]。动物实验发现,依达拉奉可以缓解缺血再灌注和内毒素所引起的急性肺损伤[8-9]。然而,其对SW-ALI治疗作用的研究目前仍鲜有报道。本实验通过构建海水SW-ALI动物模型,观察依达拉奉对SW-ALI的作用,并初步分析其作用机制。
1 材料与方法
1.1 主要试剂
依达拉奉注射液(福建天泉药业股份有限公司,生产批号:H20110090,每支15 mg,10 mL),肿瘤坏死因子α(TNF-α,南京建成科技有限公司,生产批号:20180603),白细胞介素-6(IL-6,南京建成科技有限公司,生产批号:20180529),白细胞介素-10(IL-10,南京建成科技有限公司,生产批号:20180605),ELISA试剂盒(南京建成科技有限公司),逆转录试剂盒(康为世纪生物科技有限公司,生产批号:CW2569M),荧光定量试剂盒(康为世纪生物科技有限公司,生产批号:CW2601M)。人工海水配制:根据国家海洋局第三海洋研究所海洋生化研究室提供的东南沿海海水主要成分:氯化钠26.518 g/L,硫酸镁3.305 g/L,氯化镁2.447 g/L,氯化钙1.141 g/L,氯化钾0.725 g/L,碳酸氢钠0.202 g/L,溴化钠0.083 g/L;渗透压1300 mmol/L,pH 8.2,相对密度1.05。海水现配现用。
1.2 实验动物及分组
清洁级健康雄性SD大鼠40只,体质量220~260 g,購于北京维通利华实验动物技术有限公司[合格证号:SCXK(京)2016-0006]。本研究经武警部队特色医学中心伦理委员会批准。根据随机数字表法将大鼠分为四组,即:空白对照组(C组)、依达拉奉组(E组)、海水淹溺组(S组)和治疗组(SE组),每组10只。气管内注入4 mL/kg人工海水建立动物模型:C组暴露气管后尾静脉注射2 mL/kg生理盐水;E组暴露气管后尾静脉注射2 mL/kg依达拉奉注射液;S组暴露气管后于气管内注入4 mL/kg人工海水造模,随后尾静脉注入2 mL/kg生理盐水;SE组暴露气管后于气管内注入4 mL/kg人工海水造模,随后尾静脉注入2 mL/kg依达拉奉注射液。6 h后处死大鼠,收集组织标本。
1.3 肺组织病理学检查
每组大鼠取相同部位肺组织,4%多聚甲醛固定24 h后,常规石蜡包埋和切片,进行HE染色并观察肺组织病理变化。
1.4 肺组织湿干比测定
每组大鼠取相同肺叶,擦拭表面水分及血迹后,立即电子天平称重,记为湿重,再将肺叶放入70℃烤箱中72 h,至恒定重量,记为干重,并计算湿干比。
1.5 支气管肺泡灌洗液蛋白含量测定
打开胸腔,结扎右主支气管,用特制的气管插管插入左主支气管,用生理盐水4 mL缓慢注入左肺中,并轻柔肺部使生理盐水在肺部均匀分布,重复灌洗3次,回收支气管肺泡灌洗液,后4℃离心,取上清液用BCA法测蛋白含量。
1.6 血清IL-6、IL-10和TNF-α检测
采用ELISA检测血清IL-6、IL-10和TNF-α含量,严格按照试剂盒说明书进行操作。
1.7 逆转录聚合酶链反应(RT-PCR)检测水通道蛋白(AQP)1、AQP5 mRNA表达量
首先,Trizol法提取肺组织标本RNA,紫外分光光度仪测定RNA纯度;然后,将提取的RNA逆转录成cDNA,再以cDNA为模板,扩增AQP1和AQP5,以β-actin为内参照。各引物序列均由上海生工生物技术有限公司合成,AQP1基因:上游为5′-TCTGGAGGC-TGTGGTGGCT-3′,下游为5′-AAGTGAGTTCTCGAG-CAGGGA-3′;AQP5基因:上游为5′-TGGGTCTTCTG-GGTAGGGCCTATTGT-3′,下游为5′-GCCGGCTTTGGCACTTGAGATACT-3′;β-actin:上游为5′-ATCTGGCACCACACCTTC-3′,下游为5′-AGCCAGGTCCAG-ACGCA-3′。扩增条件为:95℃ 2 min,95℃ 2 min,95℃ 10 s,60℃ 30 s,70℃ 45 s,共40个循环,自动4℃保存。采用2-ΔΔct计算相对表达量进行分析。
1.8 Western blot检测AQP1和AQP5蛋白表达量
取适量肺组织,加入蛋白裂解液匀浆,离心收集上清液,获得肺组织蛋白,SDS-聚丙烯酰胺凝胶电泳法分离蛋白。将标记的膜放入1%的脱脂奶粉封闭液中,并在室温缓慢振荡2 h;一抗按1∶1000稀释加入,4℃摇床震荡过夜,TBST洗膜;加入二抗,37℃温育2 h,再次洗涤;将膜在暗室滴上发光液,避光保存并照相,结果做灰度扫描分析。
1.9 统计学方法
数据采用GraphPad Prism 6.0软件进行数据分析,计量资料用均数±标准差(x±s)表示,多组间比较采用单因素方差分析,进一步两两比较采用LSD-t检验,以P < 0.05为差异有统计学意义。
2 结果
2.1 四组大鼠肺组织病理学检测结果比较
肺组织大体标本观察:C组与E组大鼠肺组织表面光滑、完整;S组大鼠肺组织可见水肿明显,表面可见散在点、片状出血灶;SE组大鼠肺组织标本可见轻微水肿,表面偶见点状出血灶。肺组织HE染色后观察(图1):C组与E组大鼠肺组织无明显病理改变;S组大鼠肺组织出现典型的急性肺损伤病理改变,可见大量中性粒细胞浸润,间质性水肿,肺泡间隔增厚,斑片状出血灶;SE组大鼠与S组比较,肺组织间质性水肿程度减轻,出血灶减少,中性粒细胞浸润减轻。
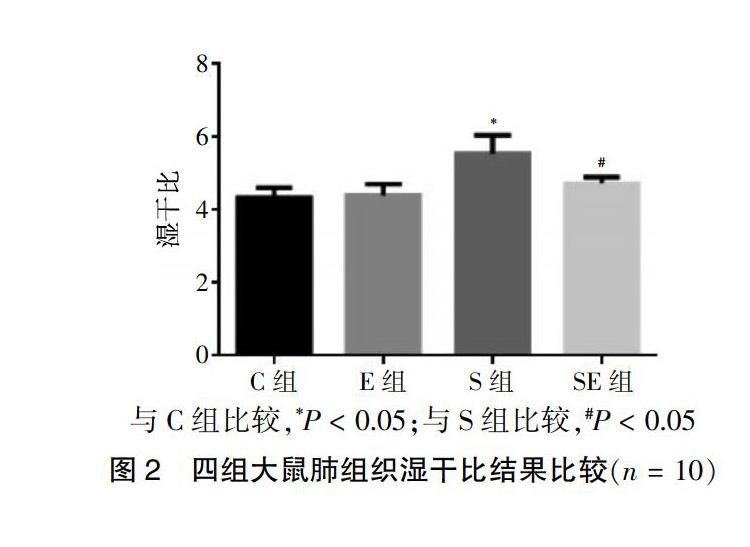
2.2 四组大鼠肺组织湿干比结果比较
S组大鼠肺组织湿干比明显高于C组(P < 0.05);SE组大鼠肺组织湿干比低于S组(P < 0.05);C组与E组大鼠肺组织湿干比比较差异无统计学意义(P > 0.05)。见图2。
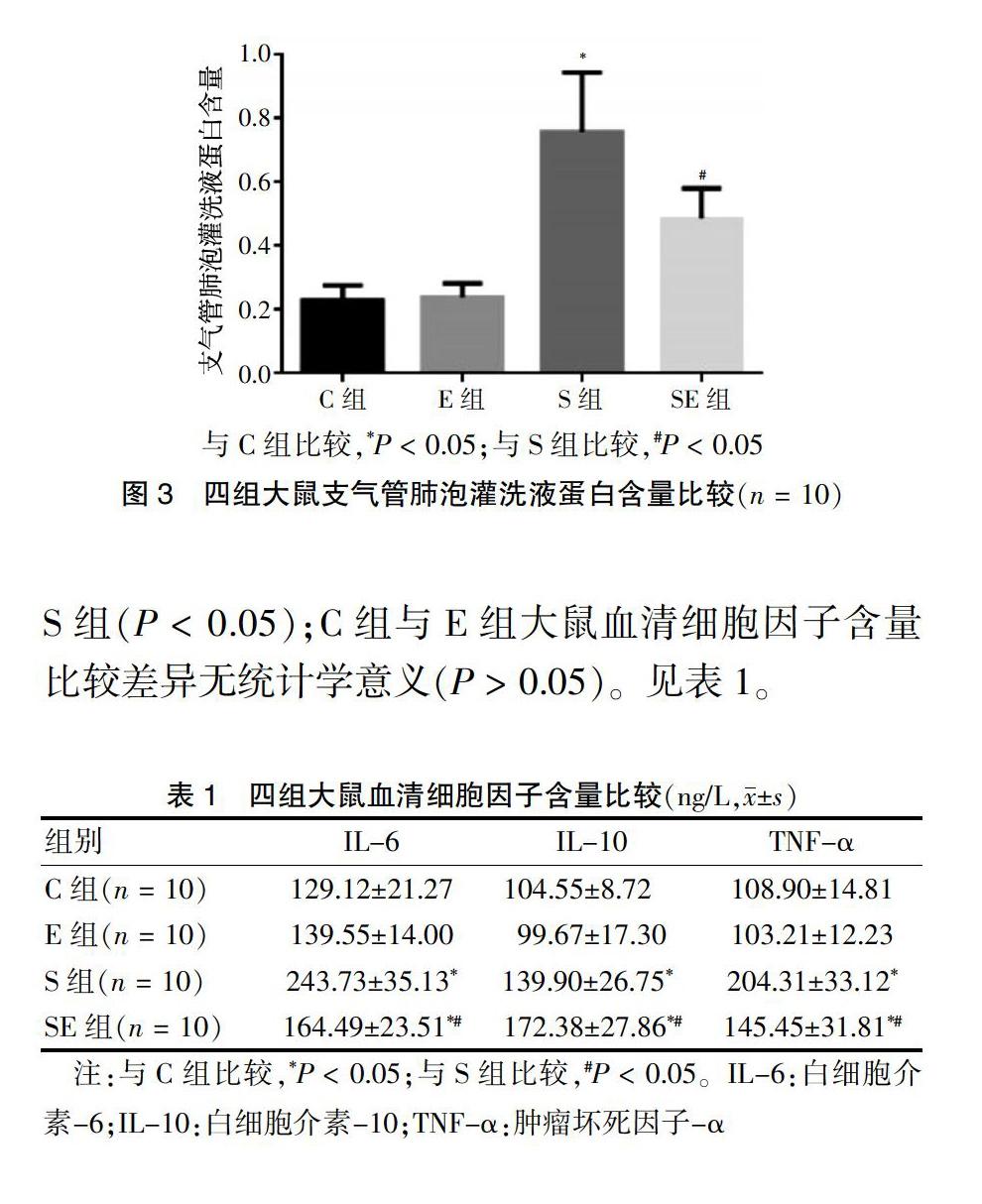
2.3 四组大鼠支气管肺泡灌洗液蛋白含量比较
S组大鼠支气管肺泡灌洗液蛋白含量明显高于C组(P < 0.05);SE组大鼠支气管肺泡灌洗液蛋白含量低于S组(P < 0.05);C组与E组大鼠支气管肺泡灌洗液蛋白含量比较差异无统计学意义(P > 0.05)。见图3。
2.4 四组大鼠血清细胞因子含量比较
S组和SE组大鼠血清IL-6、IL-10、TNF-α含量均明显高于C组(P < 0.05);SE组大鼠血清IL-6、TNF-α含量明显低于S组,血清IL-10含量明显高于S组(P < 0.05);C组与E组大鼠血清细胞因子含量比较差异无统计学意义(P > 0.05)。见表1。
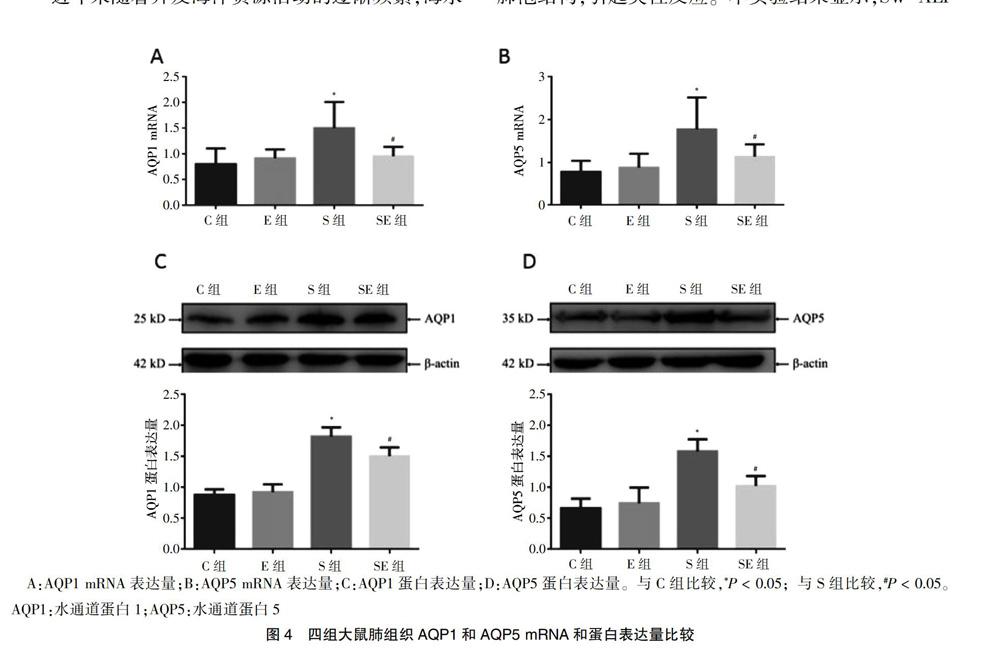
2.5 四组大鼠肺组织AQP1和AQP5 mRNA和蛋白表达量比较
S组大鼠肺组织AQP1和AQP5 mRNA和蛋白表达量均高于C组(P < 0.05);SE组大鼠肺组织AQP1和AQP5 mRNA和蛋白表达量低于S组(P < 0.05);C组与E组大鼠肺组织AQP1和AQP5 mRNA和蛋白表达量比较差异无统计学意义(P > 0.05)。见图4。
3 讨论
近年来随着开发海洋资源活动的逐渐频繁,海水淹溺事故也逐渐增多。全世界每年约有37.2万人因溺水导致死亡[10]。海水是一种高渗、低温的液体[11],吸入海水后,高渗透压和低温共同作用于肺组织,破坏肺泡结构,引起炎性反应。本实验结果显示,SW-ALI模型大鼠肺泡毛细血管膜的通透性增加,肺水肿程度增高,炎性因子聚集,呈现急性肺损伤的病理改变,这是由于高渗透压的海水可导致肺间质和肺泡毛细血管中液体渗漏至肺泡中,形成肺水肿和低氧血症[12]。同时肺水肿引起肺泡-毛细血管膜的通透性增高,进一步导致周围液体渗漏至肺泡中,加重支气管和肺泡结构的破坏,同时大量炎性介质释放并进一步损害肺组织[13]。依达拉奉由于具有抗氧化和抗自由基的作用,现被广泛应用于急性脑卒中和脑水肿的治疗[14-16]。若将其用于SW-ALI的治疗,能否发挥同样的效果,有待探讨。本实验在应用依达拉奉后,可见一方面通过下调血清促炎因子TNF-α、IL-6及上调血清抑炎因子IL-10的表达,改善海水淹溺后肺部炎性反应;另一方面通过降低肺泡毛细血管通透性,抑制肺水肿的形成,除了已知的抗氧化作用外,是否还影响了其他通路相关蛋白的表达从而发挥治疗作用,有待进一步研究,为此本实验检测了肺组织AQP的表達。
AQP是一组广泛分布于生物细胞膜上具有调节水分子转运功能的内在蛋白[17]。在人类细胞中发现的AQP至少有12种,在肺组织中主要有6种AQP表达,包括AQP1、AQP3、AQP5、AQP8、AQP9。有研究证实,AQP1和AQP5与肺组织内水分跨膜转运有着密切的关系[18]。因此,推测依达拉奉改善肺水肿的机制可能与调节AQP1和AQP5的表达有关。本研究结果表明,海水淹溺后可促进AQP1和AQP5的表达,而依达拉奉可抑制AQP1和AQP5的表达。有研究表明,急性高原缺氧引起的肺水肿和海水淹溺引起的肺损伤中AQP1和AQP5的表达上调[19]。She等[20]发现通过敲除小鼠AQP5基因可增加高原型肺水肿损伤程度,提示AQP可能参与了急性肺损伤肺水肿形成的病理过程,这对研究肺水肿的发生机制提供了新的思路。
综上所述,本研究通过构建SW-ALI模型,探讨依达拉奉对SW-ALI的治疗效果,并基于AQP进一步探索其治疗机制,发现依达拉奉在改善肺部炎症的同时,可能通过降低AQP1和AQP5水平,调节肺内水分的分布,缓解肺水肿,最终实现对SW-ALI的治疗作用,为临床上治疗SW-ALI提供了新的思路。
[参考文献]
[1] Jin F,Li C. Seawater-drowning-induced acute lung injury:from molecular mechanisms to potential treatments [J]. Exp Ther Med,2017,13(6):2591-2598.
[2] Szpilman D,Bierens JJ,Handley AJ,et al. Drowning [J]. N Engl J Med,2012,366(22):2102-2110.
[3] Ji MH,Tong JH,Tan YH,et al. Erythropoietin pretreatment attenuates seawater aspiration-induced acute lung injury in rats [J]. Inflammation,2016,39(1):447-456.
[4] Li C,Bo L,Li P,et al. Losartan,a selective antagonist of AT1 receptor,attenuates seawater inhalation induced lung injury via modulating JAK2/STATs and apoptosis in rat [J]. Pulm Pharmacol Ther,2017,45:69-79.
[5] Inokuchi Y,Imai S,Nakajima Y,et al. Edaravone,a free radical scavenger,protects against retinal damage in vitro and in vivo [J]. J Pharmacol Exp Ther,2009,329(2):687-698.
[6] Takase H,Lok J,Arai K. A radical scavenger edaravone and oligodendrocyte protection/regeneration [J]. Neural Regen Res,2018,13(9):1550-1551.
[7] Sawada H. Clinical efficacy of edaravone for the treatment of amyotrophic lateral sclerosis [J]. Expert Opin Pharmacother,2017,18(7):735-738.
[8] Zhang Z,Luo Z,Bi A,et al. Compound edaravone alleviates lipopolysaccharide(LPS)-induced acute lung injury in mice [J]. Eur J Pharmacol,2017,811:1-11.
[9] Uchiyama M,Tojo K,Yazawa T,et al. Edaravone prevents lung injury induced by hepatic ischemia-reperfusion [J]. J Surg Res,2015,194(2):551-557.
[10] Engel SC. Drowning episodes:prevention and resuscitation tips [J]. J Fam Pract,2015,64(2):E1-E6.
[11] Nawa S,Shimizu A,Kino K,et al. Development of an experimental model of an acute respiratory failure by intratracheal sea water infusion:a comparison with a conventional oleic acid induction [J]. Res Exp Med(Berl),1994,194(1):25-33.
[12] Liu W,Dong M,Bo L,et al. Epigallocatechin-3-gallate ameliorates seawater aspiration-induced acute lung injury via regulating inflammatory cytokines and inhibiting JAK/STAT1 pathway in rats [J]. Mediators Inflamm,2014, 2014:612593.
[13] Liu Z,Zhang B,Wang XB,et al. Hypertonicity contributes to seawater aspiration-induced lung injury:role of hypoxia-inducible factor 1α [J]. Exp Lung Res,2015,41(6):301-315.
[14] Zheng J,Chen X. Edaravone offers neuroprotection for acute diabetic stroke patients [J]. Ir J Med Sci,2016,185(4):819-824.
[15] 楊丽.依达拉奉联合舒血宁注射液治疗急性脑梗死的效果[J].中国医药导报,2018,15(11):74-77.
[16] Tang Y,Rong X,Hu W,et al. Effect of edaravone on radiation-induced brain necrosis in patients with nasopharyngeal carcinoma after radiotherapy:a randomized controlled trial [J]. J Neurooncol,2014,120(2):441-447.
[17] 郭琼梅,张莉,魏砚砚,等.右美托咪定对单肺通气患者血浆IL-1β及肺组织AQP4、AQP5表达水平的影响[J].中国医药导报,2017,14(4):58-61.
[18] Hong-Min F,Chun-Rong H,Rui Z,et al. CGRP 8-37 enhances lipopolysaccharide-induced acute lung injury and regulating aquaporin 1 and 5 expressions in rats [J]. J Physiol Biochem,2016,73(3):381-386.
[19] 何苗,李珊珊,王勇,等.缺血后处理上调水通道蛋白1减轻体外循环犬肺水肿[J].贵州医药,2017,41(10):1017-1020.
[20] She J,Bi J,Tong L,et al. New insights of aquaporin 5 in the pathogenesis of high altitude pulmonary edema [J]. Diagn Pathol,2013,8:193.
(收稿日期:2019-01-22 本文编辑:李亚聪)

