Ti-MWW分子筛催化硫醚氧化反应的机理
卞 贺,张 健,高志杰,张会明,徐 斌,张士国,夏道宏
(1.滨州学院 化工与安全学院,山东 滨州 256603;2.中国石油大学(华东)重质油国家重点实验室,山东 青岛 266580)
目前,世界各国燃料油标准对硫含量的要求越来越严格,许多国家已明确规定燃料油中硫的质量分数不得高于10 μg/g。我国的环保法规对燃料油中硫含量的限制也越来越严格[1],因此,油品脱硫新技术成为研究的热点[2]。由于传统的加氢脱硫方法难以脱除原油中的噻吩类硫化物,催化氧化脱硫法作为替代方法,因其反应条件温和、脱硫率高、设备简单、不需氢气、能够脱除噻吩类硫化物等优点[3],而得到迅速发展。
钛硅分子筛作为一种理想的固体催化剂[4],可催化以过氧化氢(H2O2)为氧化剂的多种选择性氧化反应[5],广泛用于氧化脱硫领域[6-9]。近年来,一种新型的钛硅分子筛(Ti-MWW)[10]受到广泛关注。Ti-MWW分子筛具有独特的孔道结构,存在2套独立的10元环(10MR,10-Membered ring)和12元环(12MR)超笼体系[11]。在以H2O2为氧化剂的液相选择氧化反应中,Ti-MWW分子筛具有良好的催化性能,表现出不同于TS-1钛硅分子筛[12]的溶剂效应和产物立体选择性[13]。目前,关于Ti-MWW的催化氧化的机理研究大多集中于烯烃的环氧化[14-16],而对于氧化脱硫的机理还没有细致、明确的认知。二甲基硫醚(DMS)作为一种典型的含硫化合物,可以被氧化剂(H2O2、NO2、O2和O3等)氧化[17-18]生成二甲基亚砜(DMSO)或砜。
在非催化条件下DMS和H2O2反应机理研究[19]的基础上,笔者采用加上色散校正的密度泛函(DFT-D3)的理论方法[20],考察Ti-MWW/H2O2体系对DMS的催化氧化机理,同时考虑溶剂效应的影响,以期对该类反应有更深入而系统的认识。
1 模型的构建和计算方法
1.1 Ti-MWW模型的构建
在结构类型代码为MWW分子筛的晶胞中,有8个晶体学不同的四面体位置,分别称为T1、T2、T3、T4、T5、T6、T7和T8位[13]。Ti-MWW分子筛Ti中心优先落于T1和T3位上[13]。研究以T3位为中心,截取Ti-MWW晶体结构中包括周围5层骨架原子的簇模型,此模型含有15个T位,称为15T簇模型。对于末端的Si悬断键,用氢原子进行饱和,同时将Si-H键键长沿原方向调整为0.146 nm[13],再用Ti原子将T3位中心的Si原子替代,构建好15T簇模型,从而构建出钛-氧活性中心模型[21]。
1.2 钛-氧活性中间体模型的构建
图1为Ti-MWW分子筛T3位点构型和钛-氧活性中间体构型的示意图,图中所有原子的编号与Ti-MWW分子筛的晶格参数一致。在制备 Ti-MWW 的过程中,会形成4足Ti(OSi)4物种(见图1(a))。在T3位点Ti-MWW分子筛的Ti—O键中,最易断裂的为Ti—O12键[13-14],其水解断裂后会生成反转的Ti-OH[13,21-22],即Ti(OH)(SiOH)物种(见图1(b))。Ti(OH)(SiOH)与H2O2作用会生成2种钛-氧活性中间体:五元环的Ti-η1-OOH和三元环的Ti-η2-OOH[14](见图1(c)和1(d)),还可以进一步吸附溶剂形成六配位络合物。为了考察溶剂效应,选取H2O、CH3OH、CH3CN、CH3COCH3共4种溶剂,构建了三元环型钛-氧活性中间体的4种溶剂吸附模型:Ti-η2-OOH-H2O、Ti-η2-OOH-CH3OH、Ti-η2-OOH-CH3CN和Ti-η2-OOH-CH3COCH3(见图1(e))。
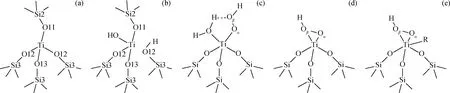
图1 Ti-MWW分子筛T3位点分子筛构型及钛-氧活性中间体构型示意图Fig.1 Ti-clusters and Ti-hydroperoxo intermediates at the T3 sites in Ti-MWW zeolite(a)Ti(OSi)4;(b)Ti(OH)(SiOH);(c)Ti-η1-OOH;(d)Ti-η2-OOH;(e)Ti-η2-OOH-R (R=H2O,CH3OH,CH3CN,CH3COCH3)
1.3 计算方法
密度泛函理论(DFT)[23]中的B3LYP方法[24]结合6-31G(d,p)基组[25]已经广泛应用于含Ti分子筛体系的理论计算。然而,钛-氧活性中心催化体系中存在弱相互作用,而B3LYP并不能很好地处理色散作用[14],因此,笔者采用加上色散校正的DFT-D3中的B3LYP-D3方法[20],并结合上述基组对反应体系中反应物、中间体、过渡态及产物进行结构优化。钛-氧活性中间体及其吸附模型如图2所示。在进行结构优化时,簇模型最外2层原子的坐标固定(图2中用线状模型表示),以保证分子筛具有一定的刚性;其余骨架原子都进行松弛并优化(图2中用球棍模型表示),由振动分析确认过渡态的正确性。通过对内禀反应坐标(IRC)的计算,验证反应通道中反应物、中间体、过渡态及产物的连接关系。此外,为了获得更精确的反应能垒数据,采用B3LYP-D3方法,结合更高水平的def2-TZVP基组[26]对结构优化得到的各构型进行了能量(单点能)的计算。上述计算工作均通过Gaussian 16 A.03程序[27]完成。

图2 Ti-MWW分子筛T3位点钛氧活性中间体构型Fig.2 Ti-hydroperoxo intermediates at the T3 sites in Ti-MWW zeolite(a)Ti-η1-OOH;(b)Ti-η2-OOH;(c)Ti-η2-OOH-H2O;(d)Ti-η2-OOH-CH3OH;(e)Ti-η2-OOH-CH3CN;(f)Ti-η2-OOH-CH3COCH3—Oxygen atoms;—Titanium atoms;—Silicon atoms;—Nitrogen atoms;—Carbon atoms;—Hydrogen atoms
2 结果与讨论
2.1 钛-氧活性中间体构型的优化结果
优化构型的部分几何结构参数列于表1。从表1可以看出:溶剂吸附后Ti—Oα键长在0.1893~0.1920 nm之间、Oα—Oβ键长在0.1470~0.1482 nm之间,都略有增加;而Ti—Oβ键长在0.2161~0.2200 nm之间,略有减少;Ti原子和各溶剂中心原子的间距,即Ti—Oγ/N的键长在0.2218~0.2353 nm之间,差别不大。根据文献[13],在B3LYP-D3/def2-TZVP水平上计算了Ti-η1-OOH、Ti-η2-OOH和Ti-η2-OOH-H2O的生成能,分别为-36.95 kJ/mol、-13.35 kJ/mol和-46.04 kJ/mol。三者稳定性顺序由大到小依次为Ti-η2-OOH-H2O、Ti-η1-OOH、Ti-η2-OOH,与文献[16-17]结果一致。Ti-η1-OOH和Ti-η2-OOH-H2O作为同分异构体,二者生成能相差不大。但Ti-η2-OOH-H2O的稳定性好于Ti-η1-OOH,意味着分子内氢键不是形成稳定活性中心构型的主要因素。
2.2 溶剂的吸附能分析
在B3LYP-D3/def2-TZVP水平上进行了溶剂对Ti-η2-OOH的吸附能(ΔEads)的计算,结果如表2所示。其中,ΔEads的计算式如式(1):
ΔEads=Ecom-Ezeo-Esol
(1)
式(1)中,ΔEads为溶剂的吸附能,kJ/mol;Ecom为优化后的吸附络合物总能量,kJ/mol;Ezeo为吸附前的分子筛构型总能量,kJ/mol;Esol为孤立溶剂分子的能量,kJ/mol。
同时考虑基组重叠误差(Basis set superposition error,BSSE)的校正[28],得到了校正后的吸附能ΔEc:
ΔEc=ΔEuc+ΔEBSSE
(2)

表1 Ti-MWW分子筛T3位点钛氧活性中间体的部分结构参数Table 1 Geometric parameters of Ti-hydroperoxo intermediates at the T3 sites in Ti-MWW zeolite
式(2)中,ΔEc为校正之后的吸附能,kJ/mol;ΔEuc为校正之前的吸附能,kJ/mol。

表2 Ti-MWW分子筛T3位点Ti-η2-OOH对不同溶剂的吸附能Table 2 Adsorption energies of solvents with Ti-η2-OOH at the T3 sites in Ti-MWW zeolite
ΔEuc—Uncorrected ΔEadsdata;ΔEc—Corrected ΔEadsdata by BSSE
从表2可以看出,不同溶剂分子在活性中心上的吸附能力由强到弱依次为CH3COCH3、CH3OH、H2O、CH3CN。
2.3 过渡态几何结构分析
为考察Ti-MWW分子筛催化氧化二甲基硫醚(DMS)的微观机理,分别以Ti-η1-OOH、Ti-η2-OOH、Ti-η2-OOH-H2O、Ti-η2-OOH-CH3OH、Ti-η2-OOH-CH3CN和Ti-η2-OOH-CH3COCH3为活性中心,对反应涉及的所有反应物、过渡态和产物进行了结构优化和频率计算。结果表明,DMS在这几种活性中心上的氧化反应经过6条类似的路径:反应物之间相互靠近,先形成反应物复合物RC(Reactant complex),然后活性中心的Oα经过渡态TS(Translate state)转移到DMS的S上面,生成产物复合物PC(Product complex),最后分解为产物二甲基亚砜(DMSO)。具体反应路径如下:
Ti-η1-OOH+DMS→RC1→TS1→PC1→Ti-OH-H2O+DMSO
(a)
Ti-η2-OOH+DMS→RC2→TS2→PC2→Ti-OH+DMSO
(b)
Ti-η2-OOH-H2O+DMS→RC3→TS3→PC3→Ti-OH-H2O+DMSO
(c)
Ti-η2-OOH-CH3OH+DMS→RC4→TS4→PC4→Ti-OH-CH3OH+DMSO
(d)
Ti-η2-OOH-CH3CN+DMS→RC5→TS5→PC5→Ti-OH-CH3CN+DMSO
(e)
Ti-η2-OOH-CH3COCH3+DMS→RC6→TS6→PC6→Ti-OH-CH3COCH3+DMSO
(f)
式(a)~(f)中,TS1~TS6分别为各反应路径的过渡态,依次为Ti-η1-OOH-TS、Ti-η2-OOH-TS、Ti-η2-OOH-H2O-TS、Ti-η2-OOH-CH3OH-TS、Ti-η2-OOH-CH3CN-TS 和Ti-η2-OOH-CH3COCH3-TS。
优化后的过渡态结构见图3。从图3可以看出:除了TS1之外,各个活性中心上的过渡态的结构相差不大;从振动方向来看,TS2~TS5类似,主要都是Oα在Ti和S之间摆动,而TS1中除了Oα在Ti和S之间摆动之外,H原子也会在Oβ和Oγ之间同步摆动。过渡态中键角φ(Oβ—Oα—S)在157.0°~174.4°之间,其中TS1键角最小,其余的接近170°。
各过渡态的部分几何结构参数列于表3。对比表1和表3可以发现,与形成过渡态之前的各自活性中心相比,TS1中Ti—Oα键长略有增加,TS2~TS5中Ti—Oα键长在0.1869~0.1918 nm之间,变化不明显。而Ti—Oβ键长都明显降低,其中TS2~TS5 中Ti—Oβ键长在0.2087~0.2128 nm之间。Oα—Oβ的键长变化较大,增加幅度为0.0174~0.0252 nm。对于Ti—Oγ/N键长,除了TS3中有所增加,其余都略有降低。过渡态中Oα原子与 S原子的距离在0.2338~0.2492 nm之间,其在TS1中距离最小。

图3 Ti-MWW分子筛T3位点二甲基硫醚的氧化过渡态构型Fig.3 Transition state of DMS oxidation at the T3 sites in Ti-MWW zeolite(a)Ti-η1-OOH-TS(TS1);(b)Ti-η2-OOH-TS(TS2);(c)Ti-η2-OOH-H2O-TS(TS3);(d)Ti-η2-OOH-CH3OH-TS(TS4);(e)Ti-η2-OOH-CH3CN-TS(TS5);(f)Ti-η2-OOH-CH3COCH3-TS(TS6)—Oxygen atoms;—Titanium atoms;—Silicon atoms;—Nitrogen atoms;—Carbon atoms;—Hydrogen atoms
对反应过程中各物种的振动分析表明,该反应的反应物、产物和中间体的力常数矩阵本征值全为正,说明它们为势能面上的稳定点。过渡态TS1~TS6皆有唯一的虚频率,分别为-544.27 cm-1、-273.09 cm-1、-280.24 cm-1、-293.78 cm-1、-308.20 cm-1和-301.13 cm-1。根据过渡态判据理论[29]可以判断它们是真实过渡态。另外,IRC计算曲线的两边显示的分子构型分别指向对应的反应物和产物,由此可以确定各过渡态为反应通道上的真实过渡态。

表3 Ti-MWW分子筛T3位点二甲基硫醚氧化过渡态的部分结构参数Table 3 Geometric parameters for transition state of DMS oxidation at the T3 sites in Ti-MWW zeolite
2.4 过渡态能量分析
在B3LYP-D3/def2-TZVP计算水平上得到的各物种的相对能量(即各物种与各自路径的反应物能量的差值,已经过零点能校正)列于表4。
一般认为,在分子筛催化烯烃环氧化反应的过程中,烯烃在分子筛活性中心上的吸附能忽略不计[17-18]。但从表4可以发现,DMS在分子筛上的吸附较强,吸附能在-47.22~-48.04 kJ/mol之间,不可忽略,这是因为本文采用的B3LYP-D3方法考虑了色散作用的贡献,比B3LYP方法得到的吸附能数值更大[16]。另外,产物在分子筛上的脱附能也较大,达73.38~116.18 kJ/mol;反应物的吸附强度明显弱于产物。从表4还可以看出,上述反应路径的产物能量远低于反应物的能量,属于强烈的放热反应,在热力学上有利于反应的进行。

表4 Ti-MWW分子筛T3位点DMS氧化反应各物种相对能量Table 4 Relative energies for species involved in DMS oxidation at the T3 sites in Ti-MWW zeolite
反应能垒ΔE为过渡态能量与反应物的复合物能量之差,见图4。从图4可以看出,不同活性中心上反应能垒由小到大的顺序依次为Ti-η2-OOH-CH3OH、Ti-η2-OOH-CH3COCH3、Ti-η2-OOH-H2O、Ti-η2-OOH-CH3CN、Ti-η2-OOH、Ti-η1-OOH。
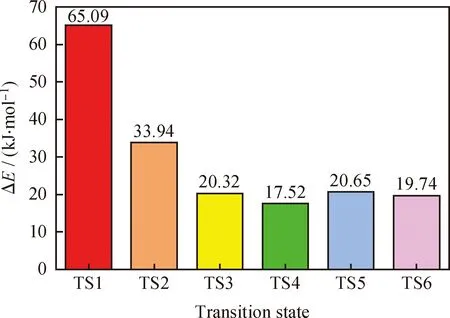
图4 Ti-MWW分子筛T3位点DMS氧化反应能垒Fig.4 Reaction barriers of DMS oxidation at the T3 sites in Ti-MWW zeolite
研究表明[30],当钛硅分子筛作为氧化脱硫反应的催化剂时,极性溶剂可以迅速将反应产物转移,恢复活性中心的催化性能,从而保证氧化反应的持续进行,水、甲醇和乙腈均适合做该反应的溶剂。为了从理论上说明极性溶剂的作用,研究采用molclus软件[31]内置的genmer组件生成100个溶剂分子包裹在DMSO附近的20个团簇构型,其中溶剂包括H2O、CH3OH、CH3CN或CH3COCH3。对上述团簇构型在MMFF94[32]力场下进行预优化,然后用GFN-xtb方法[33]进行结构优化,得到最稳定构型,如图5所示。
团簇模型中溶质DMSO作为片段1,其余100个溶剂分子作为片段2,则DMSO相对于溶剂的脱附能等于片段1与片段2能量之和减去团簇总能量(基于 GFN-xtb水平),结果见表5,其中Ed1为DMSO在溶剂分子中的脱附能。为方便对比,DMSO在Ti-MWW分子筛上的脱附能也列于表5,记为Ed2。从表5可以看出,相对于Ti-MWW分子筛,DMSO在4种溶剂中的脱附能更大,表明虽然DMSO在分子筛上的脱附能较大,但更容易溶于极性溶剂从而快速转移。这与之前研究结论一致[30]。因此,4种极性溶剂不仅参与了反应、降低了反应能垒,并及时移走产物、恢复钛-氧活性中心的催化性能。

图5 溶剂包裹DMSO的团簇模型Fig.5 Cluster models of DMSO encapsulated by solvents(a)DMSO-100H2O;(b)DMSO-100CH3OH;(c)DMSO-100CH3CN;(d)DMSO-100CH3COCH3

表5 DMSO在溶剂中和Ti-MWW分子筛上的脱附能比较Table 5 Desorption energies of DMSO in solvent and Ti-MWW zeolite
为进一步考察Ti-MWW分子筛的催化效果,在B3LYP-D3/6-31(d,p)的计算水平上,对无催化剂时DMS与H2O2的氧化反应体系进行了结构优化,反应路径如下:
H2O2+DMS→RC→TS→PC→H2O+DMSO
(g)
同时,在B3LYP-D3/def2-TZVP水平上对反应体系各物种进行了单点能的计算,并考虑了零点能的校正,计算结果见表6。表6中,路径(g)数据为本文计算值;路径(h)数据为文献值[19],结构优化和单点能计算级别皆为B3LYP/6-311+G(d,p)。

表6 DMS和H2O2氧化反应各物种相对能量Table 6 Relative energies of species involved in the reaction of DMS oxidation by H2O2
从表6数据可以发现,在非催化条件下,DMS氧化反应能垒为117.19 kJ/mol,与文献值111.95 kJ/mol 非常接近,差别在于所采用的计算级别不同。与图4对比发现,Ti-MWW分子筛确实大大降低了DMS和H2O2的氧化反应的能垒,在动力学上有利于反应的发生,其中Ti-η2-OOH-CH3OH活性中心上反应能垒最低,仅为非催化条件下反应能垒的15%。
3 结 论
采用密度泛函理论的B3LYP-D3方法,对 Ti-MWW 分子筛催化氧化二甲基硫醚反应机理的研究结果表明,溶剂在活性中心吸附作用从强到弱的顺序依次为:CH3COCH3、CH3OH、H2O和CH3CN;不同活性中心上的反应能垒由小到大的顺序依次为Ti-η2-OOH-CH3OH、Ti-η2-OOH-CH3COCH3、Ti-η2-OOH-H2O、Ti-η2-OOH-CH3CN、Ti-η2-OOH和Ti-η1-OOH。Ti-MWW分子筛大大降低了DMS和H2O2体系的氧化反应能垒,有利于反应的发生。极性溶剂不仅参与了反应、降低了反应能垒,而且在及时移走产物、恢复钛-氧活性中心的催化性能方面也起到了至关重要的作用。

