聚对苯二甲酸丁二醇酯二聚体热降解机理的理论研究
罗小松,黄金保,吴 雷,金 礼,徐伟伟,严 夏
(贵州民族大学 机械电子工程学院,贵州 贵阳 550025)
聚对苯二甲酸丁二醇酯(PBT)是最常见和重要的热塑性塑料之一,由于其优异的性能而广泛用于各个领域,例如电子仪器、汽车零件材料等[1-3]。据报道,截至2018 年全球塑料产量约3.55 亿吨[4-6]。由于PBT 材料具有耐化学腐蚀性,PBT 废塑料在没有外部因素影响的情况下很难自然降解。为了有效地回收PBT 废塑料,通常采用物理回收、填埋、焚烧等多种方法来处理PBT 废塑料[7,8],然而这些方法仍然存在一些不足。通过物理回收的PBT 塑料废弃物只能降级以用于生产低性能的产品,且该类产品应用寿命非常短暂,最终仍将以废弃物的形式进入自然环境,并没有从根本上解决废弃塑料的污染问题;采用焚烧法处理PBT 塑料废弃物的过程中会放出一些有毒物质;填埋会导致土地资源的减少。热解是一种在无氧条件下将高分子聚合物转化为可回收利用的小分子化合物的方法。近年来,热解被认为是处理PBT 塑料废弃物的有效方法之一,对减轻能源压力和减少环境污染具有重要的现实意义[9,10]。通过对PBT 废塑料热降解,可从PBT 废塑料中回收对苯二甲酸和1,3-丁二烯等有价值的产品,其中,对苯二甲酸是生产聚酯的主要原料,1,3-丁二烯是生产尼龙、合成橡胶和树脂等的原料。
目前,对PBT 热解已有大量的实验研究[11-21]。Qu 等[22]对PBT 的热降解和阻燃机理进行研究发现,在惰性气氛下PBT 热降解放出的主要热解产物是CO2、丁二烯、四氢呋喃、苯和酯衍生物。Pellow-jarman 等[23]通过对PBT 聚合物和含阻燃剂多溴二苯醚的研究表明,PBT 聚合物降解的主要产物有H2O、CO2、丁二烯、四氢呋喃和PBT 低聚物。Montaudo 等[24]发现,PBT 通过β-H 氢转移反应产生的不饱和低聚物容易进行再一次β-H 转移反应而形成丁二烯。Lüderwald 等[25]发现,PBT 初始裂解反应发生在主链上的酯键处,并形成末端羧基和乙烯基结构,该过程被认为是由六元环过渡态促进的协同反应。Sono 等[26]研究发现,PBT 在低温(110℃)条件下主要是通过主链酯键断裂进行的反应。Chiu 等[27]对聚对苯二甲酸丁二酯非催化和催化降解进行了对比研究,发现PBT 非催化和催化降解的气体产物分布几乎相同,主要产物为CO、CO2、1,3-丁二烯等产物。
相比于实验研究,通过量子化学方法进行理论研究可以更加详细地研究PBT 的热降解反应过程及产物形成演化机理。然而,从分子层面对PBT进行热降解反应机理的理论研究报道极少。实际PBT 塑料是具有酯键的高分子聚合物,是由对苯二甲酸与1,4-丁二醇缩聚而成[28]。对其热解微观机理的研究通常采用各种PBT 模型化合物的热解过程来进行研究,PBT 二聚体模化物具有与实际PBT 塑料相似结构以及反应机理,因此,本工作采用量子化学方法对PBT 二聚体的热解反应机理进行了理论研究,分析各种产物及中间产物的演化形成机理,从分子层面上揭示PBT 热解的基本规律和热解反应机理。提出了PBT 二聚体热解过程中各种可能的反应路径、优化了热解反应路径中的所有反应物、中间体、过渡态和产物的结构,并计算了热力学参数值。理论计算结果可为热解回收PBT 废塑料提供理论依据。
1 计算方法
M062X 泛函属于混合元广义梯度近似交换相关泛函的新一代,对于过渡金属、主族热化学中相关能量和反应势垒高度的计算有比较好的准确性[29,30]。因此,本工作采用M062X/6-311G(d)对PBT热降解机理进行了理论计算。所有量子化学计算均在Gaussian 09 版程序中[31]完成的。对PBT 热解反应的所有反应物、产物、中间体和过渡态的几何构型进行优化和振动频率分析,确定了反应物、产物和中间体的频率为实频,而过渡态仅具有一个虚频。通过计算过渡态与反应物之间的焓值能量差来获得反应能垒(活化能),通过计算产物与反应物之间的焓值能量差可以得到反应能值[32]。对于X-Y→X·+Y·的自由基反应,可将键离能(Bond Dissociation Energy,BDE)值近似为自由基反应的能垒。BDE 值通过以下公式计算得出[33]:
式中,EBDE是BDE 值,H是热焓值。
2 结果与讨论
2.1 PBT 二聚体的键离能
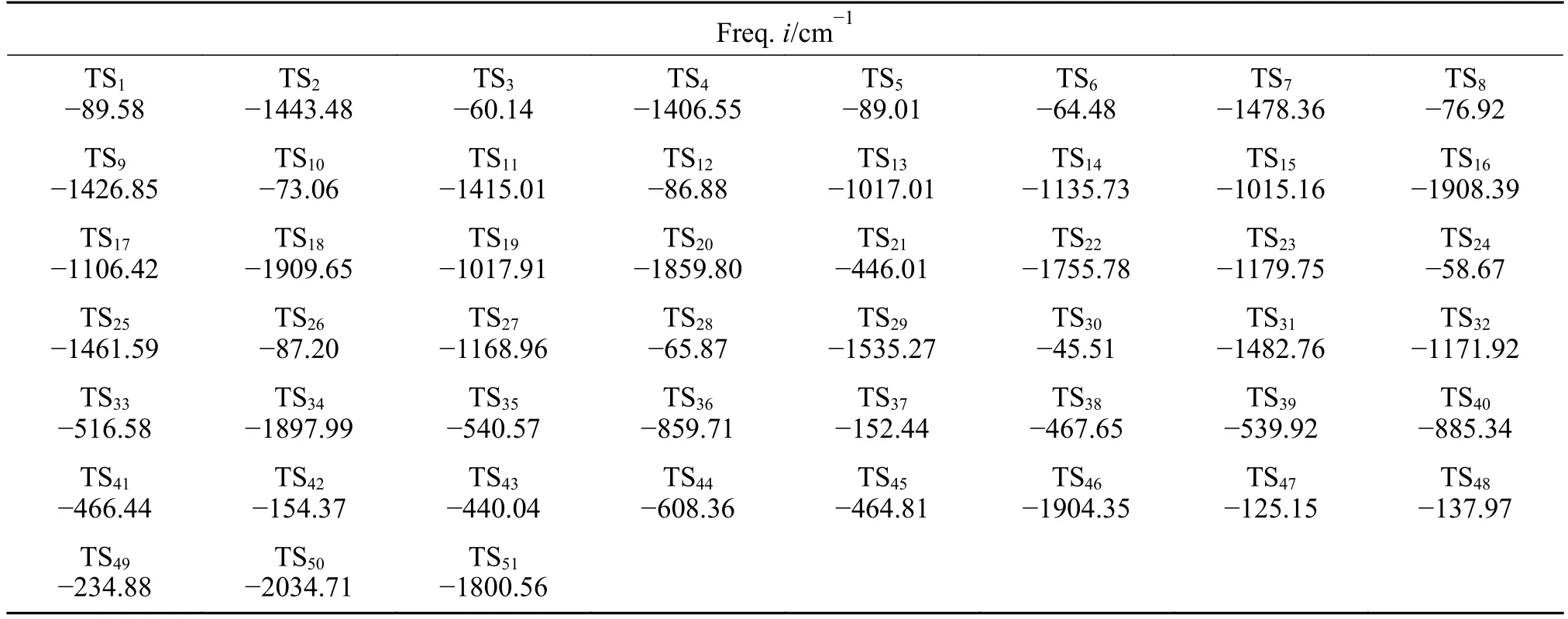
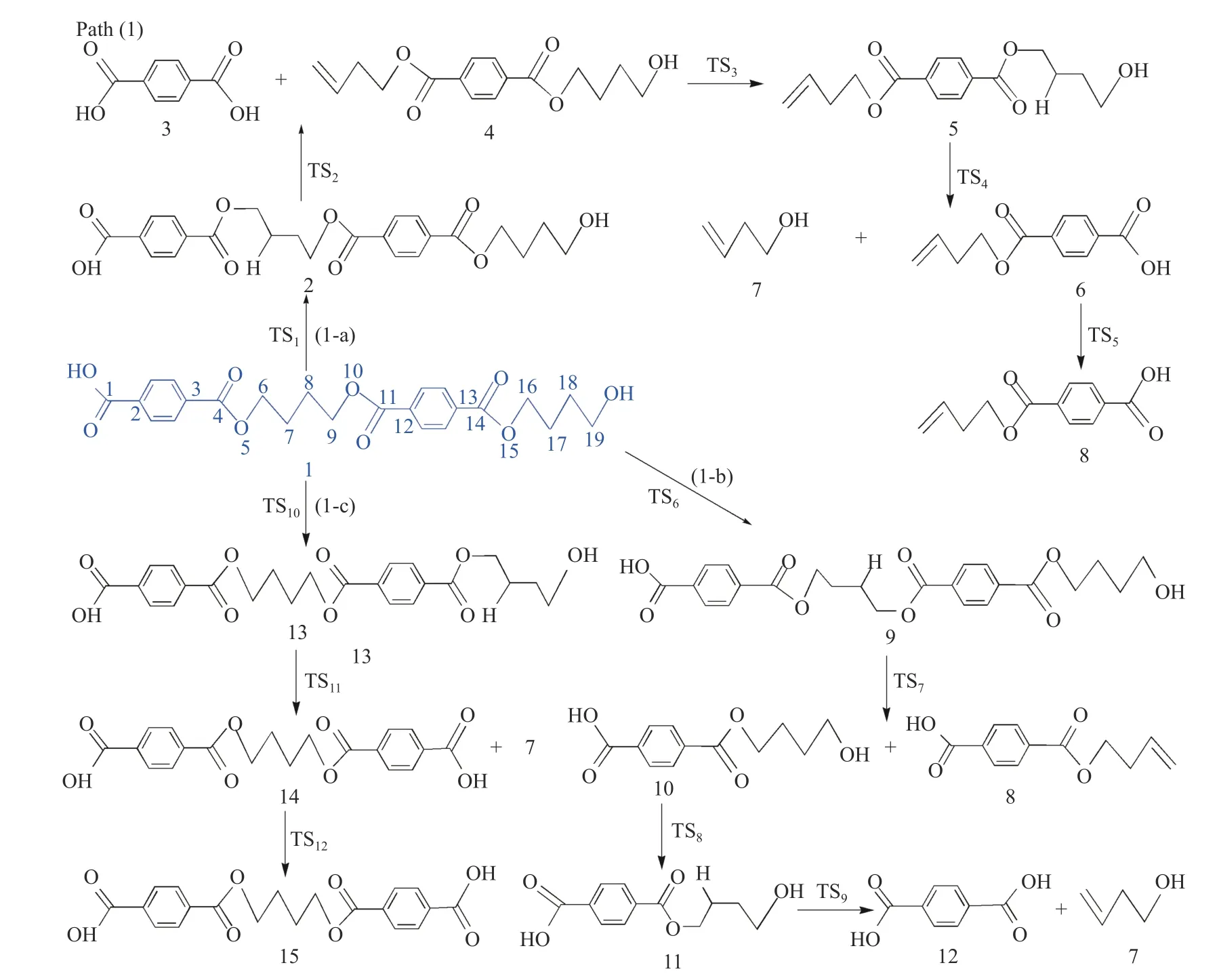
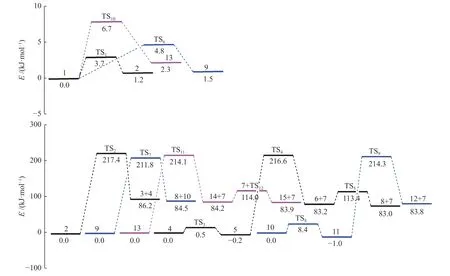
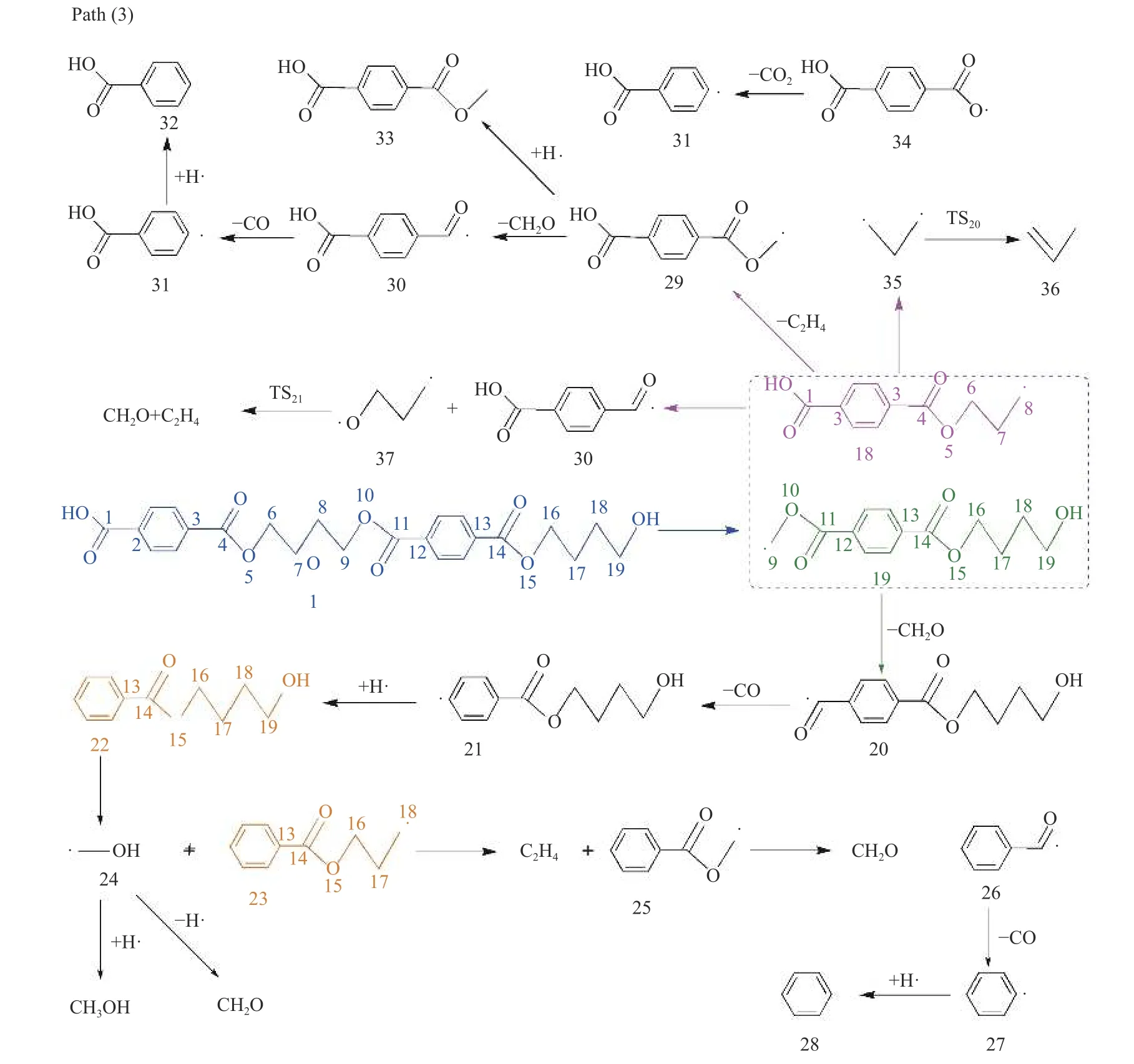
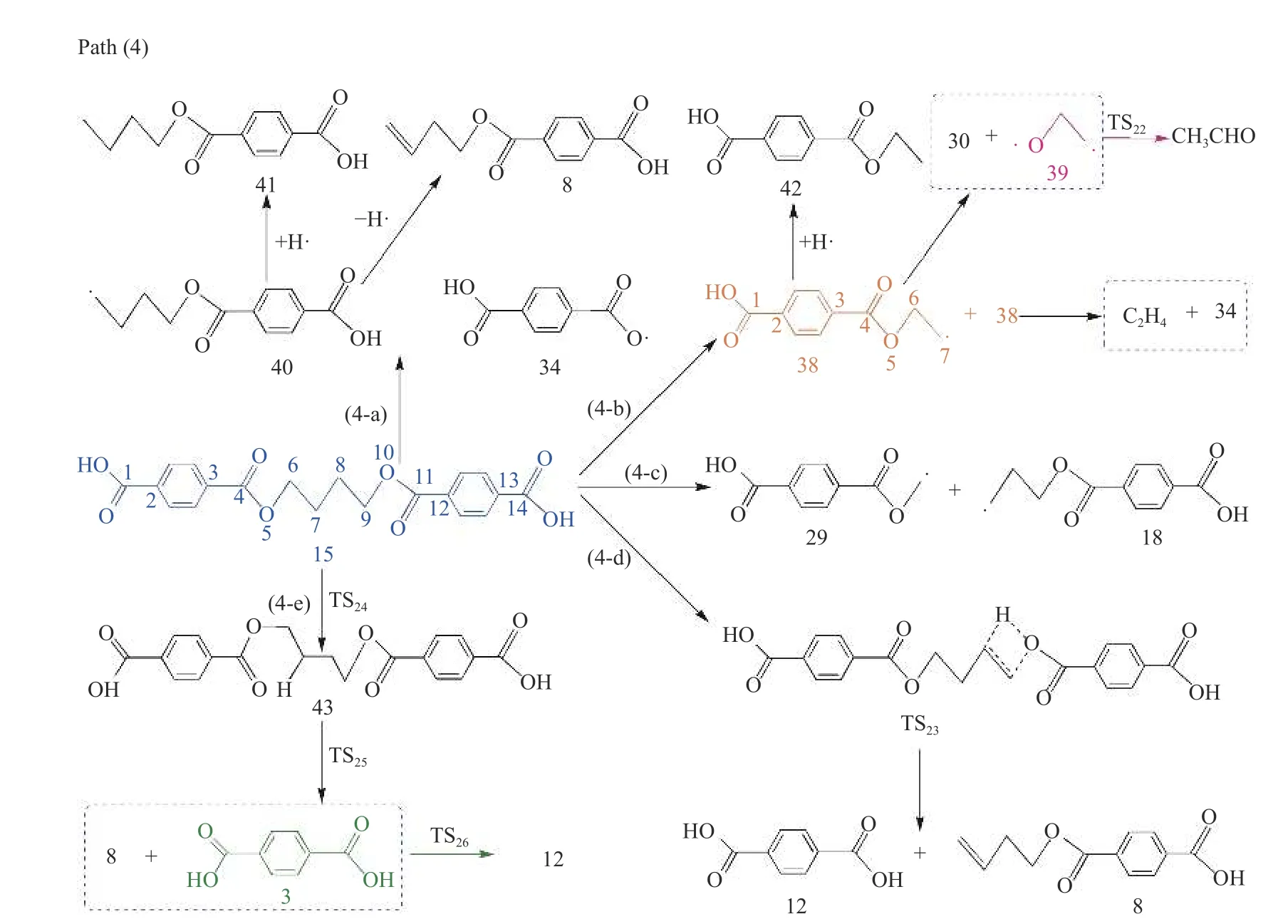
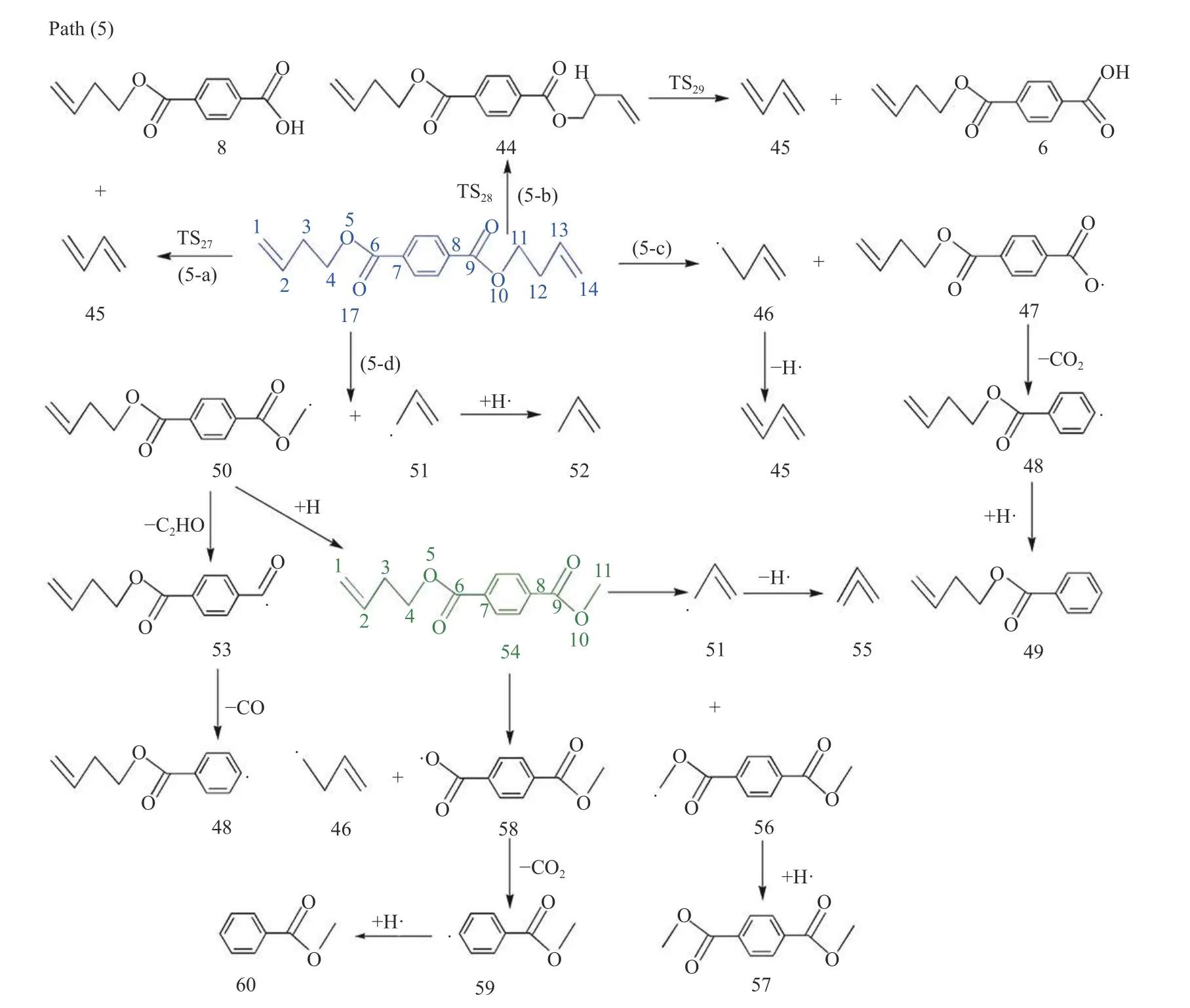
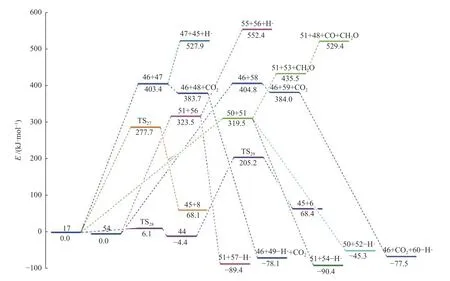
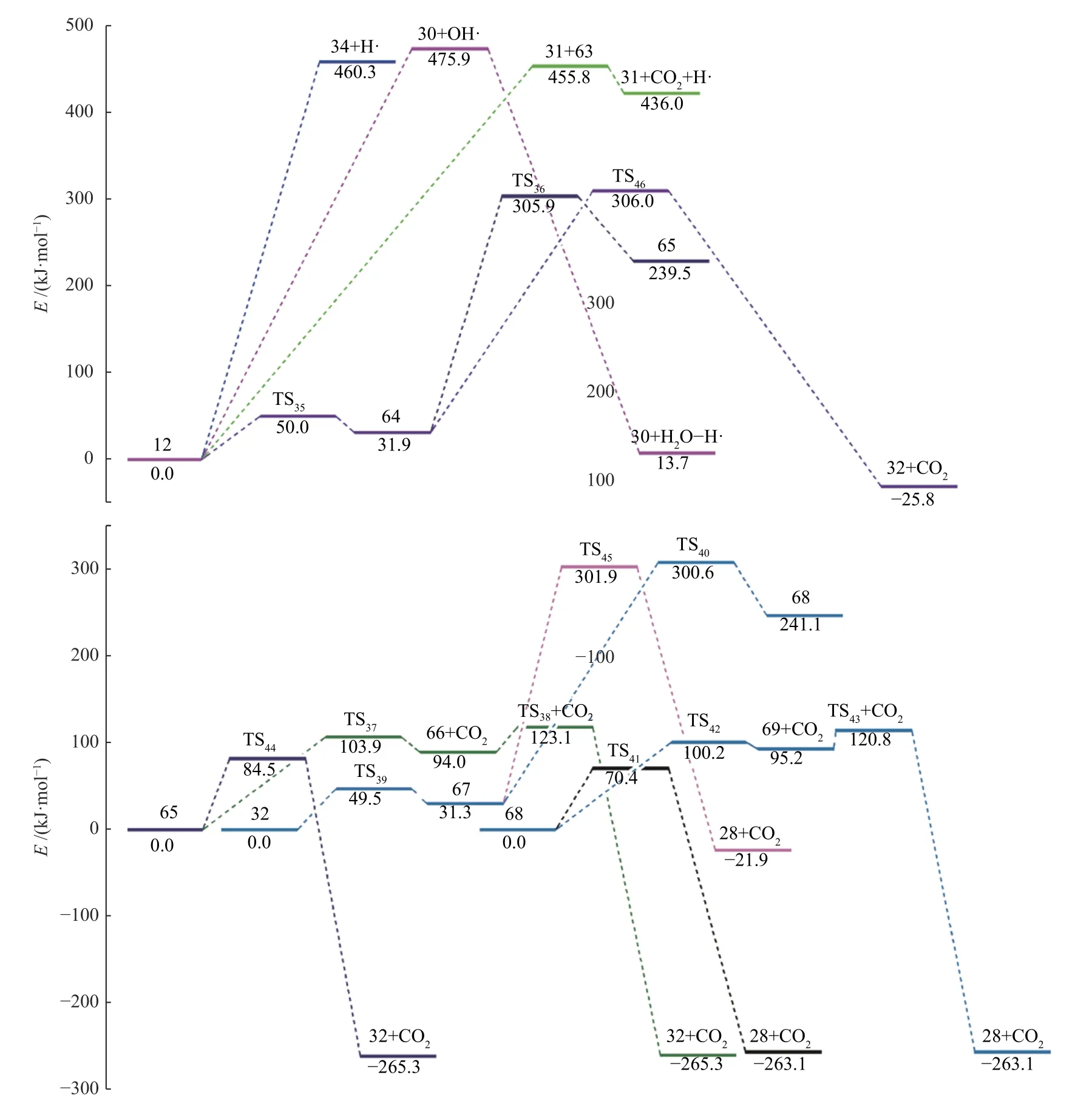
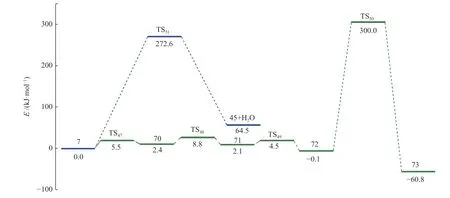
键离能是从能量角度描述化学键强弱的物理量,键离能值越大,化学键越不容易断裂,键离能值越小,化学键越容易断裂。PBT 二聚体主链上主要键的键离能值如图1 所示。从图1 可以看出,PBT主链上C-C 键的键离能最小,其次为C-O 键,而C-Caromatic的键离能最大。且PBT 二聚体主链上丁烷基(-C(6/16)H2-C(7/17)H2-C(8/18)H2-C(9/19)H2-)中的C-C 键的键离能大小为C(6/16)-C(7/17)≈C(8/18)-C(9/19) 图1 PBT 二聚体的优化结构和键离能值Figure 1 BDE values and optimal structure of PBT dimer (unit: kJ/mol) PBT 初始热降解可能主要通过协同反应机理和自由基反应机理进行,本工作设计了四元环过渡态和六元环过渡态两条协同反应路径,基于PBT 二聚体键离能计算设计了一条自由基反应路径。协同反应机理在2.2 中讨论,自由基反应机理在2.3 中讨论。 根据相关的PBT 热解实验研究[34,35],提出了PBT 二聚体热解的两条可能协同反应路径。图2和图3 描绘了通过六元环过渡态进行的协同反应路径及反应能垒,图4 和图5 描绘了通过四元环过渡态进行的协同反应路径及反应能垒,表1 为各热解路径中过渡态唯一的虚频。 表1 各热解路径中过渡态唯一的虚频Table 1 Sole imaginary frequency of various transition states 图2 反应路径(1)中的可能降解过程示意图Figure 2 Proposed decomposition process in reaction path (1) 图3 反应路径(1)的能垒示意图Figure 3 Energy barriers schematic diagram of reaction path (1) 图4 反应路径(2)中的可能降解过程示意图Figure 4 Proposed decomposition process in reaction path (2) 图5 反应路径(2)的能垒示意图Figure 5 Schematic diagram of energy barriers in reaction path (2) 在反应路径(1)(如图2 所示)中,对模型化合物1的降解过程设计了三条六元环过渡态可能反应路径。在路径(1-a)中,模型化合物1 先经同分异构化反应经过渡态TS1由二面角C(4)-O(5)-C(6)-C(7)扭转形成同分异构体2,反应能垒较低,为3.7 kJ/mol。同分异构体2 再经过六元环状过渡态TS2发生协同反应生成化合物4 和对苯二甲酸异构体3,其反应能垒为217.4 kJ/mol。化合物4 经过类似上述反应形成丁烯醇7 和对苯二甲酸单丁烯酯异构体6,反应能垒分别为0.5 和216.8 kJ/mol。对苯二甲酸单丁烯酯异构体6 再经反应能垒为30.2 kJ/mol 的TS5裂解生成更为稳定的对苯二甲酸单丁烯酯8,并释放0.2 kJ/mol 的热量。类似反应路径(1-a),在路径(1-b)中,模型化合物1 先经同分异构化反应经过TS6由二面角C(8)-C(9)-O(10)-C(11)扭转形成同分异构体9,该反应能垒为6.7 kJ/mol。同分异构体9 再通过六元环状过渡态TS7发生协同反应生成8 和化合物10,其反应能垒为211.8 kJ/mol。化合物10 经过类似上述反应形成对苯二甲酸12和7,反应能垒分别为8.4 和215.3 kJ/mol。在路径(1-c)中,模型化合物1 也可先经同分异构化反应经过TS10由二面角C(14)-O(15)-C(16)-C(17)扭转形成同分异构体13,该反应能垒为4.8 kJ/mol。同分异构体13 进一步通过六元环状过渡态TS11发生协同反应,生成二对苯二甲酸-1,4-丁二酯异构体14 和7,该反应能垒为214.1 kJ/mol。二对苯二甲酸-1,4-丁二酯异构体14 再经反应能垒为29.8 kJ/mol 的TS12转化为更稳定的结构15,并释放0.3 kJ/mol 的热量。通过对比分析路径(1-a)-(1-c)的速控步反应能垒,发现PBT 二聚体末端酯键位置发生协同反应和中间酯键位置发生协同反应能量相差很小,分别为217.4、211.8 和214.1 kJ/mol,由此推断,PBT 二聚体热解反应可能是主链酯键位置随机发生裂解,生成对苯二甲酸异构体、丁烯醇、二对苯二甲酸-1,4-丁二酯和对苯二甲酸单丁烯酯等产物。 在反应路径(2)(如图4 所示)中,对模型化合物1 的降解过程设计了三条四元环过渡态可能反应路径。在路径(2-a)中,模型化合物1 经过四元环过渡态TS13发生协同反应生成丁烯醇7 和二对苯二甲酸-1,4-丁二酯15,该反应能垒为279.5 kJ/mol。类似反应路径(2-a),在路径(2-b)中,模型化合物1通过TS14生成对苯二甲酸单丁烯酯8 和对苯二甲酸丁醇16,反应能垒为281.5 kJ/mol。对苯二甲酸丁醇16 经过类似上述反应生成对苯二甲酸12 和7,该反应能垒为268.9 kJ/mol。对苯二甲酸丁醇16也可经过TS16脱掉一个水分子生成8,其反应能垒为290.4 kJ/mol。在路径(2-c)中,模型化合物1 通过TS17生成12 和化合物4,反应能垒为279.9 kJ/mol。化合物4 既能通过类似上述反应生成8 和7,也能经过TS18脱掉一个水分子生成对苯二甲酸二丁烯酯17,反应能垒分别为276.7 和290.8 kJ/mol。通过对比分析路径(2-a)-(2-c)的速控步反应能垒,发现PBT 主链中间酯键位置和末端酯键位置通过四元环过渡态进行协同反应的能垒相差不大,分别为279.9、281.5 和279.5 kJ/mol,这再次表明,PBT初始热解可能是主链酯键位置随机发生裂解反应,生成对苯二甲酸、丁烯醇和对苯二甲酸单丁烯酯等产物。 根据BDE 的计算结果和相关的实验研究[36,37],提出断裂键离能最小的一条自由基反应路径。因C(18)-C(19)键可能受末端效应的影响,故以断裂C(8)-C(9)键来阐述PBT 自由基裂解过程,热解反应路径如图6 所示,反应能垒示意图如图7所示。 图6 反应路径(3)中的可能降解过程示意图Figure 6 Proposed decomposition process in reaction path (3) 在反应路径(3)(如图6 所示)中,模型化合物1通过C(8)-C(9)键断裂生成自由基18 和19,该反应能垒为381.6 kJ/mol。对自由基18 设计了三条可能反应路径,第一条路径是18 能够通过酰基氧键断裂和TS21生成甲醛和乙烯,该反应能垒分别为427.9 和114.3 kJ/mol。第二条路径是自由基18能够通过C(6)-C(7)键和酰基氧键断裂、脱羰反应等过程形成自由基31,该反应能垒分别为112.7、113.6 和92.2 kJ/mol。自由基31 进一步获得氢原子形成苯甲酸32,该过程释放461.7 kJ/mol 的热量。或自由基18 能够通过C(6)-C(7)键断裂形成自由基29,反应能垒为112.7 kJ/mol,自由基29 再进一步获得氢原子生成对苯二甲酸甲酯33,并释放412.9 kJ/mol 的热量。第三条路径是自由基18能够通过烷基氧键断裂生成自由基34 和自由基35,该反应能垒为407.9 kJ/mol。自由基34 进一步通过C-Caromatic断裂生成CO2和自由基31,并释放24.3 kJ/mol 的热量。或自由基18 能够通过烷基氧键断裂和TS20形成丙烯36,反应能垒分别为407.9和112.4 kJ/mol。对自由基19 设计了一条可能反应路径,自由基19 通过酰基氧键断裂和脱羰反应两个过程形成自由基21,该反应能垒分别为113.2和90.0 kJ/mol。自由基21 进一步获得氢原子生成苯甲酸丁醇22,该过程释放461.6 kJ/mol 的热量。苯甲酸丁醇22 可通过C(18)-C(19)键断裂形成自由基24,其反应能垒为371.8 kJ/mol。自由基24 再获得氢原子生成甲醇,该过程释放396.2 kJ/mol 的热量。苯甲酸丁醇22 也可通过C(18)-C(19)键断裂和脱氢反应两个过程形成甲醛,反应能垒分别为371.8 和106.0 kJ/mol。自由基23 能够通过C(16)-C(17)键断裂、酰基氧键断裂和脱羰反应等过程生成自由基27,该过程的反应能垒分别为111.4、111.4和97.6 kJ/mol。自由基27 再获得氢原子生成苯28,该反应过程释放461.7 kJ/mol 的热量。 对反应路径(3)的反应能垒进行分析发现,自由基18 和19 生成CO、乙烯和甲醛的速控步反应能垒相对较小,分别为113.2、112.7 和113.2 kJ/mol,而形成苯甲酸、苯、对苯二甲酸甲酯、丙烯和CO2的速控步反应能垒较其他产物而言较高,因此推断,CO、乙烯和甲醛可能是PBT 自由基热解反应过程的主要产物。 对PBT 二聚体初始热解过程的各反应路径进行热力学和动力学分析发现,PBT 二聚体通过六元环过渡态进行协同反应(Path (1))的速控步反应能垒(约215.0 kJ/mol)明显低于通过四元环过渡态进行协同反应(Path (2))的速控步反应能垒(约280.0 kJ/mol)和自由基反应(Path (3))的速控步反应能垒(381.6 kJ/mol),在协同反应中,中间酯键位置和末端酯键位置发生协同反应速控步能垒相差很小,这表明,PBT 初始热解反应过程中可能主要是PBT 主链酯键随机位置经过六元环过渡态进行的协同反应,主要产物为丁烯醇、对苯二甲酸、对苯二甲酸单丁烯酯、对苯二甲酸二丁烯酯和二对苯二甲酸-1,4-丁二酯等物质,这与相关热解实验研究[21-23,27,38]中对PBT 热解主要产物的描述基本相符,但相关热解实验文献中并没有观察到丁烯醇,故推测随着反应的进行,丁烯醇可能会进一步降解,其降解机理在反应路径(8)中讨论。由于自由基反应速控步能垒明显高于协同反应速控步能垒,自由基反应发生的可能性较小,因此,CO、乙烯和甲醛等自由基热解反应产物含量较少[16,17]。 根据PBT 热解初始反应和相关的实验研究[39-41],提出了二对苯二甲酸-1,4-丁二酯、对苯二甲酸二丁烯酯、对苯二甲酸单丁烯酯、对苯二甲酸和丁烯醇五种主要产物二次降解的可能反应路径并分析了相应的反应机理。图8 和图9 描述了二对苯二甲酸-1,4-丁二酯的可能反应路径及反应能垒。图10 和图11 描述了对苯二甲酸二丁烯酯的可能反应路径及反应能垒。图12 和图13 描述了对苯二甲酸单丁烯酯的可能反应路径及反应能垒。图14和图15 描述了对苯二甲酸的可能反应路径及反应能垒。图16 和图17 描述了丁烯醇的可能反应路径及反应能垒。 图8 反应路径(4)中的可能降解过程示意图Figure 8 Proposed decomposition process in reaction path (4) 图9 反应路径(4)的能垒示意图Figure 9 Schematic diagram of energy barriers in reaction path (4) 图10 反应路径(5)中的可能降解过程示意图Figure 10 Proposed decomposition process in reaction path (5) 图11 反应路径(5)的能垒示意图Figure 11 Schematic diagram of energy barriers in reaction path (5) 图12 反应路径(6)中的可能降解过程示意图Figure 12 Proposed decomposition process in reaction path (6) 图13 反应路径(6)的能垒示意图Figure 13 Schematic diagram of energy barriers in reaction path (6) 图14 对苯二甲酸降解反应路径示意图Figure 14 Reaction path of terephthalate acid degradation 图15 对苯二甲酸降解的反应能垒示意图Figure 15 Energy barriers of terephthalate acid degradation 图16 反应路径(8)中的可能降解过程示意图Figure 16 Proposed decomposition process in reaction path (8) 图17 反应路径(8)的能垒示意图Figure 17 Schematic diagram of energy barriers in reaction path (8) 在反应路径(4)(如图8 所示)中,对二对苯二甲酸-1,4-丁二酯15 的降解过程设计了五条可能反应路径,其中,路径(4-a)-(4-c)为自由基反应路径,路径(4-d)-(4-e)为协同反应路径。在路径(4-a)中,二对苯二甲酸-1,4-丁二酯15 通过烷基氧键断裂生成自由基34 和自由基40,其反应能垒为404.1 kJ/mol。自由基40 通过脱去氢原子生成对苯二甲酸单丁烯酯8,该反应能垒为139.7 kJ/mol。或自由基40 获得氢原子生成对苯二甲酸单丁酯41,该过程释放421.6 kJ/mol 的热量。在路径(4-b)中,二对苯二甲酸-1,4-丁二酯15 通过C(7)-C(8)键断裂生成自由基38,其反应能垒为389.2 kJ/mol。自由基38 能够进一步获得氢原子生成对苯二甲酸乙酯42,该过程释放427.8 kJ/mol 的热量。自由基38 也能通过O(5)-C(6)断裂自由基34 和乙烯,其反应能垒为130.0 kJ/mol。自由基38 还能通过C(4)-O(5)断裂生成自由基30 和自由基39,自由基39 进一步通过TS22生成乙醛,其中,反应能垒分别为425.6 和142.9 kJ/mol。路径(4-c)中,二对苯二甲酸-1,4-丁二酯15 能够通过C(6)-C(7)键断裂生成自由基29 和自由基18,其反应能垒为379.2 kJ/mol。在路径(4-d)中,二对苯二甲酸-1,4-丁二酯15 经过类似反应路径(2-a)生成对苯二甲酸12 和8,其反应能垒为286.2 kJ/mol。类似反应路径(1-a),在路径(4-e)中,二对苯二甲酸-1,4-丁二酯15 通过TS24形成同分异构体43,反应能垒为7.0 kJ/mol。同分异构体43 再经过TS25生成对苯二甲酸异构体3 和8,其反应能垒219.5 kJ/mol。对苯二甲酸异构体3 进一步通过反应能垒为29.4 kJ/mol 的TS26异构化生成更稳定的对苯二甲酸12,并释放0.4 kJ/mol的热量。 基于反应路径(4)的动力学和热力学分析可知,路径(4-a)-(4-e)的速控步反应能垒分别为404.1、389.2、379.2、286.2 和219.5 kJ/mol。因此,路径(4-e)中进行的协同反应可能是二对苯二甲酸-1,4-丁二酯降解反应过程中的最优反应,其中,形成的对苯二甲酸单丁烯酯和对苯二甲酸可能为二对苯二甲酸-1,4-丁二酯降解的主要产物。 在反应路径(5)(如图10 所示)中,对对苯二甲酸二丁烯酯17 的降解过程设计了四条可能反应路径,其中,路径(5-a)-(5-b)为协同反应路径,路径(5-c)-(5-d)为自由基反应路径。在路径(5-a)中,类似反应路径(2-a)对苯二甲酸二丁烯酯17 通过TS27生成45 和对苯二甲酸单丁烯酯8,该反应能垒为277.7 kJ/mol。在路径(5-b)中,对苯二甲酸二丁烯酯17 经过类似反应路径(1-a)先经过TS28形成同分异构体44,该反应能垒分别为6.1 kJ/mol。同分异构体44 再经过TS29生成1,3-丁二烯45 和对苯二甲酸单丁烯酯异构体6,反应能垒为209.6 kJ/mol。在路径(5-c)中,对苯二甲酸二丁烯酯17 可通过烷基氧键断裂和脱氢反应生成45,反应能垒分别为403.4 和124.5 kJ/mol。或对苯二甲酸二丁烯酯17 通过烷基氧键断裂形成自由基46 和自由基47,该反应能垒为403.4 kJ/mol。自由基47 进一步通过C-Caromatic断裂生成CO2和自由基48,并释放22.0 kJ/mol 的热量。自由基48 再进一步获得氢原子最终生成苯甲酸丁烯酯49,该过程释放461.8 kJ/mol 的热量。在路径(5-d)中,对苯二甲酸二丁烯酯17 通过C(11)-C(12)键和酰基氧键断裂、脱羰反应最终生成自由基48,该过程反应能垒分别为319.5、116.0 和93.9 kJ/mol。自由基51 获得氢原子生成丙烯52,其过程释放364.8 kJ/mol 的热量。自由基50 获得氢原子生成中间体54,该过程释放409.9 kJ/mol 的热量。中间体54 既能通过烷基氧键断裂形成自由基46 和自由基58,反应能垒为404.8 kJ/mol。自由基58 进一步通过C-Caromatic断裂生成CO2和自由基59,并释放23.1 kJ/mol 的热量。自由基59 再进一步获得氢原子生成苯甲酸甲酯60,该过程释放461.5 kJ/mol的热量。中间体54 也能通过C(3)-C(4)键断裂形成自由基56,反应能垒为323.5 kJ/mol。自由基56 再获得氢原子生成对苯二甲酸二甲酯57,该过程释放412.9 kJ/mol 的热量。或中间体54 通过C(3)-C(4)键断裂和脱氢反应两个过程最终生成丙二烯55,反应能垒分别为323.5 和228.9 kJ/mol。 对反应路径(5)的各小路径反应能垒分析发现,路径(5-a)-(5-d)的速控步能垒分别为277.7、209.6、430.4 和319.5 kJ/mol。因此,在苯二甲酸二丁烯酯降解过程中,路径(5-b)可能为最优反应路径,而路径(5-a)和(5-d)可能为竞争反应路径。通过分析对苯二甲酸二丁烯酯降解过程中形成1,3-丁二烯和对苯二甲酸单丁烯酯的反应能垒可知,1,3-丁二烯和对苯二甲酸单丁烯酯可能主要通过六元环过渡态发生协同反应形成。 在反应路径(6)(如图12 所示)中,对对苯二甲酸单丁烯酯8 的降解过程设计了五条可能反应路径。其中路径(6-a)-(6-c)为协同反应路径,路 径(6-d)-(6-e)为自由基反应路径。类似反应路径(1-a),在路径(6-a)中,对苯二甲酸单丁烯酯8通过TS30形成同分异构体61,同分异构体61 进一步通过TS31生成1,3-丁二烯45 和对苯二甲酸异构体3,反应能垒分别为3.4 和204.4 kJ/mol。在路径(6-b)中,对苯二甲酸单丁烯酯8 经类似反应路径(2-a)通过TS32生成45 和对苯二甲酸12,其反应能垒为273.5 kJ/mol。在路径(6-c)中,对苯二甲酸单丁烯酯8 通过TS33形成同分异构体62,同分异构体62 再通过TS34生成CO2和苯甲酸单丁烯酯49,其反应能垒分别为50.1 和277.0 kJ/mol。在路径(6-d)中,对苯二甲酸单丁烯酯8 通过C(6)-C(7)键断裂生成自由基29 和自由基51,该过程反应能垒为323.8 kJ/mol。在路径(6-e)中,8 通过烷基氧键断裂生成自由基34 和自由基46,其反应能垒为405.9 kJ/mol。 对反应路径(6)中各小路径进行动力学和热力学分析发现,路径(6-a)-(6-e)的速控步反应能垒分别为204.4、273.5、277.0、323.8 和405.9 kJ/mol。因此,在对苯二甲酸单丁烯酯的降解过程中,路径(6-a)中的六元环过渡态进行的协同反应可能为最优反应路径,该反应过程中形成的对苯二甲酸和1,3-丁二烯可能是对苯二甲酸单丁烯酯的主要产物,而路径(6-b)和(6-c)可能为竞争反应路径。由于在对苯二甲酸单丁烯酯分解过程中,路径(6-d)和(6-e)的速控步反应能垒相对较高,因此,这两条反应路径可能难以进行。 在反应路径(7)(如图14 所示)中,对对苯二甲酸12 的降解过程设计了四条可能反应路径。其中,路径(7-a)-(7-c)为自由基反应路径,路径(7-d)为协同反应路径。在路径(7-a)中,对苯二甲酸12 的O-H 发生断裂形成自由基34 和氢自由基,该反应能垒为460.3 kJ/mol。在路径(7-b)中,对苯二甲酸12 通过酰基氧键断裂形成自由基30 和氢氧根自由基,反应能垒为475.9 kJ/mol。氢氧根自由基进一步获得氢原子最终生成H2O,并释放462.2 kJ/mol 的热量。在路径(7-c)中,对苯二甲酸12 通过裂解C-Caromatic键裂解形成自由基31 和63,其过程反应能垒为455.8 kJ/mol。自由基63 进一步脱氢原子形成CO2,该过程释放19.8 kJ/mol的热量。在路径(7-d)中,对苯二甲酸形成苯甲酸、苯和CO2有三种方式,第一种是对苯二甲酸先经过同分异构化通过TS35形成同分异构体64,反应能垒为50.0 kJ/mol。同分异构体64 中O-H 中氢原子转移至苯C(4)直接通过TS46生成苯甲酸和CO2,反应能垒为274.1 kJ/mol。苯甲酸以类似上述反应直接生成苯和CO2,其反应能垒分别为49.5 和270.6 kJ/mol。第二种是对苯二甲酸先经过同分异构化通过TS35形成同分异构体64,同分异构体64 中O-H 中氢原子转移至苯C(5)通过TS36形成自由基65,自由基65 进一步通过TS44生成苯甲酸和CO2,反应能垒为274.0 和84.6 kJ/mol。苯甲酸以类似上述反应生成苯和CO2,反应能垒为269.3 和70.4 kJ/mol。第三种是对苯二甲酸先经过同分异构化通过TS35形成同分异构体64,同分异构体64 中O-H 中氢原子转移至苯C(5)通过TS36形成自由基65,自由基65 经过C-Caromatic断裂通过TS37形成CO2和自由基66,自由基66 进一步通过TS38形成苯,反应能垒为103.9 和29.1 kJ/mol。苯甲酸以类似上述反应生成苯,该反应能垒为25.6 kJ/mol。 对反应路径(7)的各小路径进行动力学和热力学分析发现,路径(7-a)-(7-d)的速控步能垒分别为460.3、475.9、455.8 和274.1 kJ/mol,因此,路径(7-d)可能为对苯二甲酸降解的最优反应路径,该反应中形成的苯甲酸、苯和CO2可能是对苯二甲酸的主要产物。而在路径(7-d)中,对苯二甲酸形成苯甲酸、苯和CO2有三种方式,根据相关实验研究[34,35]可知,生成苯甲酸、苯和CO2主要以第一种反应方式,故推测第二种和第三种可能为竞争反应路径。 在反应路径(8)(如图16 所示)中,对丁烯醇的降解过程设计了两条路径,第一条路径是丁烯醇7 先经三次同分异构化反应形成同分异构体72,同分异构体72 进一步通过TS50裂解生成四氢呋喃73,反应能垒分别为300.2 kJ/mol。第二条路径是丁烯醇7 直接通过TS51裂解生成1,3-丁二烯45,反应能垒为272.6 kJ/mol。通过比较路径(8)中两条小路径中的反应能垒,可以发现丁烯醇通过协同反应脱水生成1,3-丁二烯的反应能垒(272.6 kJ/mol)比丁烯醇通过分子内氢转移生成四氢呋喃的反应能垒要低(300.2 kJ/mol),故推测1,3-丁二烯的生成可能优于四氢呋喃。 对上述反应路径(4)-(8)热解反应过程进行热力学和动力学分析可知,二对苯二甲酸-1,4-丁二酯主要通过协同反应生成对苯二甲酸和对苯二甲酸单丁烯酯;对苯二甲酸二丁烯酯主要通过协同反应生成对苯二甲酸单丁烯酯和1,3-丁二烯;对苯二甲酸单丁烯酯主要通过协同反应生成对苯二甲酸和1,3-丁二烯;对苯二甲酸主要通过协同反应脱羧直接生成苯甲酸和CO2;丁烯醇主要通过协同反应脱水生成1,3-丁二烯,而丁烯醇通过分子内氢转移形成四氢呋喃可能为竞争反应。 对生成CO2的相关反应路径进行动力学和热力学分析可知,发现通过协同反应脱羧的反应能垒(274.0 kJ/mol(Path (7))、277.0 kJ/mol(Path (6))、274.1 kJ/mol(Path (7)))比自由基反应(403.4 kJ/mol(Path (5))、407.9 kJ/mol(Path (5))、404.8 kJ/mol(Path (5))、455.8 kJ/mol(Path (7)))的速控步反应能垒要低,因此推断,CO2可能主要在二次反应过程中通过协同反应脱羧生成。对生成CO 的相关反应路径进行动力学和热力学分析可知,CO 主要通过含羰基自由基脱羰生成,在PBT 初始自由基热解过程中(Path (3))形成羰基自由基的速控步能垒(381.6 kJ/mol)明显高于二次降解过程中(Path(5))的速控步能垒(319.5 kJ/mol),因此,CO 可能主要在二次降解过程中形成。通过对PBT 二聚体主要产物的二次降解过程中分析可知,在反应路径(4)-(8)过程中主要生成了苯甲酸、苯、CO2和1,3-丁二烯等主要产物,而CO 和四氢呋喃为竞争产物,上述分析结果与相关实验结果[21,22,38-40]一致。 本工作采用密度泛函理论方法M062X/6-311G(d)研究了PBT 的热解反应机理,提出了PBT 二聚体热降解过程的各种可能反应路径,计算了PBT二聚体各种可能反应路径的热力学及动力学参数,得出以下结论。 PBT 主链上进行协同反应所需的能量明显低于主链上C-C 和C-O 键断裂所需的能量,在协同反应中,PBT 主链末端酯键位置与中间酯键位置的反应能垒相差很小,并且通过六元环过渡态的反应比通过四元环过渡态的反应更容易发生,因此,PBT 的初始热解过程可能主要是主链酯键位置随机通过六元环过渡态进行的协同反应。 PBT 初始降解形成的主要产物有二对苯二甲酸-1,4-丁二酯、对苯二甲酸二丁烯酯、对苯二甲酸单丁烯酯、对苯二甲酸等,其中,PBT 末端酯键位置裂解会形成丁烯醇,而相关热解实验文献中并没有观察到丁烯醇,丁烯醇可进一步降解生成了1,3-丁二烯或四氢呋喃。 PBT 初始热解主要产物的二次降解反应过程主要以协同反应为主,主要热解产物是对苯二甲酸、苯甲酸、苯、1,3 丁二烯和CO2等,主要竞争产物是CO 和四氢呋喃。 PBT 热解过程中,CO2主要通过协同反应脱羧生成,CO 主要通过含羰基自由基脱羰生成。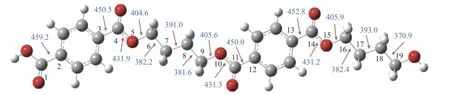
2.2 PBT 二聚体热降解的协同反应机理


2.3 PBT 二聚体热降解的自由基反应机理
2.4 PBT 主要热解产物的二次反应机理





3 结 论

