胃癌组织中UBA2表达的临床意义及其对细胞增殖和凋亡的影响
李晓锋,毛爱枝,李国喜
胃癌在恶性肿瘤的发病率中仅次于肺癌,是常见的消化道恶性肿瘤之一。目前,胃癌的发病机制尚未明确,但普遍认为胃癌的发生发展涉及多种癌基因与抑癌基因活性的变化[1-2]。类泛素蛋白(Small ubiquitin-like modifier,SUMO)具有高度保守的特点,其结构与泛素相似,可介导靶蛋白参与细胞多种生命活动,研究发现SUMO化修饰异常与多种重大疾病相关[3]。UBA2是SUMO化修饰过程中重要酶系的一个亚基,其表达直接影响体内SUMO化修饰水平[4]。据报道,UBA2在肝癌[5]、胃癌[6]、前列腺癌[7]等恶性肿瘤中呈高表达,但其在胃癌中的临床意义和生物学功能尚未明确,故本研究将探究胃癌组织中UBA2表达的临床意义及其对细胞增殖和凋亡的影响,为胃癌的临床诊断和生物治疗提供理论基础。
1 材料与方法
1.1 实验材料
组织标本来源于2017年5月至2018年4月西安交通大学第一附属医院接受胃癌切除手术患者,癌旁正常组织距癌<3 cm,胃癌组织术后经病理检测确诊,冻存于液氮罐中待测,所有患者均签署知情同意书,且术前未接受放化疗等治疗。人胃癌细胞株AGS和正常胃黏膜上皮细胞株GES-1购自美国ATCC菌种保藏中心。
1.2 仪器与试剂
qRT-PCR仪(加拿大LUMEX公司);全自动凝胶成像仪(美国BIO-RAD公司);流式细胞仪(美国ThermoFisher公司);脂质体Lipofectamine 2000试剂盒(美国Amresco公司);逆转录试剂盒(美国Promega公司);TRIzol、RPMI 1640、DMEM培养基和胎牛血清(美国Gibco公司);SYBR Green PCR Master Mix(美国Invitrogen公司);MTT粉末(上海冠导生物工程有限公司);蛋白一抗(美国Abcam公司);Annexin V-FITC/PI试剂盒(武汉博士德生物工程有限公司)。
1.3 细胞培养
正常解冻保种AGS、GES-1细胞,培养于含10%胎牛血清的DMEM中,置于37 ℃、CO2培养箱中孵育;当细胞贴壁80%左右时,进行传代培养;取生长状况良好的细胞用于后续实验,并作保种处理。
1.4 细胞转染
参照Lipofectamine 2000转染试剂盒说明书步骤,将UBA2过表达载体(UBA2 mimic组)和低表达载体(siRNA UBA2组)转染至AGS细胞,另正常培养AGS细胞作对照;转染成功后,用含10%胎牛血清的RPMI 1640培养基培养,收集细胞用于后续实验。
1.5 qRT-PCR检测UBA2 mRNA的表达
采用TRIzol法提取组织标本和细胞中总RNA,参照逆转录试剂盒说明书步骤逆转录合成cDNA模板,混入SYBR Green PCR Master Mix进行qRT-PCR检测,反应条件:预变性95 ℃ 15 s,变性95 ℃ 5 s,退火60 ℃ 30 s,延伸72 ℃ 30 s,共40个循环。每个样本重复3次实验,以GADPH为内参,采用2-ΔΔCt值表示UBA2 mRNA的相对表达量,其引物序列[8]见表1。

表1 基因引物序列
1.6 Western blot法检测UBA2 蛋白的表达
采用RIPA法提取组织标本和细胞中的总蛋白,检测提取蛋白浓度,取30~100 μg进行凝胶电泳,待蛋白完全分离后,电转仪至PVDF膜上;经封闭、一抗、二抗等免疫反应后,滴加ECL发光液显示条带,应用全自动凝胶成像仪检测蛋白条带信号。
1.7 MTT检测AGS细胞的增殖活力
将AGS细胞以2×105个/mL接种于96孔板,待细胞贴壁50%~60%时进行转染,成功后分别培养24 h、48 h和72 h,加入含20 μL MTT液的培养基200 μL,避光条件下培养4 h,吸弃培养基,加入150 μL二甲基亚砜溶解孔板底部紫色结晶,置于酶标仪上轻微震荡6 min,于570 nm下检测各孔的光密度值(optical density,OD),作5次独立重复实验。
1.8 流式细胞仪检测AGS细胞的凋亡情况
转染后细胞培养48 h,以800 rpm离心细胞5 min,去上清,用预冷的PBS缓冲液清洗2次,加入100 μL标记液重悬细胞,避光条件下室温反应15 min,离心5 min沉降细胞后,用PBS缓冲液清洗1次,加入混合染液(Annexin V-FITC/PI),避光条件下4 ℃染色20 min,上流式细胞仪进行分析。参数设置:激发波长488 nm,Annexin V发射光波波长为515 nm,PI发射光波波长大于560 nm。结果判定:在双变量流式细胞仪的散点图上,左下象限显示活细胞,为(FITC-/PI-);右上象限是非活细胞,即坏死细胞,为(FITC+/PI+);而右下象限为凋亡细胞,显现(FITC+/PI-)。
1.9 统计学方法

2 结果
2.1 不同组织和细胞中UBA2 mRNA和蛋白表达的比较
如图1,胃癌组织中UBA2 mRNA和蛋白的表达显著高于癌旁正常组织[mRNA水平:(2.55±1.34)vs.(0.93±0.2);蛋白水平:(1.58±0.14)vs.(1.12±0.12),均P<0.05];胃癌细胞AGS中UBA2 mRNA和蛋白均显著高于正常胃黏膜上皮细胞[mRNA水平:(0.68±0.12)vs.(0.29±0.08);蛋白水平:(0.82±0.11)vs.(0.35±0.08),均P<0.05]。
2.2 UBA2 mRNA表达与胃癌患者临床病理特征的关系
不同年龄、性别的胃癌患者中UBA2 mRNA表达无显著差异(P>0.05);肿瘤小、浸润浅、无淋巴结转移及低TMN分期的胃癌患者中UBA2 mRNA表达分别显著低于肿瘤大、浸润深、有淋巴结转移及高TMN分期的患者(均P<0.05),见表2。
2.3 过表达或低表达UBA2对AGS细胞中UBA2 mRNA表达的影响
与对照组相比,UBA2 mimic组细胞中UBA2 mRNA水平显著上调[(1.16±0.15)vs.(0.65±0.09),P<0.05],siRNA UBA2组细胞中UBA2 mRNA水平显著下调[(0.23±0.07)vs.(1.16±0.15),P<0.05],如图2。

图1不同组织和细胞中UBA2 mRNA和蛋白表达的比较 A:组织样本中UBA2 mRNA的表达;B:细胞中UBA2 mRNA的表达;C:不同组织和细胞中UBA2蛋白的表达。与正常组织或细胞相比,*P<0.05

表2 UBA2 mRNA表达与胃癌患者临床病理特征的关系
2.4 过表达或低表达UBA2对AGS细胞增殖的影响
如图3,生长曲线显示,与对照组相比,转染48 h和72 h时,UBA2 mimic组AGS细胞增殖能力明显上调(P<0.05),siRNA UBA2组细胞增殖能力明显下调(P<0.05),且作用效果具有时间依赖性,具体吸光值见表3。
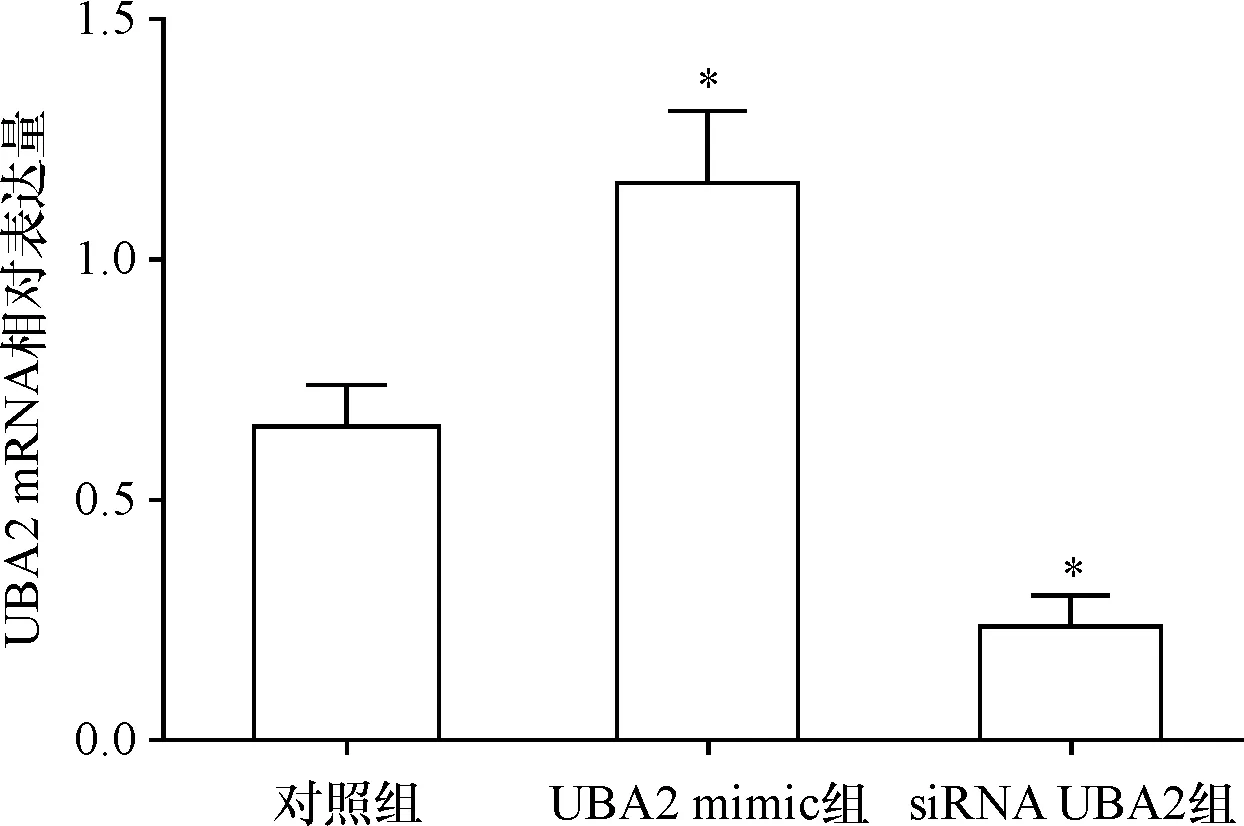
图2过表达或低表达UBA2对AGS细胞中UBA2 mRNA表达的影响 与对照组相比,*P<0.05

图3过表达或低表达UBA2对AGS细胞增殖的影响 与空白对照组相比,*P<0.05
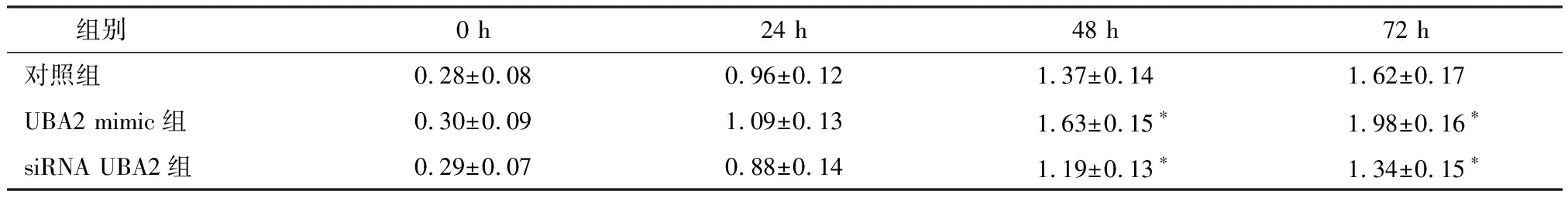
表3 培养24 h、48 h及72 h时AGS细胞的吸光值 (570 nm)
注:*与对照组相比,P<0.05
2.5 过表达或低表达UBA2对AGS细胞凋亡的影响
如图4,对照组细胞凋亡率为(8.36±1.52)%,UBA2 mimic组AGS细胞凋亡率为(3.67±0.84)%,显著低于对照组(P<0.05);siRNA UBA2组细胞凋亡率为(21.81±3.69)%,显著高于对照组(P<0.05)。

图4过表达或低表达UBA2对AGS细胞凋亡的影响
3 讨论
早期胃癌发病隐匿,临床表征不明显,许多患者确诊时病情已进入中晚期,不易控制;此外,胃癌在手术切除后极易复发、转移,难以预后,严重威胁人类的健康,因此,学者们都致力于寻找胃癌的分子靶点,为其治疗带来新的研究方向[9-10]。SUMO通过与靶蛋白共价结合,而起到调节靶蛋白功能的作用,研究发现许多癌基因和抑癌基因均为SUMO靶蛋白,如p53、双微基因2(MDm2)、早幼粒细胞性白血病基因PML等,这些促癌基因的激活或抑癌基因功能的抑制将可能引发肿瘤[11-13]。UBA2在SUMO活化过程中有重要作用,需要UBA2提供SUMO活性位点的半胱氨酸残基并形成巯酯键,以结合靶蛋白,完成SUMO的活化。大量研究表明,UBA2参与肿瘤的发生发展,参与肿瘤细胞增殖、凋亡、侵袭和迁移等生理过程[14]。Liu X等[15]研究显示,UBA2在小细胞肺癌细胞H446的增殖、转移和化疗敏感性中有重要作用,可作为小细胞肺癌潜在的生物标志物和治疗靶点。He P等[16]研究发现,UBA2在结直肠癌组织中表达水平显著升高,且其表达水平与肿瘤分期密切相关。本研究发现,UBA2 mRNA水平在胃癌组织和细胞中均呈高表达,与Hu XY等[17]研究一致。为进一步明确UBA2在胃癌中的临床意义,本研究通过分析UBA2 mRNA水平与胃癌患者临床病理特征的关系,发现肿瘤大、浸润深、有淋巴结转移及高TMN分期的胃癌患者UBA2 mRNA水平显著升高,提示UBA2与胃癌的发生发展密切相关。
近年来,多项研究表明敲除UBA2可能导致脑胶质瘤细胞、结肠癌细胞、肝癌细胞的增殖、运动能力的下降。Liang J等[18]研究发现,敲除UBA2可抑制脑胶质瘤细胞U87和U251的侵袭和迁移能力。Cheng H等[19]研究显示,UBA2在结肠癌中有重要作用,其下调可抑制结肠癌细胞的增殖,促进细胞周期的停滞和凋亡。袁征等[20]研究显示,低表达UBA2可抑制肝癌细胞HepG2的增殖、侵袭能力,可能与TGF-β2、VEGF等信号通路有关。本研究通过转染UBA2过表达载体和siRNA表达载体,观察差异表达UBA2对胃癌细胞AGS增殖和凋亡的影响。转染过表达载体UBA2 mimic和低表达载体siRNA UBA2后,AGS细胞中UBA2 mRNA的表达出现相应的升高和降低,表明转染成功。细胞增殖实验发现UBA2水平与胃癌细胞的增殖能力有关,过表达UBA2可明显促进AGS细胞的增殖,而低表达UBA2会抑制AGS的增殖。细胞凋亡实验发现UBA2水平与胃癌细胞的凋亡有关,过表达UBA2可明显抑制AGS细胞的凋亡,而低表达UBA2会促进AGS的凋亡。推测胃癌细胞中UBA2可能主要参与增殖、凋亡相关蛋白的SUMO化修饰,进而影响胃癌细胞的增殖和凋亡。
综上所述,UBA2在胃癌组织和细胞中高表达,与胃癌患者肿瘤大小、浸润深度、淋巴结转移情况及TMN分期等临床特征密切相关;同时,UBA2还可促进胃癌细胞的增殖,并抑制其凋亡。后续实验我们将深入探究UBA2激活SUMO在胃癌细胞中的具体分子途径,为胃癌发病机制的研究及胃癌的临床治疗提供科学参考。

