棘托竹荪水溶性多糖理化性质、单糖组成和固体形貌研究
张全才 李鸥叶 施晓丹 黄延盛 殷军艺 张 爽 聂少平*
(1无限极(中国)有限公司 辽宁营口 115000
2南昌大学 食品科学与技术国家重点实验室 南昌 330047)
竹荪(Dictyophora indusiata)又名竹笙、竹参等,属于鬼笔科、竹荪属,是一类生长在含有大量枯竹残体和腐殖质的竹林里的腐生性真菌,在我国主要分布在四川、云南、福建等地。竹荪营养丰富,味道鲜美,素有“山珍之花”、“真菌皇后”等美称,我国是最早食用竹荪、最早对竹荪进行人工驯化栽培的国家[1-2]。竹荪还是珍贵的药用菌,具有很高的药用价值[3]。富含多糖、蛋白质、黄酮、多酚类等成分,具有抗炎[4]、抗肿瘤[5-6]、抗氧化[7-8]、抑菌[9]等多种功效,是一类在食品、保健品和生物医药领域具有广阔应用前景的真菌。
近年来,越来越多的真菌多糖应用于治疗肿瘤、免疫缺陷病和糖尿病等疾病,竹荪多糖相关研究早在1980年便有报道。Ukai等[10-11]从竹荪中获得一种长裙竹荪子实体多糖,为线性(1→3)-α-D-甘露聚糖,相对分子质量为620 ku(以0.1 mol/L NaCl为流动相)或550 ku(以2 mol/L NaOH为流动相)。另外,该研究团队还分离鉴定出另一种结构为带有(1→6)分支的(1→3)-β-D-葡聚糖(T-3-G和T-5-N)的长裙竹荪多糖,其中T-3-G的重均分子质量约为5.1×105u[12-13]。国内研究人员Wang等[14]从竹荪中分离纯化得到一种以β-(1→3)-D-葡聚糖为主链,带有部分 β-(1→6)葡聚糖支链的竹荪多糖(PD3)。而 Hua等[15-16]经Sephadex G75和DEAE-Sepharose FF柱层析纯化得到的长裙竹荪多糖Dip-I和Dip-II则含有果糖、木糖、半乳糖、葡萄糖和甘露糖等。Liao等[17]经阴离子交换柱层析DEAE-52和葡聚糖凝胶柱层析G200中得到的竹荪多糖DP1由半乳糖(14.1%)、葡萄糖(56.2%)、甘露糖(29.7%)组成。
上述研究主要以长裙竹荪为研究对象,采用柱纯化的方法来获得高纯度的竹荪多糖。竹荪多糖的单糖组成、相对分子质量等理化性质因制备方法或测定方法的不同而有很大差别。针对棘托竹荪多糖分离纯化和结构特征鲜有研究报道。本文以棘托竹荪为研究对象,采用更为简单的乙醇分级沉淀方法对竹荪提取物进行分级纯化,以获得纯度较高的竹荪多糖组分,并测定其基本理化性质、相对分子质量、单糖组成和固体形貌等,为后续深入的结构、构象特征分析以及功能活性研究奠定良好基础。
1 材料与方法
1.1 材料与试剂
棘托竹荪提取物,由本单位实验室自制。
8种单糖标准品(岩藻糖、鼠李糖、阿拉伯糖、半乳糖、葡萄糖、木糖、甘露糖、果糖)和2种糖醛酸标准品(半乳糖醛酸、葡萄糖醛酸),美国Sigma公司;不同分子质量的葡聚糖系列标准品(Dextran T-10、Dextran T-40、Dextran T-50、Dextran T-70、Dextran T-500、蓝色葡聚糖),美国 Pharmacia公司;考马斯亮蓝G-250(进口分装),德国Fluka公司;牛血清蛋白,美国Amersco公司;咔唑,阿拉丁试剂公司;透析袋(截留分子质量3 500 u),上海国药集团化学试剂有限公司;95%食用酒精、无水乙醇、浓硫酸、苯酚、叠氮钠等,均为国产分析纯。
1.2 仪器与设备
Aligent1260高效液相色谱仪,美国安捷伦公司;TU-1900双光束紫外-可见分光光度计,北京普析通用仪器有限责任公司;Dionex ICS-5000离子交换色谱仪,美国戴安公司;Nicolet 5700傅里叶红外光谱仪,美国Thermo公司;JSM-6701F型扫描电子显微镜,日本电子光学公司;N-1100型旋转蒸发仪,上海爱朗仪器有限公司;冷冻离心机,美国Thermo公司;AL 104电子天平,梅特勒-托利多仪器(上海)有限公司等。
1.3 方法
1.3.1 棘托竹荪提取物中高纯度多糖的制备 采用乙醇分级沉淀的方法制备高纯度竹荪多糖(如图1所示)。称取50 g竹荪提取物,溶于500 mL蒸馏水,然后加入乙醇(95%,V/V)至体系中乙醇体积分数为20%,置于冰盒中醇沉8 h后再离心分离(10 000 r/min,15 min,4 ℃),弃去沉淀;上清液继续加入乙醇至其体积分数达到40%,醇沉12 h左右,离心分别得到沉淀和上清液。沉淀用无水乙醇洗涤3~4遍后再加入100 mL蒸馏水复溶,然后置于冰盒中用蒸馏水透析3 d,每2~3 h换水一次。向离心上清液中继续加入乙醇,采用同样的方法依次获得60%(V/V)乙醇沉淀和80%(V/V)沉淀进行透析。
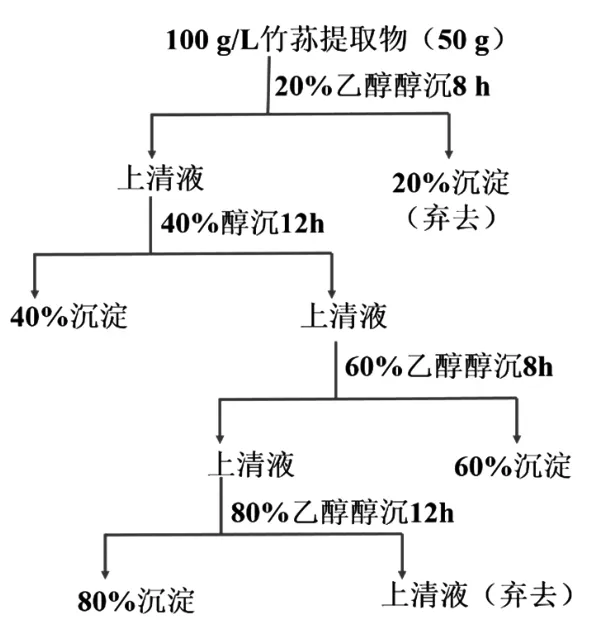
图1 竹荪提取物中乙醇分级沉淀多糖流程图Fig.1 Flow chart of gradual ethanol precipitation of polysaccharides from water extract of Dictyophoraechino-volvata Zane
将上述所得3种透析液分别浓缩至50~60 mL,加入4倍体积的无水乙醇静置8~12 h,然后进行离心(10 000 r/min,15 min,4 ℃),所得沉淀用无水乙醇洗涤3~4遍,真空干燥(60℃,2 h),依次得到3个棘托竹荪多糖组分(DEP-4P、DEP-6P、DEP-8P)。
1.3.2 棘托竹荪多糖的理化性质分析
1.3.2.1 中性糖、蛋白质和糖醛酸含量测定 以葡萄糖为标准品,采用苯酚-硫酸法测定中性糖含量[18]。以牛血清蛋白为标准品,采用考马斯亮蓝法测定竹荪多糖的蛋白质含量[19]。以葡萄糖醛酸为标准品,采用改良的硫酸-咔唑法测定竹荪多糖中糖醛酸含量[20]。
1.3.2.2 纯度及相对分子质量测定 采用高效凝胶渗透色谱对棘托竹荪多糖的纯度进行鉴定[21]。采用的色谱条件为保护柱:UltrahydrogelTMGuard Column(6 mm×40 mm,10 μm);分离柱:UltrahydrogelTMLinearColumn(7.8 mm ×300 mm,10 μm);柱温:35.0℃;流动相:超纯水(含0.02%NaN3);流速:0.6 mL/min;进样量:20 μL。示差检测器温度为35.0℃;紫外检测器检测波长为280 nm。用流动相配制1 mg/mL系列葡聚糖标准品和竹荪多糖样品,上机检测。
1.3.2.3 单糖组成分析 参考文献报道的方法[22-23],首先用2 mol/L硫酸在100℃油浴条件下将竹荪多糖水解成单糖,然后采用离子色谱仪对混合单糖标准品和竹荪多糖的单糖组成进行检测分析。
1.3.2.4 红外光谱扫描 称取干燥的多糖样品1 mg,采用KBr压片法,用Nicolet 5700傅里叶红外光谱仪在4 000~400 cm-1范围内进行红外光谱扫描。
1.3.2.5 电镜观察 配制0.5 mg/mL竹荪多糖溶液,冷冻干燥然后对干燥的多糖样品进行喷金处理,置于扫描电镜下观察。
2 结果与分析
2.1 棘托竹荪多糖得率和化学成分
经乙醇分级得到3个棘托竹荪多糖样品,通过比色法测定棘托竹荪提取物及多糖的中性糖、蛋白质和糖醛酸含量等结果如表1所示。由表可以看出,随着分级过程中,乙醇体积分数的逐渐增加,竹荪多糖的糖含量降低。3个竹荪多糖组分均未检测出蛋白质和糖醛酸。

表1 棘托竹荪提取物乙醇分级沉淀所得各多糖组分的得率及化学组成Table 1 Yields,chemical components of polysaccharides using gradual ethanol precipitation from water extract of Dictyophoraechino-volvata Zane
2.2 纯度及相对分子质量

图2 棘托竹荪提取物和乙醇分级沉淀所得多糖高效液相凝胶渗透色谱图Fig.2 High performance gel chromatograph of polysaccharides using gradual ethanol precipitation water extract from Dictyophora echino-volvata Zane
图2为棘托竹荪提取物和多糖(DEP-4P、DEP-6P、DEP-8P)的高效液相凝胶渗透色谱图。棘托竹荪提取物在14.2,15.1和17.9 min左右出现3个峰,表明竹荪提取物可能具有3个分子质量分布相对集中的组分。经过乙醇分级后,DEP-4P、DEP-6P和DEP-8P相对分子质量分布则相对集中,并且都是单一对称的色谱峰。由保留时间计算分配系数Kav与葡聚糖标准品的LogMw的关系建立标准曲线得:Kav=-0.2905 LogMw+1.6409,R2=0.9937,DEP-4P、DEP-6P、DEP-8P 的出峰时间逐渐向后推移,(依次为 15.015,15.893,16.806 min)。DEP-4P、DEP-6P、DEP-8P 的相对分子质量约为 2.1×104,6.5×103,1.9×103u,明显小于文献报道的长裙竹荪多糖的重均分子质量(510,550或600 ku)[11-13]。这可能与竹荪的来源和提取纯化的方法有关。
2.3 单糖组成分析
3个竹荪多糖的单糖组成结果如表2所示,竹荪多糖DEP-4P和DEP-6P主要由葡萄糖组成,DEP-8P中还有极少量的甘露糖。3个组分均未检测出糖醛酸。该结果与Ukai[10-13]和Wang等[14]报道的单糖组成一致,而与Hua等[15-16]报道的长裙竹荪多糖Dip-I和Dip-II(果糖、木糖、半乳糖、葡萄糖和甘露糖)和Liao等[17]报道的竹荪多糖DP1(半乳糖、葡萄糖、甘露糖)有所差别。
2.4 棘托竹荪多糖红外光谱特征
棘托竹荪提取物及多糖的红外光谱见图3。DEP-4P、DEP-6P、DEP-8P与竹荪提取物具有类似的特征吸收峰。对比参考文献[24-25],对棘托竹荪多糖的红外图谱分析如下:在3 380 cm-1处的吸收峰为羟基吸收峰,2 930 cm-1和1 640 cm-1处的微弱吸收峰分别为-CH的伸缩振动和氢键振动吸收峰,1 411 cm-1和1 367 cm-1处的吸收峰为-CH变角振动吸收峰。800~1 200cm-1被认为是多糖的特征吸收区域,其中1 023,1 081和1 238 cm-1为吡喃环吸收峰,930,850,761和709cm-1处的吸收峰,初步表明竹荪多糖的异头碳构型为α-型[26-27]。

表2 棘托竹荪多糖的单糖组成结果Table 2 Monosaccharide composition of polysaccharides from Dictyophora echino-volvata Zane

图3 棘托竹荪提取物及乙醇沉淀所得多糖的红外图谱Fig.3 FT-IR spectra of polysaccharides using gradual ethanol precipitation and water extract from Dictyophora echino-volvata Zane
2.5 棘托竹荪多糖电镜观察
图4为不同放大倍数下(1 000×和2 000×)3个竹荪多糖组分扫描电镜图,由上图可以看出,DEP-4P和DEP-6P在电镜下观察到的形貌特征以薄片状为主,DEP-8P则呈现丝状和片状交杂的结构。

图4 棘托竹荪多糖扫描电镜图Fig.4 SEM images of polysaccharides from Dictyophora echino-volvata Zane
3 结论
本研究采用乙醇分级醇沉的方法从棘托竹荪提取物中分离纯化得到3个棘托竹荪多糖组分(分别为 DEP-4P、DEP-6P和DEP-8P),由高效液相色谱表征(单一对称的峰)和糖含量测定结果(~90%)可以判定3个组分均为分布较为均一的纯多糖。随着乙醇体积分数的增加,棘托竹荪多糖的相对分子质量逐渐减少,中性糖含量逐渐降低。单糖组成分析表明DEP-4P和DEP-6P由葡萄糖组成,而DEP-8P由大部分的葡萄糖和极少量的甘露糖组成。3个竹荪多糖组分具有类似的红外光谱特征,分析结果表明竹荪多糖具有α构型吡喃糖的特征吸收峰。结合单糖组成的结果推断棘托竹荪多糖为一种α-葡聚糖。这种结构的竹荪多糖与文献报道的长裙竹荪多糖(α-mannan和β-1,3-glucan)不一致,而该类多糖在其它菌菇类多糖(如双孢菇多糖和平菇多糖)中有所报道[28-30]。后续可以采用甲基化方法和核磁技术对竹荪多糖的结构进行深入解析。扫描电镜比较3种棘托竹荪多糖的分子形貌特征发现DEP-4P、DEP-6P主要表现为片状结构,DEP-8P则以丝状结构为主。

