紫草素对大鼠重症急性胰腺炎并发急性肺损伤的抑制作用
王泽普,彭彦辉,脱红芳,胡湧渤
(河北省人民医院 1.肝胆外科 2.医务处,河北 石家庄 050057)
急性胰腺炎(acute pancreatitis,AP)是临床常见的急腹症,严重者可发生全身炎症反应综合征,发展为重症急性胰腺炎(severe acute pancreatitis,SAP),病情凶险,病程复杂。急性肺损伤(acute lung injury,ALI)是SAP的严重并发症之一。超过50%的SAP患者会出现严重的肺部并发症[1]。SAP早期死亡患者中,60%死于呼吸衰竭[2]。IL-6、TNF-α是参与SAP并发ALI时的重要炎症因子,可以预测ALI的进展[3]。很多研究已表明,PI3K/Akt、NF-κB是与ALI发展相关的下游炎性信号通路,下调PI3K/Akt和NF-κB的活化可降低牛磺胆酸钠诱导的ALI大鼠的促炎细胞因子水平[4]。亦有研究发现使用PI3K/Akt抑制剂可降低败血症模型小鼠的血清炎性因子水平,增加小鼠的生存率[5-6]。
紫草素是存在于植物紫草根中的一种萘醌类化合物。近年来,多项研究[7-8]表明紫草素对关节炎、神经系统疾病、心血管疾病及败血症等炎症反应有很好的治疗作用。其机制可能与下调白三烯B4的合成、抑制肥大细胞去颗粒作用、抑制中性粒细胞呼吸爆发,破坏磷脂酰肌醇信号通路和下调NF-κB活化等有关[9]。Bai等[10-11]证实,紫草素可以抑制脂多糖诱导的肺损伤小鼠肺组织NF-κB活化,减少TNF-α的产生。也有研究[12]发现紫草素可抑制PI3K和Akt的磷酸化。那么,紫草素对SAP及其并发的ALI是否有类似治疗作用及其机制尚未明确。本研究旨在明确紫草素在SAP及其并发的ALI中的作用,并探讨其与PI3K/Akt、NF-κB之间的关系。
1 材料与方法
1.1 实验动物与材料
健康雄性清洁级S D 大鼠24 只,体质量200~250 g,购于河北医科大学动物中心,紫草素、TNF-α、IL-6 ELISA试剂盒(上海蓝基生物科技有限公司),兔抗大鼠PI3K、p-PI3K、NF-κB多克隆抗体(美国Bioworld Technology公司),牛磺胆酸钠(Sigma公司)。
1.2 实验方法
1.2.1 动物分组与处理 将大鼠随机分为对照组,急性胰腺炎组(模型组),紫草素治疗组(治疗组),每组8 只。各组SD 大鼠适应性喂养1 周。术前12 h禁食,自由饮水。治疗组于造模前2 h 给予紫草素(50 mg/kg,溶于0.25 mL 二甲基亚砜)灌胃,模型组、对照组于同时间给予等量二甲基亚砜灌胃。模型组、治疗组经3% 戊巴比妥钠腹腔内注射(0.2 mL/100 g)麻醉,腹正中切口,于主胰管开口附近十二指肠系膜对缘使用1 mL 注射器针头刺穿肠壁,钝头1 mL 注射器针头经十二指肠乳头插入胰胆管,无损伤动脉夹固定,于肝门处用无损伤动脉夹夹闭胰胆管,经针头注入4% 牛磺胆酸钠(0.1 mL/100 g,注射速度0.2 mL/min),5 min后松开动脉夹,拔出针头,缝合十二指肠壁,关闭腹腔,背部皮下注射2 mL 生理盐水,补充手术损失。对照组经同种方式麻醉进腹后仅显露、牵拉十二指肠即关腹。术后各组大鼠禁食不禁水,于造模后6 h 取血、处死取材。
1.2.2 取材 剖开腹腔,腹主动脉取血,静置3 h 后于离心机3000 r/min 离心15 min,用于TNF-α、IL-6 水平检测。取大鼠胰腺组织与肺组织,其中右下肺组织及胰腺脾侧叶经10% 中性福尔马林固定,石蜡包埋,HE 染色,制备肺组织、胰腺组织病理切片用于形态学观察;其余肺组织用于肺组织湿干与PI3K、p-PI3K 和NF-κB 表达检测。
1.2.3 血清TNF-α、IL-6 浓度测定按照TNF-α、IL-6 ELISA 试剂盒步骤操作测定血清TNF-α、IL-6 水平。
1.2.4 肺组织及胰腺组织损伤评分 胰腺组织损伤评分根据Schmidt's 方法进行评分(表1)。肺损伤显微镜下严重程度分级:根据炎性细胞浸润、肺间质及肺泡间隙、间质水肿和广泛的肺泡壁增厚程度进行评分,每项5 个等级0、1、2、3、4。
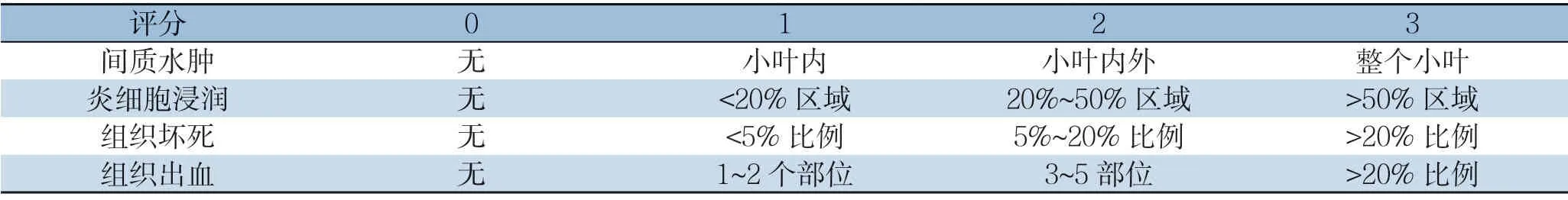
表1 胰腺损伤Schimdt's 评分标准Table 1 Schimdt's scoring criteria for pancreatic injury
1.2.5 肺组织湿干比测定 取左上肺组织用电子称称其湿重,置于80 ℃烘烤箱24 h,称其干重,计算肺组织的湿干重比。
1.2.6 肺组织PI3K、p-PI3K 和NF-κB 的表达 用Western blot 法检测肺组织中PI3K、p-PI3K 和NF-κB 蛋白的表达水平。
1.3 统计学处理
所有数据处理均应用SPSS 13.0软件,数据结果以均数±标准差(±s)表示,先行正态性检验及方差齐性检验,多个样本间的比较采用完全随机设计单因素方差分析,P<0.05为差异有统计学意义。
2 结 果
2.1 组织病理学检测结果
胰腺组织病理学检测结果:对照组大鼠胰腺组织无明显水肿、出血、炎细胞浸润及坏死;模型组大鼠胰腺组织可见胰腺腺泡水肿,伴有显著的小叶间隙增宽及片状坏死,实质及间质内可见明显炎细胞浸润;治疗组胰腺组织较模型组胰腺组织内可见炎性细胞浸润减少,腺泡水肿程度减轻,炎症程度减轻,未见明显坏死灶。与对照组比较,模型组与治疗组胰腺组织病理评分均有统计学差异(均P<0.05)。肺组织病理学检测结果:对照组肺组织镜下无明显形态学变化;模型组镜下肺组织可见明显的形态学异常,包括炎性细胞浸润、肺间质及肺泡间隙、间质水肿和广泛的肺泡壁增厚;治疗组镜下肺组织损伤严重程度较模型组减轻,炎细胞浸润程度较模型组明显减轻。与对照组比较,模型组与治疗组肺组织病理评分均具有统计学差异(均P<0.05)(图1)(表2)。
2.2 血清TNF-α、IL-6 浓度检测结果
与对照组比较,模型组与治疗组血清TNF-α、IL-6 浓度均升高,差异有统计学意义(均P <0.05);与模型组相比,治疗组血清TNF-α、IL-6浓度均明显降低,差异有统计学意义(P<0.05)(表3)。
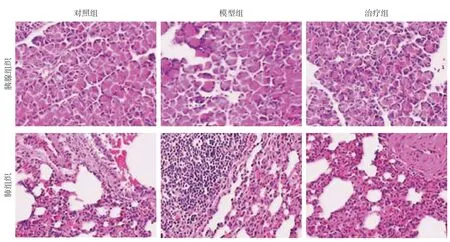
图1 HE 染色结果(×100)Figure 1 Results of HE staining (×100)
表2 各组胰腺与肺组织病理评分比较(±s,n=8)Table 2 Comparison of the pathological scores for pancreatic and lung tissue among groups (±s,n=8)
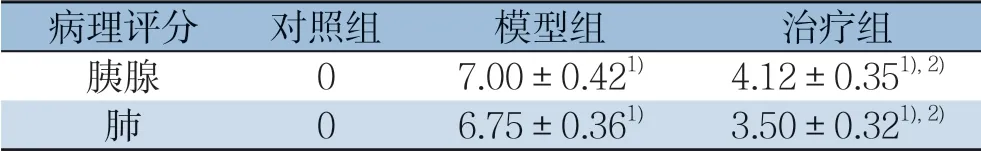
表2 各组胰腺与肺组织病理评分比较(±s,n=8)Table 2 Comparison of the pathological scores for pancreatic and lung tissue among groups (±s,n=8)
注:1)与对照组比较,P<0.05;2)与模型组比较,P<0.05Note:1) P<0.05 vs.control group;2) P<0.05 vs.model group
病理评分 对照组 模型组 治疗组胰腺 07.00±0.421) 4.12±0.351),2)肺06.75±0.361) 3.50±0.321),2)
表3 各组血清TNF-α、IL-6 水平比较(±s,n=8)Table 3 Comparison of the serum levels of TNF-α and IL-6 among groups (±s,n=8)
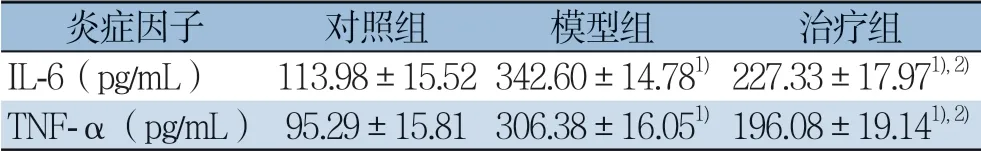
表3 各组血清TNF-α、IL-6 水平比较(±s,n=8)Table 3 Comparison of the serum levels of TNF-α and IL-6 among groups (±s,n=8)
注:1)与对照组比较,P<0.05;2)与模型组比较,P<0.05Note:1) P<0.05 vs.control group;2) P<0.05 vs.model group
炎症因子 对照组 模型组 治疗组IL-6(pg/mL) 113.98±15.52342.60±14.781) 227.33±17.971),2)TNF-α(pg/mL) 95.29±15.81306.38±16.051) 196.08±19.141),2)
2.3 肺组织湿干比检测结果
对照组,模型组、治疗组肺组织湿干比分别为:4.90±0.21、6.88±0.16、5.96±0.13。与对照组比较,模型组、治疗组肺组织湿干比均明显升高,差异有统计学意义(均P<0.05);治疗组肺组织湿干比与模型组比较明显下降,差异有统计学差异(P<0.05)。
2.4 肺组织p-PI3K/PI3K、NF-κB 表达
与对照组比较,模型组、治疗组p-PI3K/PI3K比值及NF-κB表达均明显升高,差异有统计学意义(均P<0.05);与模型组相比,治疗组p-PI3K/PI3K比值及NF-κB表达明显降低,差异有统计学意义(均P<0.05)(图2)。
3 讨 论
SAP早期胰外器官损伤中,ALI最为突出。ALI是全身炎症反应的结果,但SAP引起ALI的具体机制并未完全阐明。其可能的病理生理机制包括各种体内平衡的紊乱、炎症反应、肺血管内皮和上皮屏障功能障碍等[13]。在ALI发病早期,炎症细胞向肺部聚集、浸润,并释放大量炎性介质(如白介素类、TNF-α、弹性蛋白酶及氧自由基等),这些炎症细胞及炎症因子在某种炎症通路的串联下相互作用;如能在早期实施干预,调控有关信号通路的活性变化,将对SAP并发ALI的治疗起到重要作用[14]。
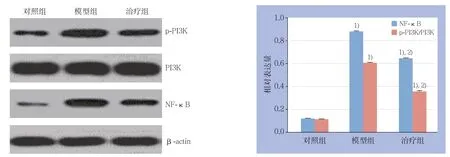
图2 各组Western blot 检测结果 Figure 2 Results of Western blot of each group
TNF-α是AP发病后较早期产生的细胞因子,通过诱生炎症介质、激活中性粒细胞产生间接毒性作用[15]。IL-6是在急性应激状态下由单核细胞、巨噬细胞、上皮细胞、平滑肌细胞释放的一种炎性因子,在SAP患者中,IL-6的表达与ALI的严重程度相关,是预测疾病预后的良好指标[16]。在该研究中,模型组血清TNF-α、IL-6水平明显高于对照组,而紫草素治疗组血清TNF-α、IL-6水平较模型组降低;治疗组肺组织湿干比较模型组低,治疗组肺组织损伤评分及胰腺组织损伤评分均较模型组轻,说明紫草素可减轻SAP并发ALI的炎症反应。
PI3K是一种胞内磷脂酰肌醇激酶,可被多种因子激活,参与多条信号转导途径,并起到广泛的生物学效应[17-18]。NF-κB信号通路在炎症、代谢、肺血管屏障功能障碍等炎性反应中发挥着重要的“炎症转换”作用[19]。活化的NF-κB在SAP的发生中起着重要的作用,它参与对细胞因子、黏附分子、炎性因子和免疫的调节。有研究[20-21]已证实,PI3K/Akt和NF-κB炎症信号通路的活化是ALI发展的潜在分子机制。也有研究[22]发现对敲除PI3K基因的小鼠能减轻自身所发生的炎症反应。本研究中,模型组大鼠肺组织p-PI3K、NF-κB表达升高,证实了PI3K的磷酸化及NF-κB信号通路的活化在SAP并发的ALI中发挥重要的作用。紫草素治疗组大鼠肺组织中PI3K的磷酸化及NF-κB的表达明显低于模型组,说明紫草素对SAP的ALI有一定预防作用,并且此作用很可能与抑制PI3K的磷酸化及NF-κB的活化有关。
本实验中,紫草素对牛磺胆酸钠诱导的SAP并发肺损伤大鼠进行预处理能够明显抑制胰腺组织与肺组织的损伤,能显著降低SAP大鼠血清TNF-α及IL-6水平,下调p-PI3K及NF-κB在肺组织中的表达,提示在SAP并发ALI过程中,炎性因子如TNF-α、IL-6大量释放,PI3K/Akt和NF-κB炎症信号通路被激活;而紫草素治疗可降低血清炎性因子TNF-α、IL-6的水平,下调PI3K的磷酸化及NF-κB在肺组织中的表达。因此,紫草素对大鼠的SAP及其并发的ALI均有抑制作用,其机制可能与减少炎症因子的释放以及降低肺组织PI3KAkt-NF-κB通路活化有关。

