腹腔镜与开腹胰十二指肠切除治疗十二指肠乳头腺癌疗效比较
程发辉,吴浩然,蒋波,段小辉,沈贤波,魏荣光,曾颖慧,毛先海
(湖南省人民医院/湖南师范大学附属第一医院 肝胆外科,湖南 长沙 410005)
十二指肠乳头腺癌(carcinoma of the papilla of Vater,CPV)在壶腹部周围癌中的发病率占第二位,仅次于胰头部恶性肿瘤。目前手术切除仍是治疗十二指肠乳头腺癌最有效的方法,手术切除方式有腹腔镜胰十二指肠切除(LPD)与开腹胰十二指肠切除(OPD)[1-3]。1994年Gagner等[4]实施了全球首列LPD,但因为手术时间长,术后并发症多,在当时被认为LPD无优势。随着腔镜技术的进步和医疗器械的发展,腹腔镜使外科进入“微创时代”[5-6],但在以往的研究中主要集中在认为LPD具有创伤性小,恢复快等“微创优势”,未平行对比十二指肠乳头腺癌患者生存率以及相关生存质量研究,因此本研究的目的是回顾和比较接受LPD与OPD治疗的十二指肠乳头腺癌患者的近期及远期疗效。
1 资料与方法
1.1 资料来源
采用回顾性临床病例对照研究方法。收集2012年1月—2017年12月湖南省人民医院由肝胆外科同一术者行胰十二指肠切除(PD)患者的临床资料,总共256例,术后由两名病理科医生明确诊断为十二指肠乳头腺癌共89例,该研究通过我院伦理委员会审批,患者及家属均签署知情同意书。
1.2 纳入标准和排除标准
纳入标准:⑴ 一般情况良好,无心、脑、肾等重要脏器严重器质性病变,PS评分0~1分;⑵ 术前影像学证实为壶腹部肿瘤而行胰十二指肠切除术,术后病理诊断为十二指肠乳头腺癌患者;⑶ 肿瘤无远处转移证据;⑷ 患者及其委托代理人知情同意,签署知情同意书。排除标准:⑴ 有严重伴发疾病不能耐受手术;⑵ 术前检查及术中探查不能行根治性切除而仅行姑息性手术;⑶ 肿瘤远处转移者;⑷ 术后病检结果非十二指肠乳头腺癌患者。
1.3 观察指标
⑴ 术中情况:手术时间、术中出血量、术中是否输血情况。⑵ 术后情况:术后观察指标包括术后胰瘘、胆汁漏、胃排空延迟、出血、腹腔感染/脓肿、肺部感染的发生率、再次手术率、以及Clavien分级≥III级并发症和平均住院时间。⑶ 术后病理结果:病理类型、手术切缘(R0切除率)术中切除淋巴结数、阳性淋巴结数、肿瘤直径、分化程度、有无血管侵润、十二指肠侵犯等情况。⑷ 术后总生存时间。术后并发症诊断标准:按照国际统一的诊断标准[7-11]诊断术后并发症,肿瘤TNM分期根据美国癌症联合会(AJCC)第7版TNM分期系统。
1.4 随访情况
采用门诊和电话方式进行术后随访,每3个月随访1次,包括肿瘤标志物、CT或MRI检查,必要时行PET-CT检查,了解患者复发及生存情况,随访时间截至2018年6月。
1.5 统计学处理
应用EpiData3.1软件进行数据采集与记录,应用SPSS 22.0统计软件进行分析,结果中的计量资料以均数±标准差(±s)表示,计数资料比较采用χ2检验,计量资料比较采用t检验,等级资料比较采用秩和检验,采用对数秩显着性检验Kaplan-Meier曲线分析生存率,P<0.05为差异有统计学意义。
2 结 果
2.1 患者一般资料
89 例十二指肠乳头腺癌患者中,50 例行OPD,39例行LPD39;男性58例,女性31例;年龄33~87岁,平均年龄60.7岁;OPD组与LPD组患者之间在性别、年龄、美国麻醉医学(ASA)评分、体质量指数(BMI)差异均无统计学意义(均P>0.05)(表1)。

表1 OPD 组与LPD 组患者一般资料Table 1 General information of patients in OPD group and LPD group
2.2 术中情况
两组手术时间差异无统计学意义(P>0.05),LPD组术中出血量明显少于OPD组(P=0.021),OPD组2例术中输血,LPD组无输血,但差异无统计学意义(P=0.502)(表2)。
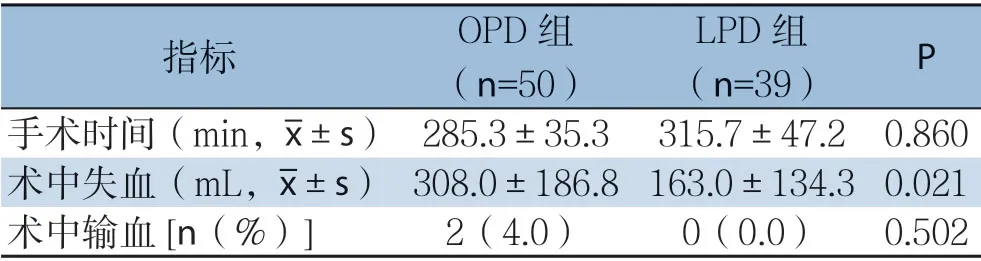
表2 OPD 组与LPD 组患者术中指标比较Table 2 Comparison of the intraoperative variables between OPD group and LPD group
2.3 术后情况
LPD 组较OPD 组术后住院时间明显缩短(P=0.043);两组术后胰瘘、胆汁漏、术后出血、胃排空延迟、腹腔感染/脓肿发生率及Clavien分级≥III 级并发症发生率差异均无统计学意义(均P >0.05);两组二次手术率也无明显差异(P=0.164)(表3)。两组住院30 d内死亡患者均为1例。

表3 OPD 组与LPD 组患者术后指标比较Table 3 Comparison of the postoperative variables between OPD group and LPD group
2.4 术后病理
两组患者术后肿瘤分化程度、肿瘤直径、血管侵润发生率、R0切除率、切除淋巴结数、TNM分期以及十二指肠侵犯等指标差异均无统计学意义(均P>0.05)(表4)。

表4 OPD 组与LPD 组患者术后病理结果比较Table 4 Comparison of the postoperative pathological results between OPD group and LPD group
2.5 术后随访
所有患者术后均获得随访,中位随访时间为23(6~36)个月,OPD组中位生存时间为31个月,LPD 组中位生存时间为36 个月。Kaplan-Meier生存曲线分析结果显示,OPD 与LPD 组术后1、3年总生存率无明显差异(85.2% vs.86.7%;43.9% vs.51.8%,均P>0.05)(图1A);1、3年无病生存率无明显差异(88.4% vs.89.2%;42.3% vs.44.8%,均P>0.05)(图1B)。

图1 患者术后生存曲线 Figure 1 Postoperative survival curves of the patients
3 讨 论
随着腔镜技术的发展,越来越多的中心开展LPD来治疗壶腹部周围肿瘤 ,其中包括十二指肠乳头腺癌。与开腹手术一样,腹腔镜手术治疗十二指肠乳头腺癌时不仅要关注近期疗效和并发症,同时也要注重肿瘤学及远期疗效。
目前绝大部分研究认为,LPD具有出血少、住院时间短等优势,然而其并发症的发生率和病死率与开放手术相比并无明显差异[12-14]。研究[13]表明LPD 病例中,并发症的发生率为48%、病死率为2%,最多见的并发症为胰瘘(15%)。Kendrick[13]指出,梅奥医学中心施行LPD联合血管切除重建,表明LPD具有出血少、切口并发症少、住院时间短的优势,表明LPD是安全、可行。然而法国一项临床随机对照试验研究比较了46例采用LPD和46例OPD手术方式的结果表明LPD术后因严重胰漏引起并发症率明显增高,认为LPD安全性有待商榷[15]。我们研究结果显示十二指肠乳头腺癌患者行LPD,术后胰漏并发症的发生率为20.5%,且主要以生化漏为主,两组之间无显著差别,与大部分研究结果相一致[12-14]。LPD术后出血率为15.3%,二次手术率为10.2%,4例均因术后出血行二次手术其中胃残端出血1例,吻合口出血3例,主要是因为早期吻合器钉仓选择及组织压榨时间过短所致,1例再次腹腔镜下探查胃残端缝合止血,3例腹腔镜下胃肠吻合口拆除止血后重新吻合,4例均痊愈出院,经过LPD自我质控体系后建议根据胃壁组织厚度来选择不同钉仓用于腔镜下离断胃和行胃空肠侧侧吻合,以减少术后出血的发生。两组住院30 d死亡患者均为1例,主要因为并发C级胰瘘后合并重症感染,C级胰瘘的预防重点在于早期生化漏、B级瘘的管理,需保持引流通畅,术区的局部积液需尽早穿刺置管引流,控制感染以防导致更严重并发症的发生,本组数据表明LPD治疗十二指肠乳头腺癌与OPD相比并未增加患者并发症发生率,因此是安全、可行的。
腹腔镜进行恶性肿瘤手术同样应遵循传统根治性切除手术原则,即彻底切除原发病灶及受浸润的周围组织器官、保证足够的切缘、清扫足够范围区域的淋巴结,以保证远期疗效。国外研究表明病理性质、手术切缘、术中切除淋巴结数以及阳性淋巴结率是影响PD预后的重要因素[16]。国内黄志强教授[17]亦指出,行胰十二指肠切除时R0与R1切除对术后生存期的影响有明显差异。有研究结果显示,开展LPD超过25例的临床中心,LPD获取的淋巴结平均为14~16枚,R0切缘超过89%,而OPD 手术平均获取淋巴结6~28 枚,R0切缘为 60%[15,18-19]。一项LPD和OPD的临床对照研究显示,两种术式在标本大小和R0切除率两方面无明显差异,而LPD取得的淋巴结较开腹手术更多[12]。研究[13]比较了2007—2010年65例LPD和129例OPD的资料,两者在肿瘤大小、切缘阴性率、获取淋巴结个数等均无明显差异。Asbun等[12]报道LPD与传统开腹PD淋巴结清扫数目分别为23.44枚和16.84枚(P<0.05),表明有经验中心完全可达到根治性切除要求。Kendrick等[14]报道了全腹腔镜下主要大静脉切除、重建的PD。Croome等[20]研究LPD联合主要血管切除、重建PD患者的资料,术后病理证实R0切除率更高、切除淋巴结数更多,病死率及重建血管通畅率方面无显著差异。在熟练掌握标准LPD和联合血管切除重建的OPD技术后,选择合适病例开展联合血管切除重建LPD不仅是安全的,甚至更具优势,邻近血管侵犯不是LPD 的绝对禁忌证。国内田锐等[21]研究结果表明,LPD和OPD两种术式R0切除率、术中切除淋巴结数、阳性淋巴结数方面差异无统计学意义。本研究结果显示。LPD与OPD肿瘤直径、淋巴结清扫数、R0切除率等差异并无统计学意义,表明LPD能够获取足够的淋巴结,达到R0切除,LPD同样遵循肿瘤根治性切除的原则,但限于回顾性研究的不足,需要前瞻性的随机对照研究进一步的证实。
Palanivelu等[22]报告恶性肿瘤行LPD术后5年生存率为32%,壶腹部腺癌、胰腺囊腺癌、胰头腺癌、胆总管腺癌的5年生存率分别为30.7%、33.3%、19.1%、50.0%,与开腹手术相当。但由于患者均为早期恶性肿瘤,其生存率优势和OPD无法进行统计学的比较。Croome等[23]包含108例LPD和214例OPD一项为期5年的对照研究中,局部复发率分别为15%和27%,两组患者总生存率比较,差异无统计学意义(P>0.05),但无疾病进展生存率LPD组却优于OPD组(P<0.05)。认为LPD组的肿瘤无进展生存期更长,可能与LPD的快速康复,术后更早接受放化疗等综合辅助治疗相关。研究[24]通过倾向评分的加权分析法,比较40例LPD和25例OPD的资料,中位总生存期为35.5个月和29.6个月。LPD和OPD组的1、3、年总生存率分别为80.5%、49.2%、39.7%和77.8%、46.4%、30%(P=0.41、0.42、0.25),此项研究是首次对LPD的长期肿瘤学安全报告,认为腺癌患者术后总生存率LPD是不逊于OPD的,本研究结果表明十二指肠乳头腺癌LPD与OPD的1、3年生存率无显著差别,采用LPD治疗十二指肠乳头腺癌具有良好的远期疗效。
腹腔镜具有良好的暴露和放大作用以及腹腔内正压作用,可以减少术中渗血,使术中出血量少于开腹。腹腔镜能提供立体视野,高清晰的分辨率,镜头视野直视下操作,减少了误伤和出血,在血管解剖方面更加精细准确,淋巴清扫更加彻底并且有助于“enbloc”切除[25-26]。结合术前影像CTA的血管重建判断无血管侵犯,在十二指肠乳头腺癌患者中术后R0切除率较高,本研究结果显示两组R0切除率无明显差异,提示LPD可能有良好的R0切除率。随着器械设备的技术进步腹腔镜目前已由2D镜头到3D立体化镜头,3D镜头可以改善术者视觉环境,给予术者三维立体、形象而富有层次感的图像,有利于辨认解剖组织的质地、与周围的立体关系,使得缝合、结扎等手术操作更加精细,降低了腔镜下消化道重建的手术难度,提高了全腹腔镜下切除重建率[27]。Miyamoto等[28]通过研究发现应用3D腹腔镜系统在胰十二指肠切除过程中能帮助术者辨认胰腺周围组织结构,包括胰管的大小、位置等方面优势明显。这使得3D腹腔镜手术在血管骨骼化、淋巴结清扫方面具有极大的优势[29],特别是在消化道重建上,降低腹腔镜下吻合的难度,同时也降低出血、胆汁漏、胰瘘的风险[30],因此LPD在将来有可能成为十二指肠乳头腺癌切除的标准术式。
总之,腹腔镜作为一种手术方式可以给患者带来围手术期的获益,但腹腔镜不等于微创,术中需牢记无瘤观念与原则。恶性肿瘤治疗中患者生存率持续提高是医者孜孜不倦的追求。我们目前研究结果提示腹腔镜胰十二指肠切在治疗十二指肠乳头腺癌方面遵循肿瘤治疗原则,与开腹相比近期效果和远期总生存率无明显差别,但本研究为回顾性研究病例数少存在偏倚,有待进一步随机对照试验研究证实。

