血红素氧合酶1在胰腺癌组织中的表达及临床意义
刘海潮,刘少朋,白明辉,苏宝威
(郑州大学附属洛阳中心医院 肝胆疝二科,河南 洛阳 471000)
胰腺癌是常见的消化系统恶性肿瘤,发病率高,病死率高,预后差[1-2]。胰腺癌治疗方法众多,如外科手术、药物化疗、放疗、射频消融、微波消融、纳米刀消融、冷冻等,但基于胰腺癌较高的恶性生物学行为,转移早、复发率高,治疗效果仍不理想[3-6]。随着生物科学技术的进步,人类对肿瘤的探索已迈入生物分子时代,更加注重对肿瘤发生发展机制的相关研究。血红素氧合酶(heme oxygenase,HO)是人体代谢中的重要成分,可分为3型,其中,血红素氧合酶1(heme oxygenase,HO-1)又被称为热休克蛋白32(HSP-32),它既是一种诱导型微粒体催化酶,又是一种促进分解代谢的限速酶[7],广泛参与了机体炎症反应,具有抗氧化、保护重要组织、器官及细胞的功能[8]。研究[9-11]显示,HO-1同时也参与了细胞凋亡、肿瘤发生、进展等重要途径。但截至目前,国内关于HO-1在胰腺癌中的研究较少。基于以上因素,本研究通过不同方法检测胰腺癌组织中HO-1的表达情况,并分析其与胰腺癌发生发展及预后间的关系,以期为后续研究提供一定参考,并寻找胰腺癌治疗可能潜在的新靶点。
1 材料与方法
1.1 一般资料
选取2016年1月—2019年1月期间在我院普外科诊治的80例行手术切除的胰腺癌患者为研究对象。收集癌组织及癌旁组织(距癌灶边缘>2 cm)纳入标准:⑴ 术前未行化疗、放疗等辅助治疗;⑵ 手术可切除,且术后经两名病理科医师行病理学阅片证实为胰腺癌;⑶ 未合并其他脏器转移;⑷ 患者一般情况良好,能耐受手术,无明显心、脑、肺脏器疾病。排除标准:⑴ 术前行化疗、放疗等相关辅助治疗;⑵ 术前合并远处脏器转移;⑶ 患者无法耐受手术;⑷ 依从性差,不能规律随访者。本研究资料完整,无失访,且征得医院医学伦理委员会批准,并取得患者知情同意。
1.2 实验方法
1.2.1 免疫组织化学法检测HO-1 的表达 术后标本经处理后,以10% 甲醛固定并行石蜡包埋,切片机4 μm 连续切片(同一标本均切4 张),65 ℃烤片、二甲苯脱蜡、水化。EDTA 修复液高压修复2 min,PBS 试剂洗涤3 次,加入过氧化氢阻断内源性过氧化物酶(30 ml/L),37 ℃室温孵育后用羊血清封闭20 min。滤纸吸净周围残余渗液,加入兔抗人HO-1 多克隆抗体(1:500)为一抗,再滴加PBS 试剂重复以上操作(空白对照),置4 ℃冰箱过夜,再加入生物素化山羊抗兔IgG 为二抗,恒温37 ℃烤箱30 min,再次PBS 冲洗3 次,室温下二氨基联苯胺(DAB)显色7 min,清水冲洗后苏木素复染。乙醇脱水并中性树胶封片后行镜下观察。
1.2.2 Western blot 法检测HO-1 的表达 分别提取两组组织蛋白,Bradford 比色法测定蛋白质浓度,分别加入同等浓度的细胞裂解液和缓冲液,沸水煮沸3 min,采用考马斯亮蓝法测定蛋白浓度:分别取100 μg 样品上样,行凝胶电泳、脱脂后加入一抗,室温过夜后行TBST 冲洗3 次(15 min/ 次),加入适量辣根过氧化物酶标记IgG 二抗,室温孵育1 h 后再行TBST 冲洗3 次。ECL 试剂盒显影,并用扫描仪对底片进行透扫,对结果行灰度分析。
1.2.3 免疫组化结果判定 依据Thomas 综合计分法[12],在光镜(×400)下每个切片随机选取5 个视野,观察染色强度及染色广度(阳性细胞所占百分比)。染色强度评分:0 分(无色),1 分(淡黄色),2 分(棕黄色),3 分(黄褐色);染色广度评分:0 分(0~10%),1 分(11%~25%),2 分(26%~50%),3 分(51%~75%),4 分(76%~100%)。以染色强度法+ 染色广度法综合积分进行评判:0~4 分:阴性表达(-);5~12 分:阳性表达(+)。
1.3 统计学处理
SPSS 19.0统计学软件对所得数据进行统计分析。其中,定量资料以均数±标准差(±s)表示,计数资料以例数(百分比)[n(%)]表示,定量资料的比较采用t检验、秩和检验或单因素方差分析;计数资料的比较采用χ2检验或确切概率法。组间相关关系比较采用Pearson相关分析,生存期比较采用Log-rank检验,SPSS绘制生存曲线。P<0.05为差异具有统计学意义。
2 结 果
2.1 免疫组织化学法检测胰腺癌组织及癌旁组织中HO-1 的表达情况
光镜下显示,HO-1主要表达在胰腺癌细胞质中,呈棕黄色或棕褐色。HO-1在胰腺癌组织中表达阳性率为78.75%(63/80),而在周围癌旁组织中表达阳性率为11.25%(9/80),差异有统计学意义(P<0.05)(图1)(表1)。

图1 免疫组织化检测HO-1 的表达(×200) Figure 1 Immunohistochemical staining for HO-1 expression (×200)

表1 胰腺癌组织及癌旁正常胰腺组织中HO-1 的表达情况[n(%)]Table 1 HO-1 expressions in pancreatic cancer tissue and adjacent normal pancreatic tissue [n (%)]
2.2 Western blot 法检测胰腺癌组织及癌旁组织中HO-1 的表达情况
Western blot检测结果显示,胰腺癌组织中HO-1的表达量较于癌旁胰腺组织明显升高,定量分析显示差异有统计学意义(P<0.05)(图2)。
2.3 HO-1 蛋白的表达与胰腺癌临床病理特征的关系
HO-1蛋白的表达与患者性别、年龄及CA19-9的高低无关(均P>0.05),但与TNM分期、肿瘤分化程度及淋巴结转移有关(均P<0.05);TNM分期越晚、肿瘤分化程度越低及发生淋巴结转移者,HO-1的阳性率越高(表2)。

图2 胰腺癌组织及癌旁组织中HO-1 蛋白的相对表达量比较Figure 2 Comparison of the relative expression levels of HO-1 protein in pancreatic cancer tissue and tumor adjacent tissue
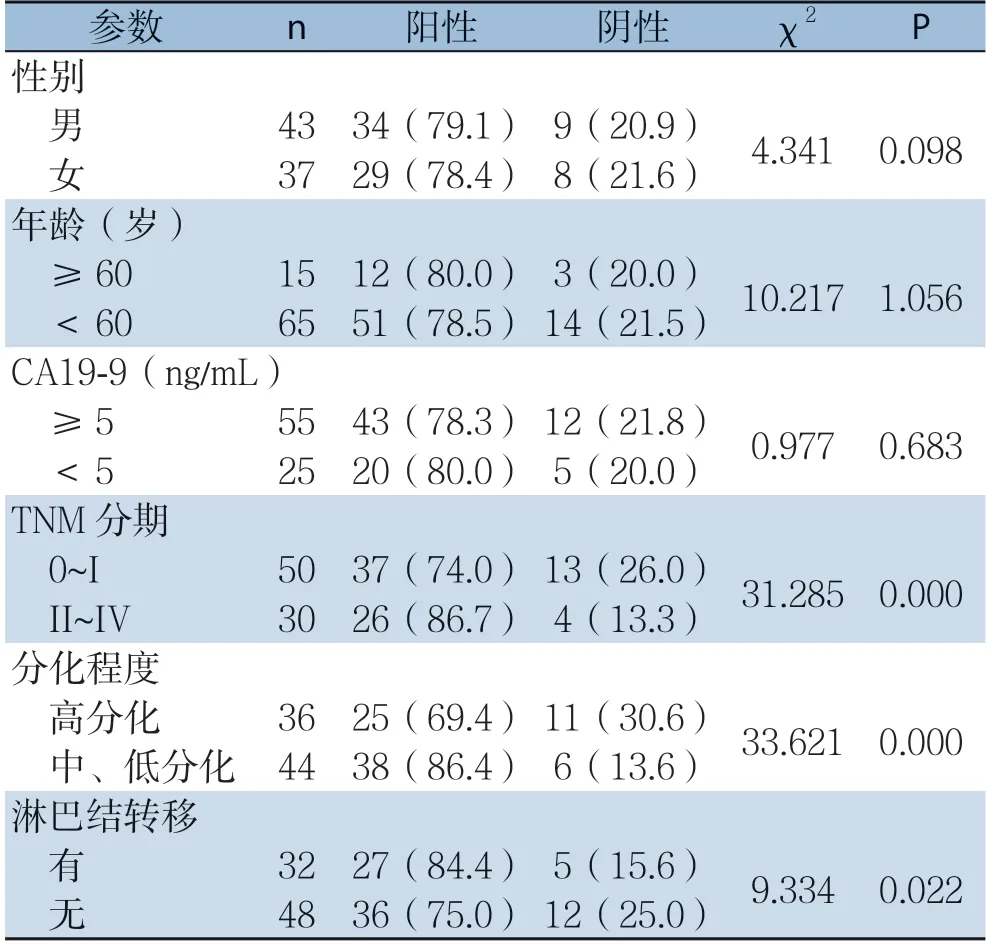
表2 HO-1蛋白的表达与胰腺癌临床病理因素的关系[n(%)]Table 2 Relations of HO-1 expression with the clinicopathologic features of pancreatic cancer [n (%)]
2.4 HO-1 蛋白的表达与胰腺癌患者生存期的关系
所有研究者均随访至2019年6月。Log-rank检验示,HO-1阳性表达的63例胰腺癌患者中位生存期为25.1个月,而剩余的17例HO-1表达阴性的胰腺癌患者中位生存期为36.7个月,明显优于前者,差异有统计学意义(P<0.05)(图3)。

图3 HO-1 阳性及阴性表达的胰腺癌患者的生存曲线Figure 3 Survival curves of pancreatic cancer patients with positive and negative HO-1 expressions
3 讨 论
作为常见的消化系统恶性肿瘤,胰腺癌发病率高,恶性程度高,且病死率高,被称为“癌中之王”[13-14]。以外科手术为主的治疗方法极大的提高了胰腺癌患者的生存率,但由于胰腺为腹膜后器官,位置深在,发病隐匿,且胰腺癌缺乏典型的临床表现,因此多数患者发现时已属中晚期,多已丧失外科手术时机[15]。对于中晚期胰腺癌患者,药物化疗是主要的治疗方法之一,但 由于肿瘤发生是多分子通路相互作用的过程,癌细胞基因突变多,易对化疗药物产生耐药,化疗敏感性差[16-18]。因此,基于分子层面而不断寻求新的药物治疗潜在靶点就显得尤为重要。相关研究[19-21]已证实,HO-1是人体抵抗应激反应的重要组成部分,可将血红素分解为胆绿素及一氧化碳等,进而分解为胆红素,参与机体代谢、氧化还原反应过程。研究[22-24]发现,HO-1在冠状动脉粥样硬化性心脏病、急性肾损伤、急性脑梗死等疾病进展过程中具有抗氧化、减轻应激反应的作用。但与此同时,目前国内外研究也显示,HO-1 在肿瘤的发生发展中也具有促进作用,Ren等[25]发现,HO-1 其在胃癌上皮细胞细胞质中明显高表达,有可能促进了胃癌的发生。此外,在肺癌、乳腺癌、前列腺癌等实体肿瘤中均发现了HO-1 的高表达状态[26-28],这提示HO-1可能作为一种促癌基因,广泛参与了诸多肿瘤的进展。在胰腺癌中,国外Abdalla等[29]研究提示,抑制HO-1可降低干细胞标志物CD133和CD44的表达,可用于胰腺癌患者的治疗。Nuhn等[30]发现,抑制HO-1和铁在胰腺癌细胞中的螯合作用与胰腺肿瘤对体内化疗的敏感性增加有关,可能为胰腺癌的治疗提供新的策略。但截至目前,国内关于HO-1在胰腺癌发病过程中的相关研究却较少,因此本课题结合目前已有研究成果,着重探究了HO-1在胰腺癌组织中的表达,分析其与胰腺癌患者的临床预后相关性,以便为后续更多研究提供参考。
3.1 免疫组化法及Western blot 法检测HO-1 在胰腺癌组织中的表达
免疫组化法显示,HO-1 主要表达于胰腺细胞质中,且在胰腺癌中呈高表达,阳性率为78.75%,而在癌旁正常胰腺组织中呈明显低表达,阳性率为11.25%,两组患者差异显著,说明HO-1可能参与并促进了胰腺癌的发生,这与蒋洁等[31]的研究结果类似。Western blot法检测发现,在胰腺癌组织中HO-1表达量显著高于癌旁正常胰腺组织。这与免疫组化法结果保持一致,更进一步提示HO-1与胰腺癌关系密切,且可能与胰腺癌的发展有协同作用。药物化疗的机理是细胞毒性药物作用于肿瘤的发生发展通路,进而抑制肿瘤的进展。基于以上因素,作者猜测抑制HO-1的表达,可能有助于抑制胰腺癌的进展,进而为胰腺癌的治疗提供新的分子靶点。本课题后续研究将对此进行着重探究。
3.2 HO-1 的表达与胰腺癌患者临床病理特征的相关性分析
分析HO-1与临床病理特征之间的关系,结果显示,HO-1与患者性别、年龄及CA19-9的表达无关,但与胰腺癌TNM分期、肿瘤分化程度及淋巴结转移密切相关,且TNM分期越晚、肿瘤分化程度越低和(或)发生淋巴结转移者,HO-1的表达量呈明显升高趋势。结合上述实验研究,提示HO-1不仅参与了胰腺癌的发生,且与胰腺癌患者的临床病理特征具有显著相关性,可能促进了胰腺癌的进展,这与国外相关研究结果类似[32-33]。胰腺癌TNM分期越晚、肿瘤分化程度越低者,则预后越差,而HO-1与胰腺癌临床病理特征显著相关,因此,随着研究深入,检测HO-1的表达可能成为预测胰腺癌进展的又一新指标。
3.3 HO-1 的表达与胰腺癌患者生存期的相关性分析
随后的Log-rank 检验发现,HO-1 表达阳性的胰腺癌患者中位生存期为25.1个月,显著短于HO-1表达阴性的胰腺癌患者,说明HO-1的表达与胰腺癌患者的生存期关系密切,这对临床治疗中判定胰腺癌患者的预后起到了一定的参考价值。
总之,本课题发现HO-1 在胰腺癌中呈高表达,且与胰腺癌患者临床病理特征及预后具有高度相关性,揭示了其有可能在胰腺癌发生发展过程中起到了某种协同促进作用,对胰腺癌的诊治及预后判断具有一定的参考价值,有可能成为胰腺癌药物化疗潜在的新靶点。但本研究周期短、样本量小,后续实验将对HO-1在胰腺癌细胞增殖等过程中的具体作用机制进行更加深入研究,以期进一步探究其内在作用机制,为临床治疗提供一定参考。

