PD-1、PDL-1和T淋巴细胞亚群在乳腺癌中的表达及价值*
钟亚春,陆 璇,杨 泳,彭文茜,黄 倩
(武汉市第一医院甲状腺乳腺外科 430022)
乳腺癌发病率高居女性恶性肿瘤的第二位,仅次于宫颈癌,近些年来,其发病率尚有年轻化和增高趋势[1-3]。手术联合术后化疗是根治乳腺癌的主要方法,但乳腺癌术后复发率仍较高,可能是术前存在肿瘤微转移,这也是导致患者预后不良的主要危险因素[4]。肿瘤细胞的快速生长和转移与肿瘤细胞的生物学特性紧密相关。正常组织中,人体细胞的生长、凋亡处于一种动态平衡,但肿瘤细胞理论上可以无限制复制,主要原因是肿瘤细胞的生物学特性可以让其逃脱机体免疫系统的杀伤作用。程序性死亡分子1(programmed death-1,PD-1)、程序性死亡配体1(programmed death ligand-1,PD-L1)信号通路是诱导免疫逃逸的主要机制之一。有研究显示在结直肠癌患者中PD-1可以通过促进T淋巴细胞的凋亡,抑制细胞毒性T淋巴细胞活性,从而抑制机体免疫系统对肿瘤细胞的杀伤作用,达到肿瘤免疫逃逸的作用[5-9]。本研究旨在探讨乳腺癌组织中PD-1介导的免疫信号通路及作用,为后续临床干预提供理论依据。
1 资料与方法
1.1一般方法 2017年6月至2018年6月收集本院收治的乳腺癌患者92例,纳入标准:乳腺癌(诊断依据为病理);无远处转移;年龄18~65岁。排除标准:复发性乳腺癌;术前检查发现远处转移;感染;术前接受放化疗等;肝肾、心脑肺等重大疾病;合并其他恶性肿瘤;失访。本研究征得本院伦理委员会批准,并获得所有患者知情同意。92例乳腺癌患者中,年龄38~65岁,平均(51.28±6.74)岁,TNM分期为Ⅰ、Ⅱ、Ⅲ期的分别为22、43、27例,直径1.2~7.5 cm,平均(4.21±1.49)cm,肿瘤细胞分化程度为高、中、低的分别为54、28、10例,导管癌、小叶癌分别62和30例,Her-2阳性的43例,淋巴结转移25例。
1.2数据收集 检测PD-1、PD-L1、CD4+T淋巴细胞、CD8+T淋巴细胞和调节性T淋巴细胞(Treg)。分析PD-1、PD-L1、CD4+T淋巴细胞、CD8+T淋巴细胞、Treg与乳腺癌患者临床特征(年龄、TNM分期、直径、肿瘤细胞分化程度)的相关性。
1.3检测方法 (1)PD-1、PD-L1:择期行乳腺癌根治术,术中取得乳腺癌组织和癌旁组织标本,行免疫组织化学法检测,相关抗体、DAB显色试剂盒、ElivisionTMplus试剂盒由福建迈新生物技术有限公司统一提供。计分方式:包括染色强度和阳性细胞百分比两项,深褐色(3分)、黄色(2分)、浅黄色(1分)和无色(0分);阳性细胞百分比大于60%(3分)、>30%~60%(2分)、>0~30%(1分)和0(0分);两个计分项目的和为总分,总分为2~6分即认为阳性,否则认为阴性。(2)CD4+T淋巴细胞、CD8+T淋巴细胞和Treg:取相应组织制作细胞悬液,分离淋巴细胞(密度梯度离心法),磷酸盐缓冲液(PBS)洗涤3次,加入单克隆抗体,室温反应30 min,流式细胞仪检测(美国Beckman coulter公司Epics XL型流式细胞仪)。
2 结 果
2.1乳腺癌组织和癌旁组织PD-1免疫信号通路相关指标差异 与癌旁组织比较,乳腺癌组织PD-1、PD-L1、Treg、CD4+T淋巴细胞表达增高,而CD8+T淋巴细胞表达降低(P<0.01)。见表1。
2.2年龄与PD-1免疫信号通路相关指标的相关性 年龄大于或等于50岁与小于50岁的患者乳腺癌组织中PD-1、PD-L1、Treg、CD4+T淋巴细胞和CD8+T淋巴细胞差异均无统计学意义(P>0.05)。见表2。
2.3TNM分期与PD-1免疫信号通路相关指标的相关性 与TNM分期为Ⅰ或Ⅱ期的患者比较,Ⅲ期的患者乳腺癌组织PD-1、PD-L1、Treg、CD4+T淋巴细胞表达增高,而CD8+T淋巴细胞表达降低(P<0.01)。见表3。

表1 乳腺癌组织和癌旁组织PD-1免疫通路相关指标差异
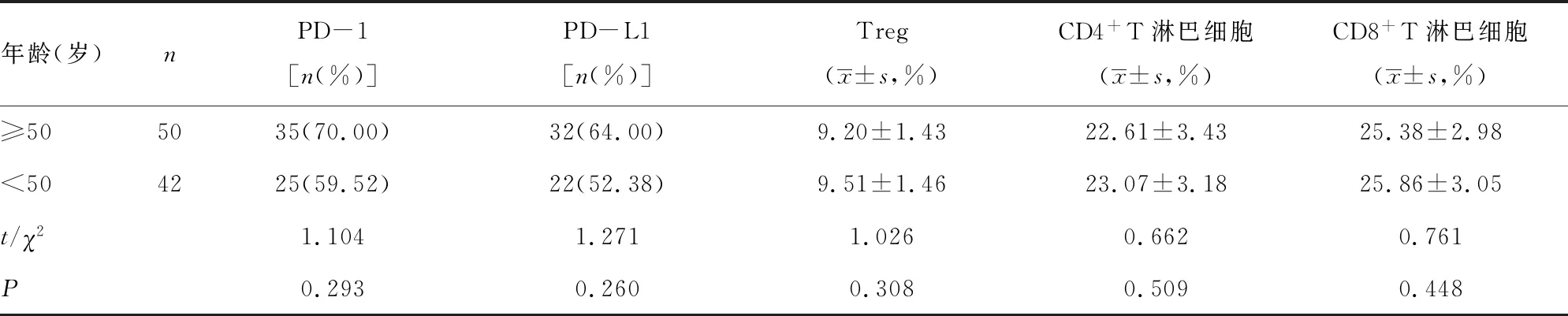
表2 年龄与PD-1免疫通路相关指标的相关性
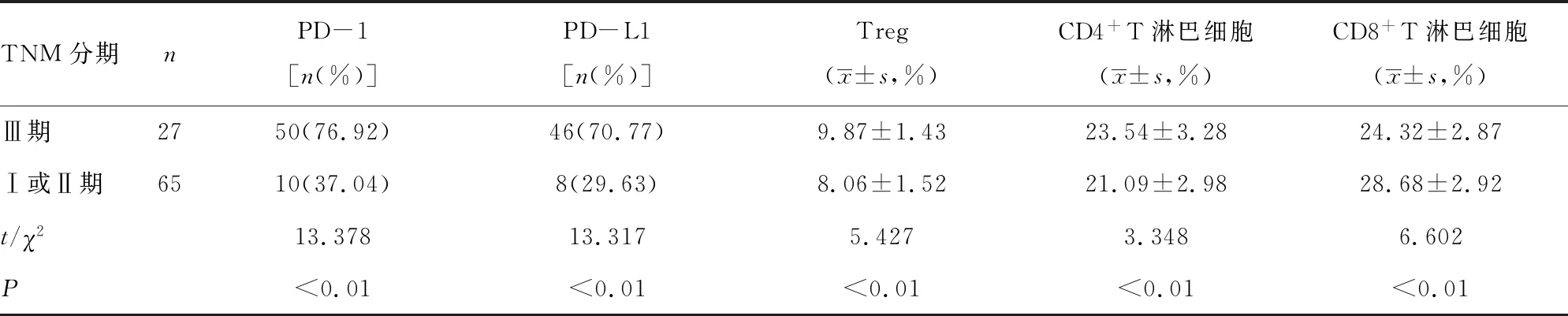
表3 TNM分期与PD-1免疫通路相关指标的相关性
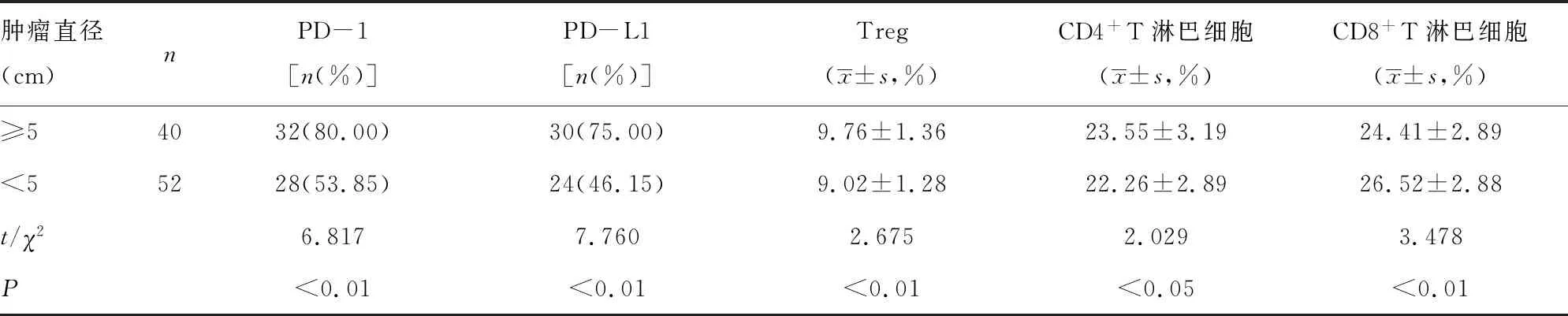
表4 肿瘤直径与PD-1免疫通路相关指标的相关性
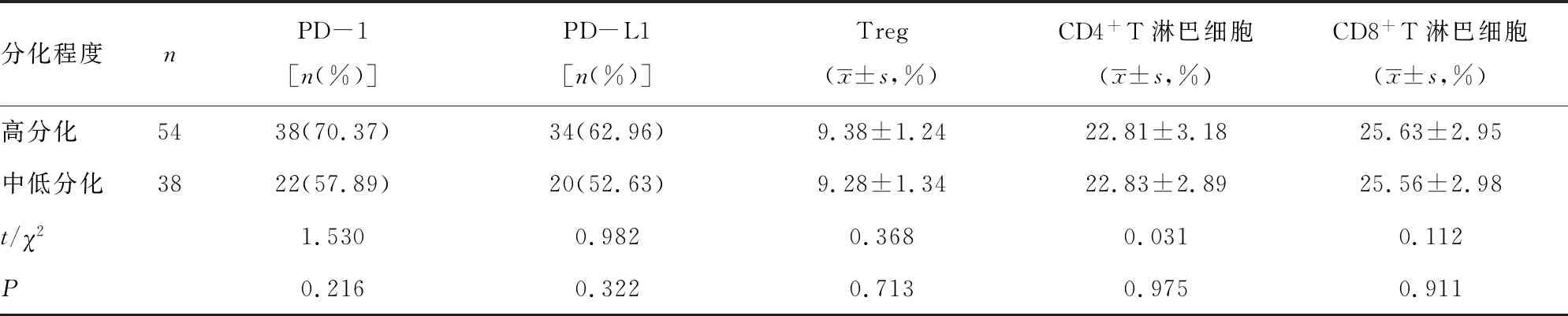
表5 分化程度与PD-1免疫通路相关指标的相关性
2.4肿瘤直径与PD-1免疫信号通路相关指标的相关性 与肿瘤直径小于5 cm的患者相比,≥5 cm的患者乳腺癌组织PD-1、PD-L1、Treg、CD4+T淋巴细胞表达增高,而CD8+T淋巴细胞表达降低(P<0.05)。见表4。
2.5分化程度与PD-1免疫通路相关指标的相关性 中低分化和高分化的患者乳腺癌组织中PD-1、PD-L1、Treg、CD4+T淋巴细胞和CD8+T淋巴细胞差异均无统计学意义(P>0.05)。见表5。
3 讨 论
肿瘤的生物学特性对肿瘤细胞的生长和转移具有重大影响,这也是不同生物学特性患者临床预后不同的主要原因。本研究探讨了PD-1介导的免疫通路在乳腺癌患者发病和发展中的作用,结果发现乳腺癌组织中PD-1、PD-L1、Treg、CD4+T淋巴细胞表达增高,而CD8+T淋巴细胞表达降低(P<0.05),且与肿瘤直径、TNM分期有关。
尽管对乳腺癌的治疗最近取得了一定进展,但20%的患者乳腺癌仍然发生转移和死亡[10-12]。在过去的几十年中,分子机制参与了乳腺癌的转移已经被确定,因此各类靶向药物治疗目前日益得到重视。尽管如此,乳腺癌的发病率和病死率仍高居不下,肿瘤细胞的免疫逃脱在乳腺癌的发病和发展中具有重要意义[13-15]。正常情况下,组织中细胞生长和凋亡处于动态平衡,在病理条件下,这种平衡受到破坏,肿瘤的免疫受到诸多因素的影响,其中就有肿瘤细胞表面分子的改变,从而诱导抑制机体免疫功能,逃脱免疫系统对其杀伤作用。PD-1是机体重要的免疫抑制分子之一,是一种免疫球蛋白,也是一种膜蛋白,由268个氨基酸残基组成,第一次在凋亡小鼠T淋巴细胞杂交瘤2B4.11被克隆出来。PDL-1则是机体的一种蛋白质,由CD274基因编码,其主要功能是降低细胞毒性T淋巴细胞(主要由CD8+T淋巴细胞分化而来),增加Treg(主要由CD4+T淋巴细胞受到免疫抑制分子的作用分化而来),达到抑制机体免疫系统的目的[16-17]。乳腺癌组织中的Treg主要由CD4+T淋巴细胞受到免疫抑制分子的作用分化而来,具有免疫抑制功能。Treg细胞在肿瘤组织中的作用目前备受关注,可以导致免疫抑制、免疫无功能,促进多种癌细胞的生长和转移[18-20]。本研究显示,乳腺癌组织中PD-1、PDL-1、Treg、CD4+T淋巴细胞升高,且与肿瘤直径和TNM分期有关,说明PD-1、PDL-1在乳腺癌组织中的高表达可以促进Treg和CD4+T淋巴细胞的表达,进而促进肿瘤细胞的生长,导致患者预后不良。此外,本研究显示乳腺癌组织中CD8+T淋巴细胞降低,CD8+T淋巴细胞在肿瘤微环境中可分化为细胞毒性T淋巴细胞,是杀伤肿瘤细胞的关键效应性T淋巴细胞,水平降低表明免疫系统对肿瘤细胞杀伤能力下降[21-24]。由此可见PD-1、PDL-1的高表达还可以通过抑制CD8+T淋巴细胞的表达,导致其分化为细胞毒性T淋巴细胞的能力下降,从而促进乳腺癌细胞生长和转移。PD-1、PDL-1在乳腺癌组织中的高表达可能与NF-κB信号通路被激活有关[25]。目前以PD-1和PD-L1为靶点的靶向药物治疗和免疫调节已经在临床开始尝试,在卵巢癌、肾癌、宫颈癌、非小细胞肺癌患者中已经被证实有效[26-29]。因此以PD-1和PD-L1为靶点的靶向药物治疗和免疫调节可考虑在乳腺癌患者中进行,但是目前尚缺乏进一步研究。
综上所述,PD-1和PD-L1在乳腺癌组织中升高,抑制T淋巴细胞对肿瘤细胞的杀伤,与TNM分期和肿瘤直径有关。

