小剂量氯胺酮对抑郁大鼠海马Rac1蛋白表达及树突棘密度的影响*
朱贤林,王在平,叶 刚,姚娜娜,朱荣誉,牟俊英,吴帮林
(恩施土家族苗族自治州中心医院麻醉科,湖北恩施 445000)
抑郁症是一种常见的精神类疾病,具有高发病率和高致残率等特点,严重危害人类身心健康[1]。传统药物如三环类抗抑郁药和选择性5-羟色胺再摄取抑制剂(selective serotonin reuptake inhibitors,SSRIs)极大地促进了抑郁症治疗,但这些药物具有起效缓慢、缓解率低等缺点,尤其对重度抑郁患者治疗效果不佳[2]。近年临床研究发现,静脉麻醉药氯胺酮具有快速、持久的抗抑郁作用,尤其对于重度抑郁症及SSRIs类药物治疗效果不佳的患者有效[3],但其具体机制尚不清楚。研究表明,抑郁症的发病与突触可塑性改变有关,抑郁患者大脑边缘脑区的容积明显缩小,神经元萎缩和树突复杂性发生改变[4]。Rac1是小G 蛋白Rho家族中的一员,通过调节神经元骨架重构,能够导致突触结构发生改变,从而调节突触可塑性。本研究拟观察小剂量氯胺酮对抑郁大鼠海马Rac1蛋白表达及树突形态学的影响,以期阐明氯胺酮发挥抗抑郁作用的可能机制。
1 材料与方法
1.1动物及抑郁模型 成年雄性SD大鼠50只,鼠龄2~3个月,体质量200~250 g,由湖北民族大学动物实验中心提供。在室温(22±2)℃条件下适应性饲养7 d,自由摄取食物和水,采用慢性不可预见性轻度应激法(chronic unpredictable mild stress,CUMS)建立大鼠抑郁模型[5],具体方法为:将大鼠孤笼饲养后,每天随机安排一种应激,连续28 d,且每3天应激方法不重复。9种应激方法为:夹尾1 min;禁食24 h;鼠笼45°倾斜24 h;禁水24 h;潮湿垫料24 h;昼夜颠倒24 h;45 ℃热水游泳5 min;4 ℃冰水游泳5 min;水平摇晃鼠笼(1次/s)15 min。
1.2方法
1.2.1实验分组及处理 抑郁建模完成后,根据糖水偏好实验和旷场实验结果,选取抑郁评分相近的48只大鼠,分为4组(n=12):抑郁组(D组)、氯胺酮组(DK组)、氯胺酮+NSC23766组(DKN组)和NSC23766组(DN组),另选同一批成年、SD雄性大鼠12只作为对照组(C组)。C组大鼠不接受CUMS应激,腹腔注射生理盐水8 mL/kg进行处理; D组大鼠只接受腹腔注射生理盐水8 mL/kg处理;DK组大鼠腹腔注射氯胺酮(批号:KH091201,恒瑞医药)10 mg/kg;DKN组大鼠腹腔注射 Rac1抑制剂NSC23766(sc-204823A,美国Santa Cruz公司)2.5 mg/kg[6],5 min后给予氯胺酮10 mg/kg腹腔注射;DN组大鼠给予NSC23766 2.5 mg/kg腹腔注射。以上处理每天1次,连续7 d。
1.2.2糖水偏好实验 糖水偏好实验是通过检测糖水消耗量和糖水偏爱百分比作为衡量大鼠快感缺乏的客观指标,从而评估大鼠的抑郁状态。分别于建模后和氯胺酮处理后进行。大鼠给予2 d的糖水适应,第1天每笼放入2瓶1%蔗糖溶液,第2天每笼放入纯水和1%蔗糖溶液各1瓶。然后让其禁饮、禁食23 h,随后每笼放入提前准备好的1%蔗糖溶液和纯水各1瓶,允许大鼠自由饮水1 h,然后收集水瓶称重,计算每只大鼠1 h内消耗的纯水量和糖水量。糖水偏好百分比=[消耗的糖水量/(消耗的糖水量+消耗的纯水量)]×100%[7]。
1.2.3旷场实验 旷场实验也常用于评估动物抑郁状态[8]。实验装置为60 cm×60 cm×40 cm,四周底面全部涂黑的无盖木制方箱,底面用白线划分成12 cm×12 cm的25个方格。在箱子上方1 m处放置一摄像头,镜头对准箱底,实验在安静环境下进行将动物小心放在箱底中心,观察5 min内水平移动距离(即水平穿行方格数)和竖直站立次数。
1.2.4Western blot检测海马Rac1、Tiam1和α-chimaerin蛋白表达 取出冷冻的海马组织称重,在液氮中磨碎,加入RIPA缓冲液充分混匀(每克组织3 mL RIPA),4 ℃离心10 min,转速12 000 r/min,然后取上清液。加入缓冲液充分混匀后(缓冲液与上清液按4∶1的比例),于100 ℃沸水中煮5 min。取50 μg蛋白样品,先通过十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE)进行分离,然后电转至聚偏氟乙烯(PVDF)膜上,于室温下用5%脱脂奶粉封闭1 h。加入一抗:Rac1(1∶1 000稀释,23A8∶ab33186,英国Abcam公司);Tiam1(1∶200稀释,E-7∶sc-393315,美国Santa Cruz公司);α-chimaerin(1∶500稀释,G-8∶sc-365985,美国Santa Cruz公司);甘油醛-3-磷酸脱氢酶(GAPDH,1∶1 000稀释,美国Santa Cruz公司),4 ℃摇床孵育12 h;含吐温20的磷酸盐缓冲液(PBST)漂洗10 min,共3次。然后加入辣根过氧化物酶(HRP)标记的羊抗兔IgG(1∶5 000稀释,美国Santa Cruz公司),室温孵育2 h;PBST漂洗10 min,共3次。以GAPDH作为内参,用增强化学发光法(ECL)检测蛋白表达,并用凝胶成像系统照相。
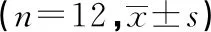
表1 各组大鼠氯胺酮治疗前后糖水偏好百分比和旷场测试结果
a:P<0.05,与C组比较,b:P<0.05,与D组比较;c:P<0.05,与DK组比较;d:P<0.05,与DKN组比较
1.2.5GST pull-down法检测Rac1的活性 根据Rac1的活性分析试剂盒说明书(Active Rac1 Pull-Down and Detection Kit,美国Thermo Fisher Scientific公司)操作,具体如下:将冷冻的海马组织称重并在液氮中磨碎,然后于每毫升溶液中加入20 μL Rac1分析反应物(PAK-1 PBD,琼脂),4 ℃下轻微摇晃60 min,充分混匀,14 000 r/min,4 ℃离心15 min,取上清液转入到EP管中。加入4倍缓冲液,充分混匀。然后通过Western blot方法检测GTP-Rac1蛋白量。
1.2.6高尔基染色及树突形态分析 根据高尔基染色试剂盒说明书(FD Rapid GolgiStain Kit,PK 401/401A)进行操作,提前24 h配好A、B、C、D、E溶液(均由不同容积的PK 401和401A混合而成)。各组大鼠完成行为学实验后随即挑选6只用于高尔基染色,在腹腔注射2%戊巴比妥50 mg/kg麻醉后处死,迅速取出大脑,于去离子水中洗净血液,然后浸入装有A+B等量混合液的试管中,在室温下避光保存14 d(次日换A+B等量混合液)。将大脑从A+B混合液中转入装有C液的试管中,室温避光保存96 h(次日更换C溶液)。取出脑组织,在低温下放入振动切片机中切片(-20 ℃~-22 ℃),片厚150 μm,切片放入6%蔗糖溶液中[以0.1 mol/L杜氏磷酸缓冲液(DPBS)配制],室温避光保存72 h。将脑片放在漂染皿中,用去离子水漂洗2次,每次4 min。将去离子水吸净,然后加入适量染色混合液(D液∶E液∶去离子水=1∶1∶2)孵育10 min。用负压吸引器将染色混合液吸净,加入去离子水清洗两次,每次4 min。将脑片移至载玻片上,依次用50%、75%、95%的乙醇梯度脱水,每个乙醇浓度脱水4 min。然后再用100%乙醇脱水4次,每次4 min。二甲苯浸泡3次,每次4 min。滴加适量中性树胶后用盖玻片封片,晾干,避光保存。于光学显微镜(BX-51,日本Olympus公司)下观察、拍照。选择具有典型海马CA1 结构部位的神经元,用NIH Image J软件分析神经元的树突棘密度和树突棘形态。在400倍显微镜下以神经元胞体为圆心,做递增间距为50 μm的同心圆,检测树突长度(μm),同时根据重建图像检测树突分支数。树突棘密度指二级树突分支上顶树突部位每10微米的树突棘数量。
2 结 果
2.1各组大鼠治疗前后糖水偏好百分比和旷场实验结果比较 氯胺酮处理前,各组大鼠的糖水偏好百分比、水平移动距离、直立次数差异均有统计学意义(F=28.532、31.464、19.173,P<0.01),与C组相比,D、DK、DKN、DN组糖水偏好百分比、水平移动距离和直立次数均明显下降(P<0.01),但D、DK、DKN、DN组之间进行比较时,差异均无统计学意义(P>0.05);氯胺酮处理后,与D组相比,DK组糖水偏好百分比、水平移动距离和直立次数明显上升(P<0.05),但仍然低于C组,差异有统计学意义(P<0.05)。与DK组相比,DKN、DN组糖水偏好百分比、水平移动距离和直立次数均明显下降,差异有统计学意义(P<0.05)。见表1。
2.2各组大鼠海马Rac1蛋白表达及Rac1活性的比较 各组大鼠海马Rac1蛋白表达水平及Rac1活性(Rac1-GTP)差异均有统计学意义(F=38.267,P<0.01);与C组相比,D组Rac1蛋白表达水平及Rac1活性均明显降低(P<0.05);与D组相比,DK组Rac1蛋白表达水平及Rac1活性均明显升高,但仍低于C组,差异有统计学意义(P<0.05);与DK组相比,DKN、DN两组Rac1蛋白表达水平及Rac1活性均明显降低(P<0.05),见图1。

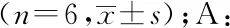
图1各组大鼠海马Rac1蛋白表达及其活性分析
2.3各组大鼠海马Tiam1、α1-chimaerin蛋白表达的比较 各组大鼠海马Tiam1、α1-chimaerin蛋白表达差异均有统计学意义(F=26.352、41.735,P<0.01);与C组相比,D组Tiam1表达水平明显降低,但α1-chimaerin表达水平明显升高(P<0.05);与D组相比,DK组Tiam1表达水平明显升高,但α1-chimaerin表达水平却明显下降,差异均有统计学意义(P<0.05);与DK组相比,DKN、DN两组Tiam1表达水平明显降低,而α1-chimaerin明显升高,差异有统计学意义(P<0.05),见图2。
2.4各组大鼠海马树突棘长度及树突棘密度的比较 对大鼠海马CA1区树突分析发现,各组大鼠海马CA1区树突棘长度、树突分支节点数、树突棘密度差异均有统计学意义(F=22.673、24.358、37.239,P<0.01)。与C组相比,D、DK、DKN、DN组树突棘长度、树突分支节点数、树突棘密度均明显减少或降低,差异有统计学意义(P<0.05);与D组相比,DK组树突棘长度、树突分支节点数、树突棘密度均明显升高,差异有统计学意义(P<0.05);与DK组相比,DKN、DN两组树突棘长度、树突分支节点数、树突棘密度均明显降低(P<0.05)。见图3、4。
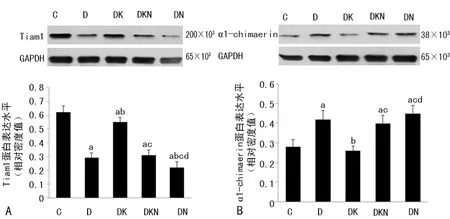
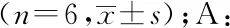
图2Westernblot检测各组大鼠海马Tiam1、α1-chimaerin蛋白表达
a:P<0.05,与C组比较,b:P<0.05,与D组比较;c:P<0.05,与DK组比较;A:高尔基染色图片(×400);B:大鼠海马CA1区树突棘长度;C:大鼠海马CA1区树突分支节点数
图3高尔基染色分析各组大鼠海马CA1区树突棘形态学改变
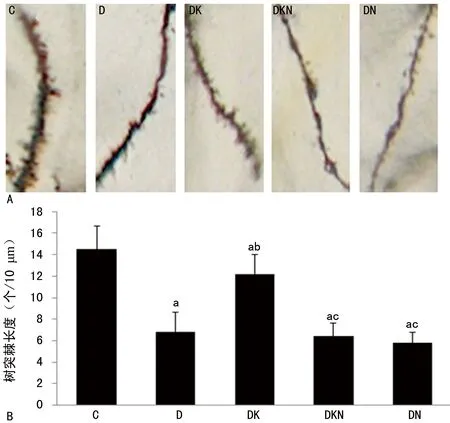
a:P<0.05,与C组比较,b:P<0.05,与D组比较;c:P<0.05,与DK组比较;A:高尔基染色图片(×1 000);B:大鼠海马CA1区树突棘密度
图4高尔基染色分析各组大鼠海马CA1区树突棘密度
3 讨 论
CUMS是目前国际上构建抑郁动物模型的常用方法。抑郁症的核心症状主要表现为兴趣缺失,而糖水偏好实验和旷场行为学实验能够反映大鼠的探索欲望和兴趣缺失,因而可对大鼠的抑郁程度做出较准确的评估[9]。本研究发现,与未接受建模干预的对照组相比,接受CUMS处理后的各组大鼠糖水偏好百分比、水平移动距离、直立次数均明显下降,表明本研究中大鼠抑郁模型的构建是成功的。
既往研究表明,氯胺酮作为一种非竞争性的NMDA受体拮抗剂,具有抗炎、抑制兴奋性毒性及调节神经细胞凋亡等中枢保护作用[10-11]。近期临床研究发现,氯胺酮对重度抑郁症及SSRIs类药物治疗效果不佳的患者也具有快速的抗抑郁作用,重度抑郁症患者单次静脉注射低于麻醉剂量的氯胺酮(0.5 mg/kg),40 min后就能产生快速、明显、持续的抗抑郁效应。注射24 h后,超过70%的患者症状改善了50%,其中有35%的患者注射1周后症状改善仍然明显[12-13]。由于氯胺酮本身具有一定的精神不良反应,且其精神不良反应会随着剂量的增加而更加明显[14]。氯胺酮用于啮齿类动物时,50 mg/kg的剂量被考虑为中等剂量或小剂量的上限,腹腔注射50 mg/kg的氯胺酮能够诱导健康大鼠产生精神不良反应,但10 mg/kg却未发现大鼠行为学异常[15]。因此,本研究选择10 mg/kg氯胺酮作为研究剂量,其目的在于更好地模拟临床。本团队前期研究也发现,小剂量氯胺酮能够增强电休克(一种有效的物理学抗抑郁治疗方法)的抗抑郁作用[16]。在本研究中发现,与D组相比,DK组大鼠的糖水偏好百分比、水平移动距离、直立次数均明显升高,表明大鼠的探索欲望明显增强,兴趣缺失得到有效改善,抑郁样行为明显减轻。本研究结果进一步证实了小剂量氯胺酮具有良好的抗抑郁作用。理论上小剂量氯胺酮应该包括0~50 mg的不同剂量,然而本研究没有观察10 mg以外的其他剂量,也未探讨不同剂量的氯胺酮对Rac1蛋白及大鼠抑郁样行为的影响,这是本研究的一个局限。
神经突触会随着神经活动而出现增强或减弱的现象称为突触可塑性,树突形态或树突棘密度改变均直接影响着突触的传递功能[17]。越来越多的研究表明,抑郁症的发病与突触可塑性的改变有关。脑影像学研究发现,抑郁患者大脑前额皮质及海马等边缘脑区(与情感、情绪和认知功能有关)的容积明显缩小,并伴随着大量神经元的萎缩和突触数量的减少[18]。尸检分析进一步证实了这一发现,即重度抑郁患者背侧前额皮质(dlPFC)和海马区椎体神经元的体积变小,大量突触丢失以及突触蛋白发生了改变[4]。 经典的SSRIs类药物氟西汀在诱发突触发生和增强突触传递功能的同时,能够发挥良好的抗抑郁效果[19]。本研究也发现,CUMS不仅能够诱发大鼠抑郁样行为,而且能够导致海马CA1区树突棘密度降低和树突复杂性下降,而氯胺酮治疗能够增加树突棘密度和复杂性,并有效改善大鼠的抑郁样行为。这些证据表明,突触可塑性与抑郁症发病相关,而氯胺酮可能通过调节突触可塑性发挥抗抑郁效应。
研究证实,Rac1在突触可塑性方面发挥着重要作用,激活或上调Rac1的表达可引起树突棘的形态发生剧烈改变,包括树突棘的延长和树突棘密度的增加等[20]。GOLDEN等[21]研究发现,在慢性社会挫败应激条件下,小鼠伏核区Rac1的表达及活性明显下调,并诱导社会逃避、兴趣缺失等抑郁样行为,同时伴随有树突棘密度及形态发生改变,通过组成性激活突变基因过表达Rac1,则上述突触结构和形态学改变明显被逆转,而小鼠的抑郁样症状得到有效缓解。
细胞内的Rac1有两种形式,即与GTP结合的激活形式GTP-Rac1和与GDP结合的失活形式GDP-Rac1。在GTP酶活化蛋白α1-chimaerin、Bcr/Abr的作用下,Rac1由激活形式转变成失活形式。反之,在GDP/GTP转换因子Tiam1、Kalirin7的作用下,Rac1由无活性的GDP状态向有活性的GTP状态转变,从而引发下游一系列的级联反应。本研究发现,CUMS能够下调大鼠海马Rac1蛋白的表达及活性,而氯胺酮改善大鼠抑郁行为的同时,能够上调海马Rac1的表达及活性,且预先给予Rac1特异拮抗剂NSC23766能够有效逆转氯胺酮对大鼠抑郁行为的影响及海马区树突棘形态的改变。另外,本研究也发现,氯胺酮能够导致Tiam1表达上调,而α1-chimaerin表达下降。这些证据表明,Rac1蛋白在氯胺酮抗抑郁效应中发挥了关键性作用。
综上所述,小剂量氯胺酮具有良好的抗抑郁效应,其发挥抗抑郁作用的具体机制可能是通过上调海马区Rac1蛋白表达及其活性,继而增加海马区树突棘密度及改善突触可塑性有关。

