二肽基肽酶-4水平、超敏C反应蛋白与冠状动脉病变程度的相关性
修倩茹 王誉旋 徐睿 李明杰 孙素娟 Avinas Rai 杨光 成宪武
(1延边大学附属医院心血管内科,吉林 延吉 133000;2延边大学数学系;3延边大学附属医院高血压科)
冠心病(CAD),即冠状动脉血管发生动脉粥样硬化(AS),引起血管狭窄或阻塞,造成心肌细胞缺血、缺氧、坏死而导致的心脏病,基本病理改变为冠状动脉的粥样硬化〔1〕。炎症反应作为AS斑块形成的主要引发剂,在内皮功能不全、斑块不稳定、斑块破裂中发挥重要作用〔2〕,贯穿AS发生发展全过程。超敏C反应蛋白(hs-CRP)作为代表低水平炎症状态的灵敏指标,与常规C反应蛋白(CRP)检测相比,具有敏感性更好、结果更准确、重复性更好的优点〔1〕,临床上用来评估心血管风险〔3〕。但目前关于hs-CRP与反映冠状动脉狭窄程度的SYNTAX积分的相关性研究报道较少。二肽基肽酶(DPP)-4,除可以升高血糖外,还参与了细胞内信号转导、细胞凋亡、炎症反应、氧化应激、脂质代谢、胰岛素抵抗和免疫激活过程〔4~7〕。血浆DPP-4水平在糖尿病、肥胖和AS患者中明显升高,可以推测升高的DPP-4活性可能与引起AS的心血管疾病有关,在2016年Yang等〔8〕的临床研究也表示:CAD患者血浆DPP-4水平明显高于非冠心病患者。但关于血浆DPP-4水平与CAD病变相关性的研究较少。本研究旨在探讨DPP-4水平、hs-CRP与冠状动脉病变程度的相关性。
1 资料与方法
1.1研究对象 2017年3~12月就诊于延边大学附属医院心内科,经冠状动脉造影(CAG)后明确诊断为CAD的120例为CAD组,按照SYNTAX积分要求,将CAD组进一步分为低危组44例,中危组36例,高危组40例,同时选取CAG阴性的40例患者作为对照组。
排除标准:先天性心脏病、原发性心脏瓣膜病、心肌病、心肌炎、由任何已知的全身因素引起的继发性心肌疾病或患有可能影响DPP-4水平的疾病如贫血、白血病、感染性疾病、急慢性肝肾功能不全、免疫性疾病、肿瘤等患者均被排除在外。
1.2一般资料 收集所有入组患者的年龄,性别,吸烟史,用药史(降压药物、胰岛素、他汀类药物、抗血小板药物)和既往史〔高血压(HBP)病史、吸烟史、糖尿病(DM)病史、脂质异常病史和脑血管疾病病史(CVD)〕。
1.3实验室检查 入组患者均在CAG前抽取肘静脉血液样本,对血浆进行分离之后,在-80℃冰箱中储存;用全自动生化仪检测血浆糖化血红蛋白(HbA1c)、hs-CRP、低密度脂蛋白胆固醇(LDL-C)、高密度脂蛋白胆固醇(HDL-C)、总胆固醇(TC)、三酰甘油(TG)和血肌酐(SCr)水平;用化学发光法检测DPP-4活性(Promega,Madison,WI)。
1.4CAG后按照SYNTAX积分进行分组 入组患者CAG结果均符合美国心脏病学会/美国心脏协会的诊断标准:CAG结果显示至少有一支血管狭窄程度≥50%诊断为CAD,<50%为CAG阴性。根据SYNTAX积分标准,对血管直径≥1.5 mm且冠脉血管管腔内狭窄程度≥50%的血管进行评分,SYNTAX积分≤22分为低危组,23~32分为中危组,≥33分为高危组。SYNTAX积分由术者和2位副高级及以上职称的介入医生完成。
1.5统计学处理 采用SPSS25.0软件进行χ2检验、方差分析、Kruskal-Wallis秩和检验、线性回归和Jonckheere-Terpstra方法。
2 结 果
2.1一般基本资料比较 CAD低危组、中危组的女性所占比例明显低于对照组(P<0.01)。CAD各组的年龄均明显高于对照组(P<0.05)。HBP患病率随着冠状动脉病变严重程度的增加而上升(P<0.05)。CAD中危组和高危组的β-受体阻滞剂(BB)用药史均明显高于对照组(P<0.05),并随着冠状动脉病变严重程度增加BB用药史也上升。既往胰岛素用药史、血管紧张素转换酶抑制剂(ACEI)用药史的例数随着冠状动脉病变严重程度的增加而上升(P<0.05),见表1。
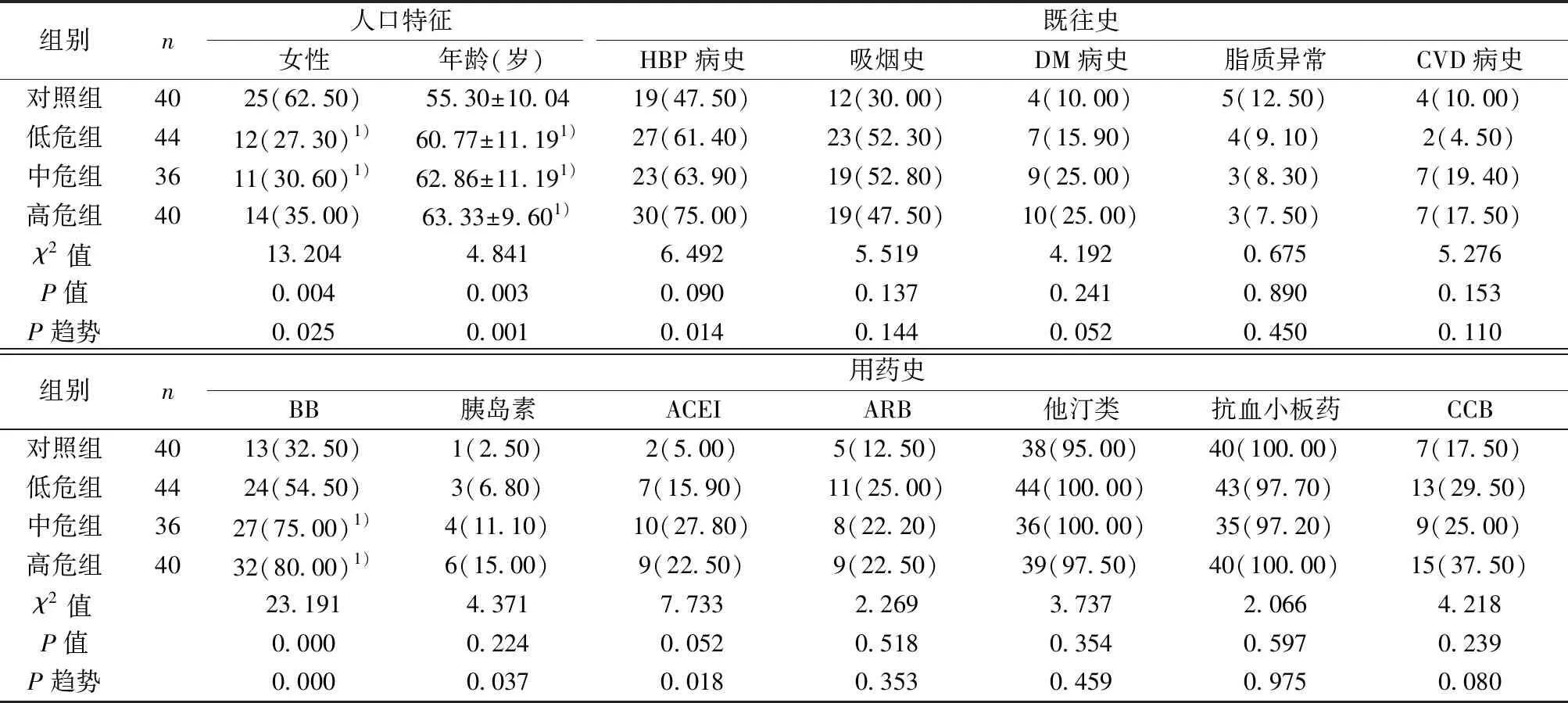
表1 各组一般资料比较〔n(%)〕
与对照组比较:1)P<0.05;ARB:血管紧张素受体拮抗剂,CCB:钙通道阻滞剂
2.2血生化指标比较 CAD高危组的SCr水平明显高于对照组(P<0.05),并随着冠状动脉病变严重程度的增加而上升。CAD组低危组和高危组的LDL-C水平均明显高于对照组(P<0.05),并随着冠状动脉病变严重程度的增加而上升(P<0.01)。CAD低、中、高危组的hs-CRP水平均明显高于对照组,中危组的hs-CRP水平明显高于低危组(P<0.05),并随着冠状动脉病变严重程度的增加而上升(P<0.001),CAD高危组和中危组的DPP-4水平均明显高于对照组、低危组,高危组的DPP-4水平明显高于中危组(P<0.05),并随着冠状动脉病变严重程度的增加而上升(P<0.001),见表2。
2.3hs-CRP、DPP-4水平影响冠状动脉病变程度的多重线性回归分析 未调整时,hs-CRP、DPP-4水平与SYNTAX 积分呈正相关(均P<0.001),调整年龄、性别、BB用药史、ACEI用药史、SCr、LDL-C因素后,hs-CRP、DPP-4与SYNTAX 积分仍呈正相关(P<0.001)。见表3。
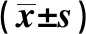
表2 各组血生化指标比较
与对照组比较:1)P<0.05;与低危组比较:2)P<0.05;与中危组比较:3)P<0.05
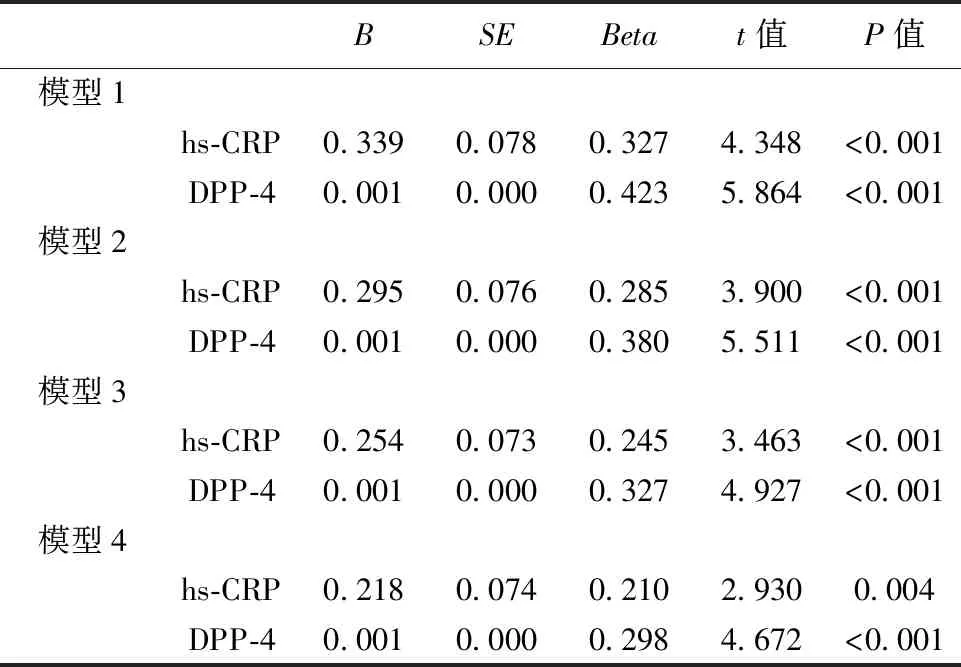
表3 hs-CRP,DPP-4水平冠状动脉病变程度的多重线性回归分析
模型1:未调整;模型2:调整年龄、性别;模型3:调整模型2+ACEI、BB用药史;模型4:hs-CRP:调整模型3+SCr、LDL-C、DPP-4;DPP-4:调整模型3+SC、LDL-C、hs-CRP
3 讨 论
目前,CAD的诊断方法主要为CAG检查及多排螺旋CT冠脉血管成像,其中CAG被公认为诊断CAD的“金标准”〔9〕,但因其为有创操作且价格昂贵限制了广泛应用。
研究表明,由炎性因子刺激肝脏和上皮细胞后合成的CRP与AS有关〔10~12〕。早期,在冠状动脉粥样硬化斑块新生内膜近中膜处可见大量CRP沉积〔13〕,这证明了CRP参与了AS的病理过程,并通过调节巨噬细胞摄取氧化LDL转化为泡沫细胞,刺激巨噬细胞产生血栓前组织因子,刺激内皮细胞分子表达,导致血管内皮功能异常,AS斑块变得不稳定,同时,通过调节炎症因子的表达和释放加速AS的进展。既往研究提示hs-CRP在心肌细胞损伤和心功能降低上发挥了重要作用〔14〕,表明了hs-CRP与心血管疾病之间存在相关性〔15,16〕,CRP具有抗炎和促炎的双重作用,可以和LDL一起沉积在血管壁上,通过补体激活途径促使炎症反应加剧、加速AS形成和CAD的发生〔17〕。
DPP-4抑制剂具有抑制炎症反应、抑制免疫细胞活化与增殖、抑制氧化应激、改善组织细胞器官纤维化的作用〔18〕,通过减少炎症细胞及氧自由基的产生,增加一氧化氮含量,从而发挥抗炎作用〔19〕。最近的AS实验模型研究也证实了DPP-4抑制剂能够减轻炎症反应〔20〕,一项横断面研究显示,血浆DPP-4水平升高与亚临床AS的高发生率有关〔21〕。近年来临床和实验室证据表明,DPP-4抑制剂通过抑制DPP-4介导的几种活性趋化因子和细胞因子的催化降解,刺激血管生成,有助于预防缺血性心血管损伤〔22,23〕。并且,血浆DPP-4在AS组织微血管内皮中表达可能会改变神经肽Y的表达,使其对血管生成受体(Y2R/Y5R)具有亲和力,从而增强血管生成和病变的易损性,在慢性应激过程中,血浆中DPP-4浓度提高,降低了脂肪细胞中的脂连蛋白的表达与产生,促进炎症反应和氧化应激的发生,进而导致了AS的发生发展,这同样论证了DPP-4抑制剂有减少AS的作用〔24~27〕。一项小型的前瞻性人群研究报道,血浆DPP-4水平升高可用于预测新发现的AS与中国人个体的炎症反应,DPP-4抑制剂通过胰高血糖素样肽-1依赖途径降低AS斑块中单核细胞趋化因子的能力来减少单核细胞进入AS斑块中和内脏脂肪中〔28〕,通过降低炎症反应,改善血管内皮功能障碍,动员多种组织干细胞的功能从而发挥抗AS及心血管保护作用〔6,29,30〕。本研究也证明,在冠心病各组中血浆DPP-4的水平升高明显,这可能与DPP-4可以通过炎症反应过程造成心血管损伤有关。并且,本研究证实,DPP-4水平与SYNTAX积分呈正相关,这同样论证了这一点。
本研究表明血浆 hs-CRP、DPP-4水平是CAD发生发展的独立预测因子,故血浆 hs-CRP、DPP-4水平有望成为评估CAD患者冠状动脉病变严重程的新的预测指标。本研究为单中心研究,入选人数较少,不能全面地反映真实的情况,所得的结果未来还需要多中心、大样本量的长期随访研究来进一步证明。

