HELLP 综合征合并可逆性后部白质脑病1例
王 昕,高玉东,张晓兰,顾向应,王 欣
(1.天津市红桥医院妇产科 300131;2.天津医科大学总医院妇产科 300052)
可逆性后部白质脑病(RPLS)[1]是一种近几年被提出的临床-放射学综合征,在产科好发于以妊娠期高血压为基础的子痫前期及子痫患者。以头痛、癫痫发作、视觉障碍、意识障碍及精神异常为主要临床表现[2],以影像学诊断为确诊依据。妊娠高血压综合征并发溶血、肝酶升高、血小板减少(HELLP)综合征是妊娠期高血压疾病的严重并发症,因RPLS发病原因复杂,临床表现多样,早期识别有助于防止其严重的后遗症。本文报道1例严重HELLP综合征并发RPLS的病例,旨在提高大家对此病的认识。
1 临床资料
患者,女,36岁,G4P1,主因停经37+5周,规律腹痛1+h入院。孕23+周查空腹血糖5.42 mmol/L,饮食控制后复查空腹血糖5.31 mmol/L,诊断妊娠期糖尿病。孕期无血压升高史。既往史:否认高血压,肾脏疾病及癫痫病史。入院前1 h出现规律宫缩,入院待产,总产程小于3 h,产后1 d出现上腹部不适,恶心呕吐,伴头晕头痛及视物不清。查体:体温36.1 ℃,心率108次/min,血压200/116 mm Hg,神志淡漠,嗜睡,双侧瞳孔等大等圆,对光反射敏感,颈软,无抵抗,四肢从属活动,肌力Ⅴ级,肌张力不高。辅助检查:心电图示窦性心动过速。心脏彩超左室舒张功能减低,三尖瓣反流Ⅰ度。泌尿系统彩超双肾、输尿管未见异常。上腹部彩超肝脏回声增粗,胰腺回声欠均匀。头颅CT可见右侧小脑,脑干区及两侧基底节-丘脑区可见片状低密度影,边界模糊,中线结构居中,脑室系统未见明显扩大,脑沟脑池未见明显增宽。头颅磁共振成像及弥散加权成像(DWI)提示脑干区及双侧基底节-丘脑区,双侧额顶叶及右枕叶可见多发斑片状稍长T1、T2信号影,边界欠清晰,抑水像呈高信号,DWI未见明显异常信号影,中线结构居中,脑室系统未见明显扩大,脑沟脑池未见明显增宽,垂体形态及信号未见异常,见图1。
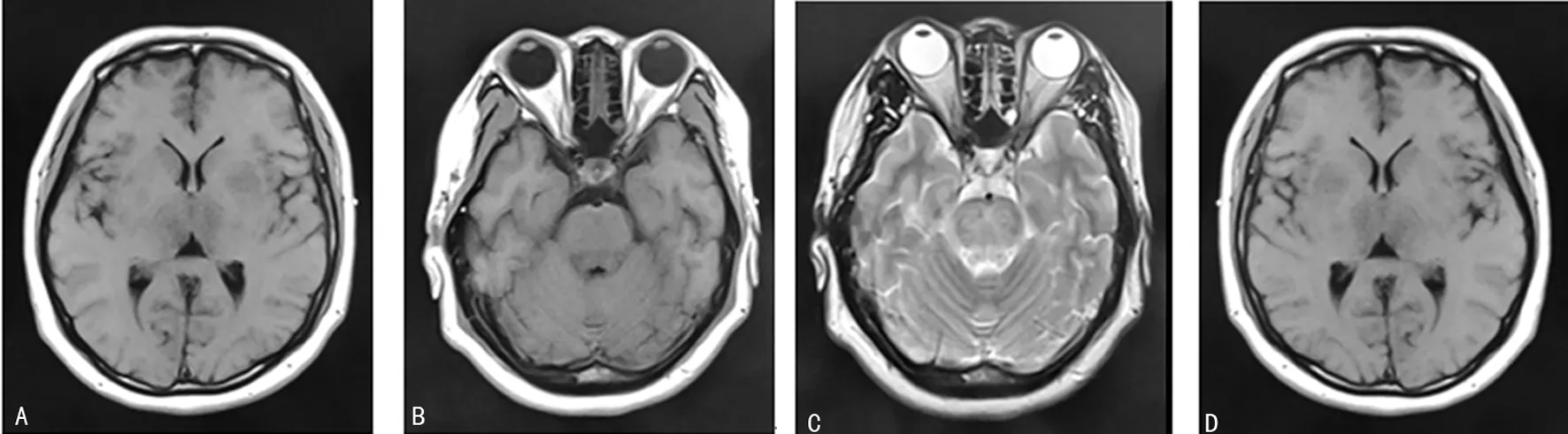
A:双侧基底节-丘脑区,额顶叶及右枕叶DW1呈像;B:双侧脑干区DW1呈像;C:双侧脑干区DW2呈像;D:双侧基底节-丘脑区,额顶叶及右枕叶DW2呈像
图1患者治疗第1天核磁检查结果
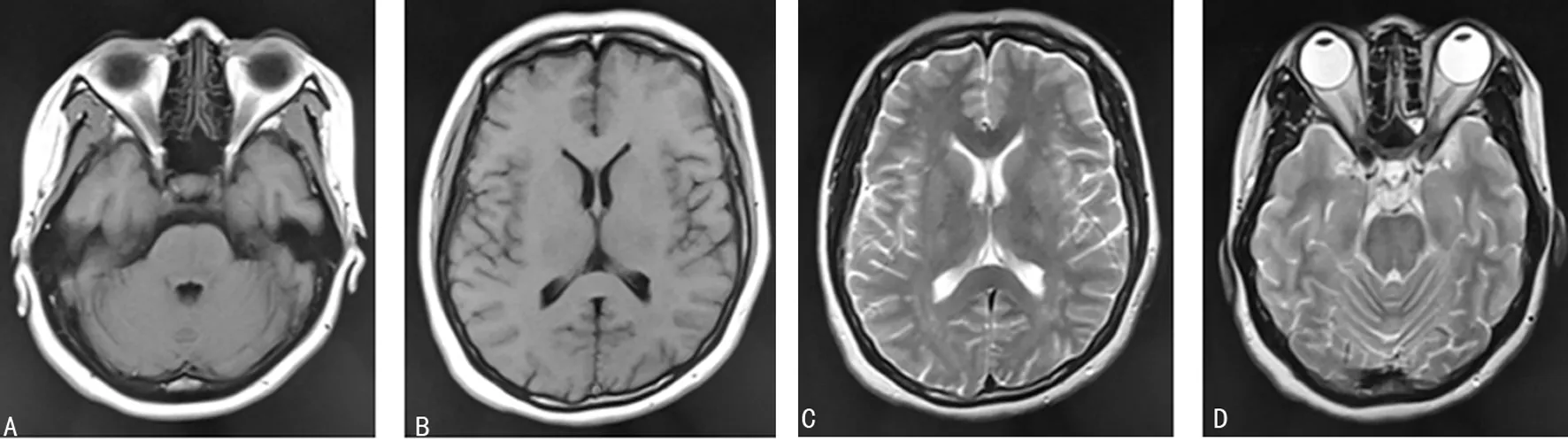
A:双侧脑干区DW1呈像;B:双侧基底节-丘脑区,额顶叶及右枕叶DW1呈像;C:双侧基底节-丘脑区,额顶叶及右枕叶DW2呈像;D:双侧脑干区DW2呈像
图2患者转入ICU治疗第6天核磁检查结果
转入ICU后给予解痉、镇静、控制血压、脱水降颅压、输注血浆、补充清蛋白及保肝治疗6 d后,症状好转,复查头颅磁共振成像及DWI提示原双侧基底节-丘脑区及右枕叶异常信号影基本消失(图2)。脑干区及双侧额顶叶多发斑片状稍长T1、T2信号影范围较前缩小,抑水像呈稍高信号,DWI未见明显异常信号影,出院后1个月随访,患者检查无异常。住院期间患者血常规及肝功能主要指标水平,见表1。
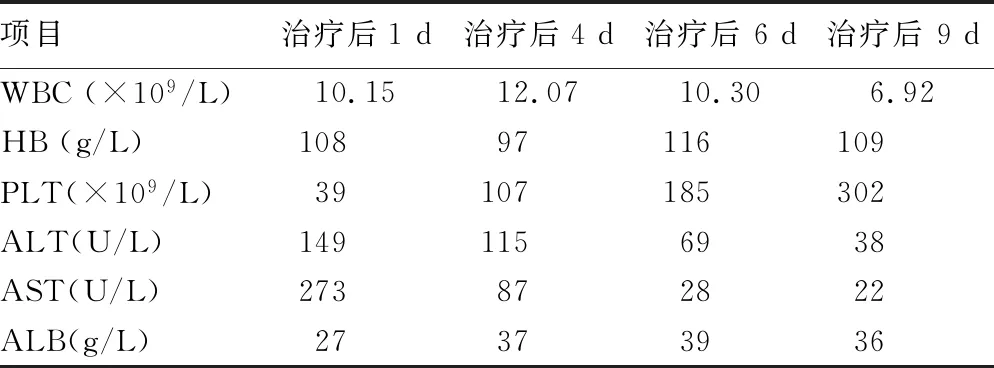
表1 住院期间患者血常规及肝功能主要指标变化
WBC:白细胞计数;HB:血红蛋白;PLT:血小板计数;ALT:丙氨酸氨基转移酶;AST:天门冬氨酸氨基转酶;ALB:清蛋白
2 讨 论
RPLS是HINCHEY在1996年命名,其病因复杂,文献报道发病率为0.01%[3],好发于孕妇,尤其是子痫前期或子痫孕妇。其他可见于高血压脑病,应用免疫抑制剂或细胞毒性药物等。而HELLP 综合征是以溶血、肝酶升高、血小板减少为特点的疾病,常见的并发症有弥散性血管内凝血(DIC),急性肾功能衰竭和胎盘早剥;其次有严重的腹水、肺水肿、脑水肿,以及比较少见的肝包膜下血肿和视网膜脱落、脑出血、胰腺和结肠脓肿[4]。
这两种疾病发病机制尚不完全明确。目前大多数学者认为,RPLS发病机制主要包括:(1)血管内皮细胞受损学说。自身免疫性疾病、免疫抑制剂及化疗药物的使用、代谢紊乱等因素均引起人体内环境变化,激活免疫系统,通过细胞免疫导致内皮细胞损伤,进而引起血管源性水肿,导致器官功能障碍。此学说为RPLS发病的主要因素。STAYKOV等[5]研究发现,子痫患者脑水肿程度与血压无明显相关性,与血管内皮受损直接相关。而最新的研究表明,血管紧张素1型受体拮抗剂通过激活肿瘤坏死因子-α(TNF-α)和内皮素-1(ET-1),从而诱导妊娠期毛细血管内皮细胞和肝脏损伤[6]。(2)脑血管痉挛学说。由于血压的急骤上升导致血管收缩,脑组织及血管内皮细胞处于低氧状态,进而激活内皮细胞释放生长因子,刺激血管再生及增加血管通透性,造成血管源性水肿。LI等[7]研究表明,高血压引起的血管收缩可能是血管源性水肿发展的主要机制,血管收缩可能有助于RPLS缺血的发展。(3)脑血管过度灌注学说。血压急骤上升破坏了脑血管自动调节机制,导致小动脉扩张,急剧升高的血压及血管过度灌注引起内皮细胞破坏,引起血管源性水肿[8]。
以上3种学说均以血管内皮受损为中心环节,而关于HELLP综合征可能机制占主流地位的学说亦为血管内皮受损学说,因此考虑这两种疾病为血管内皮受损在靶器官及全身循环系统的不同表现。该例HELLP并发RLPS推测为产后受哺乳,睡眠欠佳,精神刺激联合作用下血压骤升超过血管调节能力引起代谢紊乱,血管内皮受损,发生血管源性水肿,患者以头痛、视觉障碍及意识障碍为主要表现。在产科,对于妊娠期高血压患者出现头痛、精神异常、视力障碍经常需与脑血管疾患进行鉴别。头颅磁共振成像是可靠的检查手段。RPLS在影像学表现主要累计后部脑白质,常见的部位为顶,枕叶皮质下白质,脑干,基底节和额叶也可累及,CT表现为低密度灶,核磁检查提示T1低信号,T2液体衰减反转恢复序列(FLAIR)呈高信号,DWI及表观弥散系数(ADC)为高信号[9]。经过有效的治疗1~2周后,RPLS临床与影像学表现明显改善或者完全恢复。
RPLS与HELLP综合征的治疗关键是去除病因[10-11],早诊断、早治疗预后良好,若治疗延误,可能导致血管源性水肿向细胞源性水肿转变,引起不可逆性变化[12]。最新研究表明,ALB、AST和ALT水平是RPLS水肿发展的潜在预测因子。ALB与血管源性水肿密切相关,AST、ALT与细胞毒性水肿密切相关[13]。本病例在短时间之内将血压降至正常,通过补充清蛋白纠正低蛋白血症,脱水降颅压减轻了脑血管负荷,使AST及ALT在短时间内降至正常,避免了脑细胞受损。此外,针对HELLP综合征予以综合对症治疗,如保肝、输血、激素等治疗后,对患者预后有益。

