重组人表皮生长因子在毕赤酵母中的表达与纯化及其复合可溶性微针的制备
熊振宇,李晓瑾,李志鹏
天津科技大学 生物工程学院,天津300457
表皮生长因子(epidermal growth factor,EGF)是一类普遍存在于人类多种腺体及体液中且具备生物活性的多肽,参与调节机体多种细胞的增殖、迁移、分化等重要的生物学过程[1]。EGF 最初由美国Vanderbilt 大学医学系Cohen 教授用羧甲基纤维素柱从小鼠颌下腺分离纯化神经生长因子(NGF)时发现[2]。1975 年,Starkey 等[3]从人尿中提取出人表皮生长因子(hEGF),由于其可抑制胃酸分泌,又称抑胃素。EGF 由53 个氨基酸残基组成,其中含有6 个半胱氨酸(Cys)残基,Cys 残基之间形成3 个稳定的二硫键,使整条肽链成为具有三内环形结构的活性物质。在过去30 年中,有关EGF 及EGF 受体(EGFR)的研究揭示了EGF 控制细胞正常生长和伤口愈合的分子机理[4]。EGF 具有多种生物功能,如作为强有力的广谱细胞促分裂因子可以促进角质细胞的增殖和迁移[5-6],加快物质转运和糖代谢,同时对外科手术切口和眼角膜创伤愈合具有促进作用[7]。
EGF 有着广泛的应用前景,但天然的EGF 获得渠道却十分有限,由于产量问题的制约无法满足临床和实践的需求[8]。随着基因工程技术的发展与完善,可以利用该技术制备高产量、高活性的EGF。大肠杆菌、酵母等是目前应用最为广泛的宿主菌。但由于EGF 在大肠杆菌中表达多以包涵体的形式存在[9],而在酵母表达系统中不存在此问题,且巴斯德毕赤酵母(Pichia pastoris)表达系统是目前应用最为广泛的外源蛋白表达系统之一[10]。在此,我们构建了表达重组hEGF(rhEGF)-His 融合蛋白的毕赤酵母工程菌,以期高效获得高纯度的EGF,用于研究和应用。
微针(microneedle,MN)阵列作为1976 年提出的新剂型[11],已有40 多年发展历史,而可生物降解的聚合物微针是微针技术发展的一个方向,可以提高微针的安全性。高分子可溶性微针用水溶性高分子材料制备而成,能够在针体中包覆药物进入皮下,部分或完全溶解并释放药物[12]。其优点为原料来源广泛,制备方法相对简单,适于产业化生产等,从而增加了给药方面的优势。大分子和小分子化合物都可以作为微针的负载物。其中,大分子化合物主要用于疾病预防[13]和糖尿病的治疗[14],而小分子化合物已广泛用于治疗、诊断、美容等[15]。透明质酸(hyaluronic acid,HA)是一种良好的透皮吸收剂[16],我们以小分子透明质酸为基质制备了携带rhEGF 的可溶性微针,解决了rhEGF 分子过大,无法有效透皮吸收的问题,同时对微针造成的微小创口有较好的修复作用。
1 材料与方法
1.1 材料
大肠杆菌Top10、毕赤酵母X33-rhEGF-His 基因工程菌、表达质粒pPICZαA 均由本实验室构建并保存;PfuDNA 聚合酶、T4DNA 连接酶、TaqDNA 聚合酶、限制性内切酶XhoⅠ和NotⅠ、DNA marker、蛋白预染marker、博来霉素为Thermo 公司产品;PCR 产物纯化试剂盒、DNA 胶回收试剂盒、质粒DNA 小量抽提试剂盒、酵母浸出物、胰蛋白胨、硫酸铵、聚乙烯醇、羧甲基纤维素钠、乙基纤维素钠、PVP K30、PEG400、角鲨烷购自上海生工生物工程有限公司;Ni-beads 为GE 公司产品;10 kD 透明质酸钠、甘油、无水乙醇购自北京索莱宝科技有限公司;引物合成和基因测序由北京金唯智公司完成。
1.2 pPICZαA-hEGF-His 表达载体的构建
查阅文献设计hEGF-His基因,在两端加入XhoⅠ、NotⅠ酶切位点,经化学合成获得,连接到pUC57 载体上,然后用XhoⅠ、NotⅠ双酶切目的基因片段及载体pPICZαA,37℃水浴2 h,用胶回收试剂盒回收正确条带后,将目的基因与空载体混合并用T4DNA 连接酶于16℃恒温过夜连接,而后将其转化大肠杆菌Top10,提取质粒进行双酶切验证及基因测序。
1.3 构建毕赤酵母X33-pPICZαA-hEGF-His 表达工程菌与抗性筛选
取测序结果正确的重组质粒pPICZαA-hEGF-His 用限制性内切酶SacⅠ线性化,同时制备毕赤酵母感受态细胞,电转重组质粒到毕赤酵母X33 中,并将其涂在不同博来霉素浓度的YPD平板上,挑选单克隆提取基因组,以基因组为模板,采用AOX1-F(5'-GACTGGTTCCAATTGACAA GC-3')和AOX1-R(5'-GCAAATGGCATTCTGACA TCC-3')双引物进行PCR 扩增(反应条件:95℃预变性5 min;95℃变性30 s,55℃退火30 s,72℃延伸2 min 30 s,30 个循环;72℃终延伸10 min)验证阳性菌株。对扩增的产物进行0.8%琼脂糖凝胶电泳分析,观察是否能够得到预期大小的基因片段,分析基因是否整合到酵母基因组中。将验证正确的菌株进行小量表达,筛选高表达菌种。
1.4 甲醇诱导表达rhEGF-His 蛋白
选择筛选出的高表达菌株接种至YPD 培养基进行活化,后接种于BMGY 培养基中生长至菌液D600nm值 为4~6,更换至BMMY培养基中进行EGF 的诱导表达,在甲醇诱导下连续培养5 d,每隔12 h 补加0.5%的甲醇且每24 h 取样,对样品进行SDS-PAGE 检测,用银染法和Western 印迹分析目的蛋白。
1.5 rhEGF-His 的纯化
对筛选出的菌株进行摇瓶发酵培养,用甲醇诱导120 h 后收集发酵液离心取上清。选择合适的硫酸铵盐析浓度,对收集到的蛋白进行沉淀和浓缩。将初步处理过的蛋白与Ni-beads 孵育结合,后用咪唑洗脱。
1.6 制备可溶性微针防水背衬层
考虑其柔韧性、溶解性、厚度等方面,综合得出最优的背衬层配方为膜材料聚乙烯醇0.800 g,增稠剂羧甲基纤维素钠0.400 g,增塑剂甘油0.800 g,水10 mL。80℃恒温搅拌,待完全溶解混匀后保温静置5 min 去除部分气泡,3000 r/min 离心4~10 min,完全去除气泡后倾倒于75 mm 的玻璃平板上,放置到50℃烘箱中干燥2 h。
选择疏水性物质乙基纤维素为主要防水成分,用乙醇做溶剂配制浓度为10%的乙基纤维素溶液(10 mL 无水乙醇,1 g 乙基纤维素,共10 mL)倒于培养皿盖内,放置于烘箱中至膜干燥成形(大约1 h)。
1.7 微针层的制备及检测
使用对人体无副作用的EGF 和透明质酸浓度,即10 kD 透明质酸钠浓度10 mg/mL,EGF 浓度为10 mg/L。以EGF 和透明质酸为主要成分,水为溶剂配制针尖溶液。通过对比筛选实验,确定针体溶液由0.15 g PVP K30、40 μL PEG400、0.01 g 角鲨烷和500 μL 无菌水配制而成。采用真空填充或浸润填充(即将模板置于水溶液中超声高速离心)的方法,使溶液充分地对模具进行填充,将适量的针尖溶液(约30 μL)加入模具表面,水平放置干燥10 min 后加入120 μL 针体溶液,后用注射器进行简易加压操作,20℃干燥24 h。将制备好的微针贴片分别置于4℃冰箱、-20℃冰箱和常温(天津市滨海新区,20℃)下,观察微针形态变化。
通过对比微针对保鲜膜和猪皮的穿透性,检测微针整体塑性是否达到给药预期要求。将制备完成的微针以人体正常力度按压在保鲜膜上,静置2 min 后撕下。与此同时进行更深一步的塑性实验,将制备好的微针用正常力度按压贴于去毛后经生理盐水活化30 min 后的猪皮上,静置2 min 后撕下,并对猪皮进行台盼蓝染色。
为了验证EGF-His 透明质酸可溶性微针是否能够起到帮助伤口愈合的作用,我们采用4 只5周SD 大鼠进行创伤实验。对4 只大鼠背部进行脱毛处理后,用手术刀划出1 cm 长、1 mm 深的十字形伤口,止血消毒后将4 只大鼠分为2 组,实验组伤口处敷有EGF-His 微针贴片,24 h 定期更换,对照组定期消毒。观察大鼠背部伤口愈合情况和伤疤存留情况。待伤口愈合后对背部皮肤组织进行石蜡切片和HE 染色。
2 结果
2.1 pPICZαA-hEGF-His 表达载体的构建
将合成的EGF-His基因序列插入pPICZαA 空载体之后,转化大肠杆菌TOP10,提取质粒并用XhoⅠ/NotⅠ做双酶切验证,经琼脂糖凝胶电泳分析,结果显示酶切获得的目的DNA 条带大小与预期EGF-His基因大小一致,即218 bp(图1)。将重组质粒测序结果与目的基因进行序列比对,结果完全一致,表明重组质粒pPICZαA-hEGF-His构建成功。
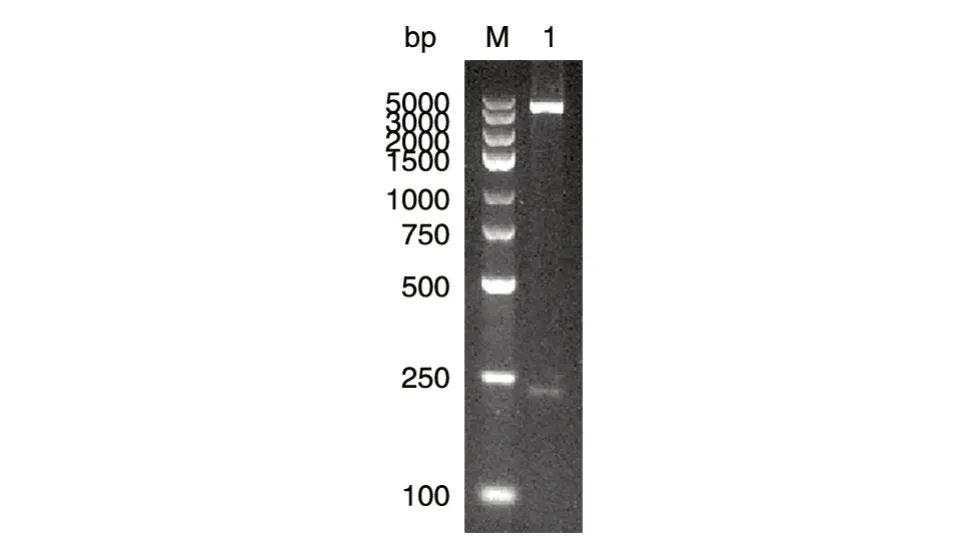
图1 重组质粒pPICZαA-hEGF-His 的双酶切验证
2.2 pPICZαA-hEGF-His 毕赤酵母X33 表达工程菌的构建与筛选
将构建的重组质粒pPICZαA-hEGF-His 电转化毕赤酵母X33,挑选单克隆并提取基因组,然后以此为模板用AOX1 通用引物进行PCR 扩增,琼脂糖凝胶电泳分析。结果表明,与阴性对照相比,所挑选的转化子均有目的DNA 条带,且大小与预期一致(图2A),即721 bp,说明所挑选的4株单克隆均转入了重组质粒pPICZαA-hEGFHis,且整合到了酵母基因组上。
将所挑选的4 株阳性单克隆分别进行小量表达,分别取120 h 时发酵样经SDS-PAGE 分析。与阴性对照相比,4 株菌株均分泌表达了目的产物,大小与预期一致,相对分子质量约6.5×103(图2B),且4 号菌株的表达量明显高于其他3 株。实验结果表明所挑选的4 株阳性单克隆均能够分泌表达目的产物,其中的4 号菌株表达量最高,将作为后续实验的高产菌种。
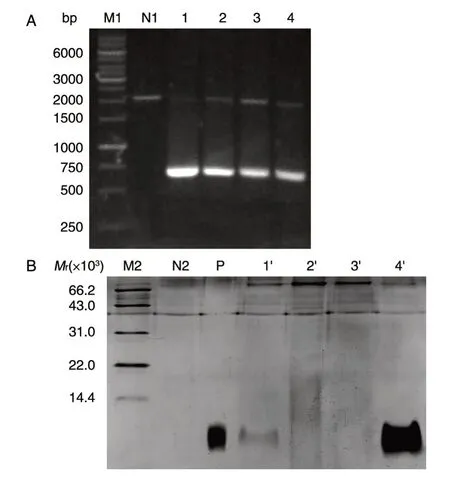
图2 pPICZαA-hEGF-His 毕赤酵母X33 工程菌的构建及筛选
2.3 重组蛋白EGF-His 在毕赤酵母X33 中的诱导表达及验证
对筛选出的高产菌株诱导表达5 d,每天定时取上清样1 次,经SDS-PAGE 并用银离子染色分析。与对照相比,发酵液中目的蛋白EGF-His含量随着发酵时间的延长而增加,且第5 d 达到最高表达量(图3A)。用Western 印迹检测表达过程取样中目的蛋白含量的变化情况,结果显示,目的蛋白含量随诱导时间的延长而增加,与银染结果一致(图3B),通过His 抗体检测也验证了所表达产物为EGF-His。

图3 hEGF-His 在毕赤酵母X33 中的诱导表达和Western 印迹验证
2.4 重组蛋白EGF-His 的纯化
将发酵5 d 的发酵液离心,取上清液用90%的硫酸铵进行沉淀,将得到的蛋白沉淀用PBS 复溶,然后与Ni-beads 孵育。结果表明,在500 mmol/L 咪唑浓度下洗脱出目的蛋白,而在1 mol/L咪唑浓度时洗脱蛋白较少(图4)。根据蛋白银染结果,除洗脱获得的目的蛋白EGF-His 外,看不到其他杂蛋白条带,表明获得纯度较高的重组蛋白EGF-His。

图4 重组蛋白EGF-His 的纯化
2.5 EGF-His 蛋白可溶性微针的制备及物理性能检测
制备微针防水层和背衬层溶液的干燥时间视倾注溶液体积而定,10 mL 干燥2 h,15 mL 干燥4 h,以此类推。干燥后剥离取出,防水层是塑料质感的透明薄片,背衬层是柔软亲肤的透明薄片。依次配置防水层、背衬层,二者有着良好的结合效果。

图5 EGF-透明质酸可溶性微针的制备和物理性能检测
为使EGF 富集于针尖部分,使药物更好地进入皮下,减少药物的损失,透明质酸可溶性微针采用分段配制微针的方法,保证EGF 的最大化利用。选用的微针基质PVP K300 具有较大的粘性,轻轻按压撕下便可得到结合于背衬层上的具有完整矩阵的微针。显微镜下观察针型,由图可见针型尖锐锋利,排列有序(图5A),表明微针制备完好,可供后续实验使用。
保鲜膜穿透预实验证明微针硬度较好,可穿透保鲜膜使其具有整齐排列的针孔。在猪皮穿透实验中,观察贴后的微针针型,发现针尖有效成分已溶解(图5B)。在染色的猪皮上可明显观察到排列整齐的蓝色针孔(图5C),说明微针针尖具有一定的穿刺性和溶解性良好。由于可溶性微针含有小分子透明质酸成分,有助于填补微针的在皮肤上留下的针孔及对皮下起到一定的补水作用,同时角鲨烷也能进一步保湿滋润抗氧化,促进有效成分的透皮吸收。微针穿刺2 min后,猪皮的针孔就可以逐渐愈合(图5D)。
通过对微针保存条件的实验研究,我们发现-20℃保存条件下微针针型消失(图5E),而4℃(图5F)和室温(图5G)的保存环境对微针针型无明显影响,且穿刺性能良好。由于EGF 在室温条件下容易失活,而-20℃虽然保证了EGF 的活性但穿刺性显著下降,所以4℃保存是微针最适合的保存条件。
2.6 EGF-His 蛋白可溶性微针的生物学活性检测
自大鼠创伤手术后,我们对其伤口进行了10 d 贴片治疗和观察。手术24 h 后,实验组SD大鼠的伤口已经开始逐渐愈合,对照组大鼠伤口处凝有血块,颜色暗沉疑似中途有过再次出血;观察6 d 后,实验组SD 大鼠伤口完全结痂脱落,仅留有轻微疤痕,背部毛发重新生长,而对照组大鼠伤口仍未完全愈合,伤痂并未脱落完全。饲养第10 d 时对照组伤口才完全愈合,但留有较明显的伤痕,周围新生毛发已经重新长出;而第10 d 实验组大鼠背部的伤痕已经完全消失,未发现其他后遗症状(图6A)。将4 只SD 大鼠处死,进行背部皮肤组织切片和HE 染色。淡粉红色物质为胶原纤维,而亮粉红色为弹力纤维,对比2 组的染色结果(图6B),发现实验鼠组织纤维情况较对照鼠更好,纤维状况也更加致密。

图6 SD 大鼠背部皮肤创伤愈合实验
3 讨论
基因工程技术已成为一种高效的制备天然蛋白质的技术手段。在原核表达系统中外源基因的表达得到了最早的应用,其中大肠杆菌表达系统应用最早、最为广泛,但也存在适用范围有限、蛋白纯化难度高、产物多为包涵体形式的局限。相比于大肠杆菌,酵母表达系统为真核表达系统,所表达的人源蛋白均具有更好的生物活性,并且可以进行高密度发酵培养,更加适用于工业化生产。本研究采用甲醇营养型表达系统的巴斯德毕赤酵母表达EGF-His 蛋白,甲醇不仅可以诱导毕赤酵母表达目的蛋白,而且可以作为毕赤酵母生长的碳源和能源,降低了污染风险,也不产生内毒素等有害和致病性物质。在纯化过程中用硫酸铵沉淀蛋白进行浓缩,而后利用亲和层析技术进一步纯化。我们设计在目的蛋白后添加了His 标签,这就使得可以通过Ni-beads进行发酵产物的纯化,从而可以比较简便地获得高纯度的EGF-His 蛋白。据报道,6×His 标签一般不影响蛋白的分泌、定位和折叠[17]。
由于EGF 蛋白透皮率较低[18],使EGF 的应用受到了极大的限制。因此,以可溶性微针为载体,可以促进EGF 的透皮吸收,增加其应用价值。由于EGF 蛋白在常温使用时存在稳定性差、易降解等缺点,我们加入了PVP[19]和透明质酸[16]来保持微针中EGF 的生物活性。研究采用浇铸法,以EGF 和透明质酸为活性成分、PVP K300 为微针材料、PVA 为背衬材料,分层制备了可溶性的EGF 微针贴片。经过筛选优化,确定了合适的微针层处方和背衬层处方,且在其中加入吸湿性物质,使其可以保持干燥以免受潮变形,便于保存。在制备过程中,我们发现须先配置防水层,待防水层干燥后将配好的背衬层溶液倾倒于上述培养皿内(防水层溶液可比背衬层少,尽量做到防水层占总防水背衬层厚度的三分之一以下),水平置于烘箱内干燥。待膜成形后,从培养皿内剥离,可方便地获得一面可防水的背衬层。
我们制备的EGF-可溶性微针贴片具有良好的穿刺性、可溶性及生物学活性,且操作简单,易于保存,为后期大规模生产奠定了良好的基础。

