电针抑制大鼠脊髓损伤后小胶质细胞活化介导炎症的机制研究
范筱,刘宇,郑鹏,张英羽
(1.青岛市市立医院,青岛 266011;2.福建中医药大学,福州 350122;3.青岛市西海岸新区中医医院,青岛266500)
脊髓损伤(spinal cord injury, SCI)是医学领域的世界性难题,其病理过程主要包括原发性脊髓损伤阶段和继发性脊髓损伤阶段[1]。炎症在 SCI 的病理反应中扮演重要角色。持续高水平炎症导致损伤处组织发生炎性浸润、血管通透性改变、损伤区域扩大、血小板凝集能力改变等引起组织水肿、缺血、细胞坏死和凋亡等不利于损伤修复的结果。小胶质细胞(microglia, MG)是神经系统固有免疫细胞,被认为是损伤后炎症的发动者和调控者。在生理状态下,MG 处于静止状态[2],对神经系统有重要的支持和营养作用。一旦损伤发生,受损组织和细胞会释放大量三磷酸腺苷(adenosine triphosphate, ATP)。ATP 作为 MG 的天然激动剂,可使MG 活化而发生极化,MG 的形态及功能发生改变而参与介导炎症。随着损伤持续和加剧,MG被过度激化,引起白细胞介素 1β(Interleukin-1β,IL-1β)和白细胞介素 18(Interleukin-18, IL-18)等大量炎性因子释放,高浓度的炎性因子进一步加重损伤,形成恶性循环[3]。临床实践中,电针已广泛应用于治疗脊髓损伤,对脊髓损伤引起的运动功能障碍、感觉功能障碍以及尿潴留等并发症均具有良好的治疗效果,可有效缓解SCI 后出现的中枢性疼痛、肠道功能障碍以及肌肉痉挛等情况[4];并且电针可有效降低SCI大鼠脊髓损伤处促炎性因子表达水平,抑制炎症[5]。但是,电针抑制SCI 后炎症的深入作用机制尚不明确。本研究旨在研究电针是否通过抑制 MG 活化介导的炎症而有利于 SCI 后神经元修复,进一步明确电针治疗 SCI的作用机制,为其临床应用提供理论依据和基础。
1 材料与方法
1.1 实验动物及分组
36 只 2 月龄 SPF 级 Sprague-Dawley 大鼠(雌雄各半),体重(220±20)g,购于上海斯莱克实验动物责任有限公司,许可证号[SCXK(沪)2014-0006],饲养于福建中医药大学实验动物中心。实验过程及方法符合福建中医药大学实验动物伦理委员会要求。采用随机数字表法将上述大鼠随机分为假手术组、模型组和电针组,每组12 只。
1.2 主要试剂及仪器
一抗,山羊抗 IBA-1 抗体(Abcam,美国)、小鼠抗ED-1 抗体(Abcam,美国)、兔抗 Caspase1(p20)抗体;二抗,驴抗山羊 Alexa Fluor 568 荧光二抗(Thermo Fisher,美国),驴抗小鼠 Alexa Fluor 488 荧光二抗(Thermo Fisher,美国);DAPI 染色液(博士德,武汉);尼氏染色液(索莱宝,北京);Triton-100(Sigma,美国);IL-1βElisa 试剂盒、IL-18 Elisa 试剂盒(西塘生物,上海)。
不锈钢毫针(0.30 mm×25 mm,苏州医疗用品厂有限公司);电针仪(G6805,苏州医疗用品厂有限公司);NYU 脊髓打击器(W.M.Keck 神经科学协作中心,美国);荧光显微镜(Leica DMI 4000B/DFC425C,德国);Imagelab、Image-Pro 图像分析系统(BIORADHERCULES,美国)。
1.3 制备脊髓损伤模型
根据参考文献[6]制备SCI 模型。具体操作为,将7%水合氯醛腹腔注射,注射剂量为5 mL/kg;麻醉成功后,将大鼠背部 T9-11部位备皮,消毒;沿背部 T9-11部位中线作长约 3 cm 切口,去除棘突及横突两侧附着的肌肉,咬骨钳去除椎板,暴露脊髓;调整 NYU 打击器,保证打击杆对准脊髓,固定大鼠,释放打击杆,使质量为 10 g的打击杆自12.5 mm 高度自由下落,撞击脊髓,见大鼠后肢回缩抽搐及尾部痉挛性摆动则提示造模成功;冲洗伤口,逐层缝合。大鼠术后单笼饲养,注意保暖,每日人工按摩膀胱2 次。
1.4 各组大鼠处理方法
电针组和模型组采用上述方法制备SCI 模型。电针组大鼠自术后第 1 天开始给予电针干预,取穴为脊髓损伤节段上下两对夹脊穴[7],具体定位参考《实验针灸学》[8]。进针角度均为斜刺,深度约为 2 mm;使用 2根电线,1 号出口线正负极分别连接左侧上下夹脊穴,2 号出口线正负极分别连接右侧上下夹脊穴;电针仪参数为连续波,频率为 2 Hz,电流强度为 1~3 mA,以大鼠安静耐受、后肢及针体轻轻抖动为宜,每日 1次,每次 20 min。假手术组和模型组每日同一时间同等条件下抓取20 min 后回笼饲养,不予任何治疗。
1.5 取材
干预3 d 后进行取材。麻醉成功后,每只大鼠采集静脉血;每组6 只大鼠采用4%多聚甲醛灌注固定,取损伤处脊髓段约 2 cm,放入 4%多聚甲醛固定 48 h;另 6只大鼠采用直接取材,取损伤处脊髓段约 2 cm,-80℃保存备用。
1.6 检测方法
1.6.1 尼氏染色
将5 μm 厚石蜡组织切片采用梯度乙醇依次复温,放入二甲苯溶液中脱蜡,梯度乙醇浸泡至水,将切片浸入尼氏染色液在60℃温箱中染色50 min,磷酸盐缓冲液漂洗 3 次,分色液分色 2 min,晾干,中性树胶封片,镜下观察并拍片。
1.6.2 Elisa 检测
将采集的大鼠静脉血离心后,取血清,按照 Elisa试剂盒说明进行操作,主要步骤依次为加样,洗板,加入一抗工作液并反应20 min,洗板,加入酶标抗体工作液,洗板,加入底物工作液,加入终止液,酶标仪450 nm检测吸光度值,依次检测大鼠静脉血清中 IL-1β和IL-18 含量。
1.6.3 免疫荧光染色
将5 μm 厚石蜡组织切片采用梯度乙醇依次复温,放入二甲苯溶液中脱蜡,梯度乙醇浸泡,漂洗后用枸橼酸盐缓冲液高压修复,血清封闭1 h,甩掉封闭液不洗,滴加 IBA-1 一抗(1:200)和 ED-1 一抗(1:200)混合液4℃过夜;次日复温后,磷酸盐缓冲溶液漂洗,避光滴加Alexa Fluor 568(1:200)和 Alexa Fluor 488 (1:200)荧光二抗混合液,室温孵育2 h,磷酸盐缓冲溶液漂洗,避光滴加DAPI 染色液,室温孵育3 min,磷酸盐缓冲漂洗,抗荧光淬灭封片剂封片,激光共聚焦扫描显微镜观察并拍片。
1.6.4 Western Blot
将保存备用的脊髓组织加入裂解液,冰浴60 min。提取组织中的蛋白质,离心后 BCA 法定量蛋白,100℃加热5 min 使蛋白质变性。蛋白变性后,将样品于相应浓度的SDS-PAGE 凝胶电泳分离,电压为80 V 持续20 min,调整电压为120 V 持续90 min。转膜,封闭,加入Caspase1(p20) 一 抗 (1:1000)4 ℃ 过 夜 ,加 入 二 抗(1:1000)孵育 2 h。漂洗掉二抗后开始显影。将膜置于化学发光试剂中反应 1 min,在避光条件下显影,凝胶扫描成像系统进行分析。
1.7 统计学方法
采用SPSS18.0 软件进行统计分析。符合正态分布的计量资料以均数±标准差表示,采用t检验;计数资料采用卡方检验。以P<0.05 表示差异有统计学意义。
2 结果
2.1 电针对神经元形态的影响
假手术组神经元形态规则,结构完整,细胞内可见丰富的虎斑样尼氏体;模型组神经元形态不规则,部分神经元水肿明显,可见神经元溶解、液化后形成的空泡样结构,尼氏体碎裂;电针组神经元形态较模型组改善,虽然可见少量神经元水肿以及空泡样结构形成,但程度较模型组轻,尼氏体较饱满。详见图1。
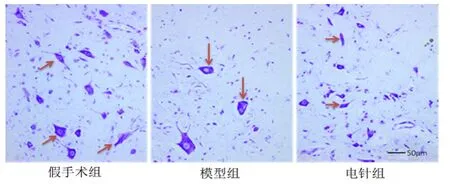
图1 各组神经元形态(×200)
2.2 电针对炎性因子表达的影响
Elisa 结果见表 1,假手术组血清中炎性因子IL-1β和 IL-18 含量较低,模型组血清中 IL-1β和IL-18 含量较高;与假手术组相比,模型组和电针组血清中IL-1β和IL-18 含量显著增高,差异具有统计学意义(P<0.01);与模型组比较,电针组血清中 IL-1β和IL-18 含量显著降低,差异具有统计学意义(P<0.01)。
表1 各组血清中lL-1β和lL-18 含量比较 (±s,pg/mL)

表1 各组血清中lL-1β和lL-18 含量比较 (±s,pg/mL)
注:与假手术组比较1)P<0.01;与模型组比较2)P<0.01
组别n IL-1β IL-18假手术组 6 2.26±0.18 1.74±0.21模型组 6 29.88±0.751) 19.39±0.971)电针组 6 14.37±0.561)2) 12.76±0.631)2)
2.3 电针对MG 活化的影响
由图2 可见,IBA-1 阳性细胞呈红色,为小胶质细胞;ED-1 阳性细胞呈绿色,为被激活的小胶质/巨噬细胞;IBA1/ED1 双阳性细胞呈黄色,为活化的小胶质细胞。阳性反应细胞均呈树桠状,散在分布于脊髓中。

图2 各组lBA1/ED1 双阳性细胞表达情况
由表 2 可见,与假手术组比较,模型组和电针组IBA1/ED1 双阳性细胞数显著增多,差异有统计学意义(P<0.01);与模型组比较,电针组IBA1/ED1 双阳性细胞数显著增多,差异有统计学意义(P<0.01)。
表2 3组免疫荧光阳性细胞计数比较 (±s)

表2 3组免疫荧光阳性细胞计数比较 (±s)
注:与假手术组比较1)P<0.01;与模型组比较2)P<0.01
组别n IBA1/ED1假手术组 6 2.83±0.83模型组 6 14.83±2.241)电针组 6 9.50±1.381)2)
2.4 电针对 cleaved-Caspase1(p20)蛋白表达的影响
由图3 可见,假手术组cleaved-Caspase1(p20)蛋白表达量较低,模型组p20 蛋白表达量较高。

图3 各组Caspase1(p20)蛋白表达情况
表3 各组cleaved-Caspase1(p20)蛋白相对表达量比较(±s)
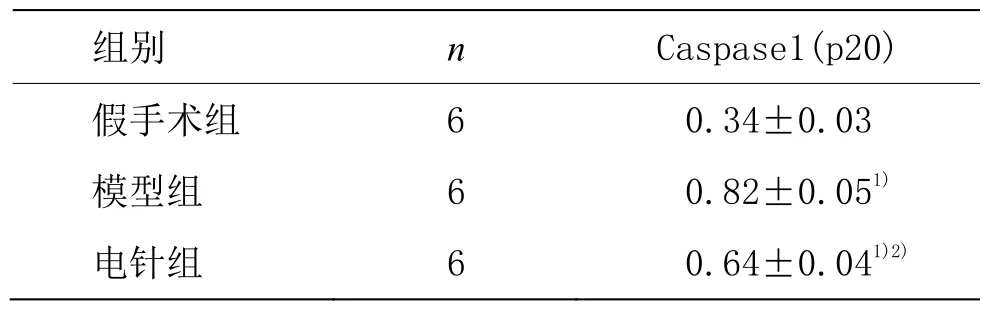
表3 各组cleaved-Caspase1(p20)蛋白相对表达量比较(±s)
注:与假手术组比较1)P<0.01;与模型组比较2)P<0.01
组别n Caspase1(p20)假手术组 6 0.34±0.03模型组 6 0.82±0.051)电针组 6 0.64±0.041)2)
由表 3 可见,与假手术组比较,模型组和电针组cleaved-Caspase1(p20)蛋白表达量显著增高,差异具有统计学意义(P<0.01);与模型组比较,电针组cleaved-Caspase1(p20)蛋白表达量显著降低,差异具有统计学意义(P<0.01)。
3 讨论
炎症是 SCI 发生后重要的病理反应之一,炎症释放的大量炎性因子以及炎性细胞浸润、聚集是导致神经元坏死、凋亡、自噬,轴突脱髓鞘,血管通透性改变和水肿等病理变化的重要原因[9-10]。MG 作为中枢神经系统中的固有免疫细胞,在 SCI 发生后的炎症反应中发挥重要作用。急性脊髓损伤发生后,脊髓中的固有MG 是损伤后大量炎性因子包括IL-1β、IL-6 和TNF-α的主要来源,从而介导炎症。SCI 发生后活化小胶质细胞/巨噬细胞群迅速向损伤区域聚集,在损伤后3 d 左右即可达到高峰,发挥浸润和吞噬作用[11-12]。因此,本研究选择损伤后3 d 作为时间点进行观察。SCI 发生后,破裂的细胞和损伤的组织释放的ATP激活MG后,MG极化为M1 状态和M2 状态。M1 状态的MG 主要促进炎性介质特别是炎性因子的释放,而M2状态的MG主要发挥抑制炎性介质的作用。但是,在SCI 持续损伤的状态下,大部分MG向M1状态发生极化而导致炎症加剧并形成恶性循环。同时,MG 活化介导炎症的主要机制与MG活化后细胞膜通透性发生改变有关。在 ATP 的作用下,MG 细胞膜通透性改变,导致细胞内外钠离子、钾离子和钙离子失衡,进一步活化 Caspase1,使其被剪切为具有酶切活性的 Caspase1(p20),Caspase1(p20)对IL-1β前体和IL-18 前体进去剪切,使其成熟为具有促炎作用的炎性因子并释放到细胞外[13]。SCI 发生后,活化 MG 参与的炎症反应对神经系统修复来说是一把双刃剑。一方面,损伤早期轻度MG 活化和炎症反应有利于清除坏死细胞和组织碎片,保护未损伤组织,促进组织修复[15];另一方面,随着损伤持续及损伤-炎症恶性循环,过度MG 活化和持续高水平炎症反应产生大量炎性介质及细胞毒性物质,导致细胞坏死、凋亡、神经退行性变等阻碍组织修复的病理结果[16]。由此可见,SCI后如何有效针对MG活化进行干预,通过降低MG活化程度进而维持低水平炎症是治疗SCI 的新思路和切入点。
SCI 中医学的病因病机为跌仆损伤致经脉受损,气血瘀阻,气血运行不畅,下肢失养所致。治疗当以益气活血、通督复髓为原则[17]。电针刺激具有活血通经、调畅督脉上下的功效,因此电针治疗脊髓损伤符合中医学基础理论。夹脊穴是腰背部的重要穴位,走行于督脉和足太阳膀胱经之间。中医学理论认为,夹脊穴与上下、左右和前后经脉之气借助气街路径而相互联系沟通,成为联络沟通督脉和足太阳膀胱经脉气的传输点。同时,从人体生理解剖方面来说,夹脊穴与脊神经节段分布有密切关系。刺激夹脊穴可有效刺激脊神经的前支和后支,从而影响交感神经而调节人体脏腑功能活动与气血运行[18]。临床实践中,对SCI 患者施以电针夹脊穴治疗,对于改善SCI 患者肢体运动功能、感觉功能以及膀胱功能等均有一定作用。本研究发现,电针组SCI 大鼠脊髓组织中神经元形态可见较明显改善,同时血清中促炎性因子 IL-1β和 IL-18 含量显著减少,这进一步证实电针夹脊穴确能通过抑制炎症而有利于损伤后神经元修复。但是,关于电针抑制炎症的机制研究尚少,电针是如何抑制SCI 后炎症尚不十分清楚。本研究进一步发现,电针抑制SCI后MG活化程度,同时降低具有酶切作用的 Caspase1(p20)蛋白的表达;同时电针干预可有效降低SCI 大鼠血清中炎性因子IL-1β和IL-18 含量。因此,鉴于MG 活化对炎症的重要介导作用以及Caspase1(p20)在MG 活化介导炎症过程中对无活性IL-1β和IL-18 的重要酶切作用,推测SCI 发生后,电针干预可抑制MG 活化并抑制 Caspase1(p20)蛋白表达,从而使具有促炎效应的IL-1β和IL-18 生成较少,这可能是电针降低SCI 后IL-1β和IL-18 含量抑制炎症的主要原因之一。因此,本研究说明电针抑制SCI后炎症而有利于神经元形态改善的机制与其抑制 SCI后MG 活化介导的炎症有关。

