针刺配合低频神经肌肉电刺激对卒中下肢偏瘫患者肢体功能的影响
马振宇
(金华市中心医院/浙江大学金华医院,金华 321000)
偏瘫是卒中常见后遗症,急性期发生率高达80%[1],表现为同侧上下肢、舌肌、面肌运动障碍,且以下肢运动功能障碍对患者运动功能康复影响最为明显。卒中患者运动元损伤后,运动系统失去高位神经中枢控制,患侧下肢出现伸肌共同运动的模式,引起足下垂,造成步态异常,影响患者独立转移能力及下肢运动功能,易造成关节扭伤,影响康复效果[2]。低频神经肌肉电刺激(neuromuscular electrical stimulation, NMES)是早期用于纠正及防治卒中后步态异常的常用策略,据文献报道,卒中患者采用NMES不仅可改善患者肢体功能,同时可降低致残率,提升患者日常生活能力[3]。针刺则为卒中偏瘫常用的中医特色治法[4],中医学认为,皮肤、腠理、五脏为有机整体,经络则遍布全身,维持规律循行、错综复杂的联络交汇将五脏六腑、皮肉筋骨联络为有机整体,经络疏通、阴阳平衡则血气通畅、血脉流通[5]。而针刺可疏通经络,畅行气血,调节脏腑气机,调和阴阳。基于此,笔者采用针刺配合NMES治疗卒中下肢偏瘫患者50例,并与单纯NMES治疗50例相比较,现报道如下。
1 临床资料
1.1 一般资料
100 例卒中下肢偏瘫患者均为2015 年7 月至2017年 6 月金华市中心医院门诊患者,按就诊先后顺序采用查随机数字表法将患者随机分为治疗组和对照组,每组50 例。治疗组中男35 例,女15 例;年龄最小41岁,最大78 岁,平均(63±8)岁;平均病程为(8.8±4.5)周;改良Ashworth 分级为Ⅰ级23 例,Ⅱ级19 例,Ⅲ级8 例。对照组中男36 例,女14 例;年龄最小43 岁,最大 79 岁,平均(63±8)岁;平均病程为(8.6±4.4)周;改良 Ashworth 分级为Ⅰ级 22 例,Ⅱ级 20 例,Ⅲ级 8例。两组患者性别、年龄、病程及改良Ashworth 分级比较,差异无统计学意义(P>0.05),具有可比性。此外,本研究经金华市中心医院医学伦理委员会批准。
1.2 纳入标准
①符合中华医学会全国脑血管学术会议通过的“各类脑血管病诊断要点”[6]中卒中后偏瘫的诊断标准。②经头部CT 或MRI 检查确诊。③临床为单侧下肢痉挛型瘫痪,伴肌张力上升,改良Ashworth 分级为1~3 级。④病程为2 周至6 个月。⑤卒中次数≤2 次。⑥符合国家中医药管理局“中风病诊断与疗效评定标准(试行)”[7]中中风病的相关标准,主症为神识昏蒙、半身不遂、口舌歪斜、言语謇涩或失语,偏身感觉异常;次症为眩晕、头痛、目偏不瞬、共济失调、瞳神变化、呛咳。⑦病情稳定,意识清醒。⑧生命体征平稳。⑨获得患者及家属知情同意。
1.3 排除标准
①生命体征不稳定或神志昏迷者;②合并严重心、肝、肾、肺功能障碍者;③合并精神疾病者;④近期接受其他抗痉挛、肌肉松弛等药物干预者;⑤非脑血管所致下肢偏瘫者;⑥惧怕针刺而无法配合者。
2 治疗方法
两组均参照“中国脑血管病防治指南”[8]给予脑卒中二级预防治疗,控制血压,给予降压、降糖、调脂处理,配合服用阿司匹林肠溶片,给予常规对症处理及营养支持。
2.1 对照组
给予 NMES 治疗。患者取侧卧位,采用美国 Empi公司LuBian Best神经肌肉电刺激治疗,电极连接患侧下肢股四头肌、胫前肌、三头肌、腘绳肌运动点,下肢悬吊,模拟步行肌肉收缩时序,每周期刺激等同一个完整的步态周期,刺激频率为45 Hz,脉宽0.3 ms,最大耐受刺激电流为30~40 mA,每次15 min。每日4 次,共治疗4 周。
2.2 治疗组
在对照组基础上加用针刺治疗。头针取顶颞前斜线、顶旁1 线、顶旁2 线;体针取患侧水沟、三阴交、内关、极泉、尺泽、委中穴。风痰阻络加丰隆、合谷穴;气虚血瘀加足三里、血海、气海穴;肝阳暴亢加太溪、太冲穴;痰热腑实加丰隆、内庭、曲池穴;阴虚风动加风池、太溪穴;口眼歪斜加地仓、颊车穴;足内翻加丘墟透照海;下肢痉挛严重加阳陵泉、解溪穴。患者取仰卧位,上肢伸直,略外展 30°,双手自然外旋,放置于身体双侧;下肢自然伸直,双膝垫高15 cm,膝关节略弯曲,双足中立位,无菌消毒局部针刺区皮肤后,选择长25~40 mm 无菌针灸针进行针刺,头针要求快速将毫针刺入头皮达帽状腱膜下,水平进针 0.8~1.0 寸,行捻转手法 2~3 min;内关直刺 0.5~1.0 寸,行提插泻法;水沟向鼻根进针0.3~0.5 寸,行轻雀啄法,以眼球湿润为宜;极泉直刺1.0~1.5 寸,行提插泻法;委中直刺0.5~1.0 寸,行提插泻法;尺泽直刺1 寸,行提插泻法;三阴交直刺进针 1 寸,行提插补法;地仓向颊车透刺35~40 mm,丘墟穿过照海穴透刺0.5~0.8 寸,其余各配穴直刺10 mm。留针30 min,每日1 次,共治疗4 周。
3 治疗效果
3.1 观察指标
3.1.1 下肢运动功能评定
采用简化Fugl-Meyer 运动功能评定表(FMA)[9]评定患者治疗前后下肢运动功能,量表包括下肢坐位、坐位、站立位等体位反射活动、联带运动、伸肌共同运动、分离运动、反射亢进、协调性及速度等方面,每项0~2 分,0 分表示无法完成动作,1 分表示部分可完成,2 分表示可充分完成,总分100 分。评分越高,表示下肢运动功能恢复越好。
两组患者治疗前后分别进行10 m 步行试验,记录患者 10 m 最大步行速度(MWS)的变化情况,均测定 3次取均值。
3.1.2 肌痉挛程度评定
采用改良 Ashworth 痉挛量表[10]评定患者治疗前后肌力变化,分为0~Ⅳ级。0 级为肌张力未增加;Ⅰ级为肌张力轻度增加,受累部分被动屈伸有较小阻力;Ⅱ级为肌张力增加明显,受累部分被动屈伸阻力增加;Ⅲ级为肌张力增加,被动活动困难;Ⅳ级为僵直,受累部分屈伸。
3.1.3 步态及关节运动参数分析
采用美国Motion Analysis 公司三维运动分析系统,要求受试者穿束缚裤装及平底鞋,将惯性测量模块、传感器固定于患者骶骨、双股骨中段前侧,双胫骨近内侧及双足背区,采样频率500 Hz,同步采集骨盆、髋、膝、踝关节冠状面、垂直面、矢状面运动数据,患者呈标准立正姿势站立行走,按习惯速度行走12 m,均重复测量 3 次,取均值,根据系统自带软件 Ortho Trak 采集患者步态及关节运动学参数,记录患侧步长、步态周期、步频、步速、支撑相、摆动相、髋关节最大屈曲/伸展角度、髋关节屈伸角速度、膝关节最大伸展/屈曲角度、膝关节屈伸角速度、足偏角。
3.2 统计学方法
所有数据采用 SPSS20.0 软件进行统计分析。符合正态分布的计量资料以均数±标准差表示,采用t检验;计数资料采用卡方检验;等级资料采用秩和检验。以P<0.05 表示差异具有统计学意义。
3.3 治疗结果
3.3.1 两组治疗前后各项步态指标比较
由表1 可见,两组治疗前各项步态指标(步长、步频、步态周期、步速、支撑相、摆动相)比较,差异无统计学意义(P>0.05)。两组治疗后各项步态指标与同组治疗前比较,差异均具有统计学意义(P<0.05)。治疗组治疗后各项步态指标与对照组比较,差异具有统计学意义(P<0.05)。
3.3.2 两组治疗前后各关节运动参数比较
由表2 可见,两组治疗前各关节运动参数比较,差异无统计学意义(P>0.05)。两组治疗后各关节运动参数与同组治疗前比较,差异均具有统计学意义(P<0.05)。治疗组治疗后各关节运动参数与对照组比较,差异具有统计学意义(P<0.05)。
3.3.3 两组治疗前后改良Ashworth 分级比较
由表3 可见,两组患者治疗前改良Ashworth 分级比较,差异无统计学意义(P>0.05)。两组治疗后改良Ashworth 分级与同组治疗前比较,差异均具有统计学意义(P<0.05)。治疗组治疗后改良Ashworth 分级与对照组比较,差异具有统计学意义(P<0.05)。
表1 两组治疗前后各项步态指标比较 (±s)

表1 两组治疗前后各项步态指标比较 (±s)
注:与同组治疗前比较1)P<0.05;与对照组比较2)P<0.05
观察指标 治疗组(例数=50) 对照组(例数=50)治疗前 治疗后 治疗前 治疗后步长(cm) 40.34±12.75 60.83±10.711)2) 40.36±12.82 55.31±4.761)步频(steps/min) 70.71±12.37 102.03±8.341)2) 70.69±12.26 90.12±13.141)步态周期(s) 1.65±0.45 1.12±0.151)2) 1.67±0.42 1.43±0.111)步速(cm/s) 54.01±20.96 96.78±7.411)2) 53.98±21.75 81.26±9.981)支撑相(%) 66.78±5.22 55.33±1.811)2) 66.81±5.31 59.23±4.471)摆动相(%) 34.27±5.12 40.32±3.251)2) 34.35±5.22 37.14±2.891)
表2 两组治疗前后各关节运动参数比较 (±s)

表2 两组治疗前后各关节运动参数比较 (±s)
注:与同组治疗前比较1)P<0.05;与对照组比较2)P<0.05
观察指标 治疗组(例数=50) 对照组(例数=50)治疗前 治疗后 治疗前 治疗后髋关节最大屈曲角(°) 26.66±5.73 32.32±3.411)2) 25.98±6.21 29.12±2.561)髋关节最大伸展角(°) 5.95±5.03 9.31±3.251)2) 5.94±5.12 7.16±1.041)髋关节屈伸角速度(°/s) 47.51±15.02 78.37±5.321)2) 47.56±16.37 70.22±9.631)膝关节最大屈曲角(°) 40.31±10.25 62.37±5.761)2) 40.32±10.31 54.17±6.361)膝关节最大伸展角(°) 2.13±3.51 1.27±1.261) 2.11±3.53 1.34±1.751)膝关节屈伸角速度(°/s) 62.11±26.34 106.71±20.941)2) 62.09±26.52 87.12±15.491)足偏角(°) 8.08±2.13 6.07±3.711) 8.07±2.12 6.21±2.751)
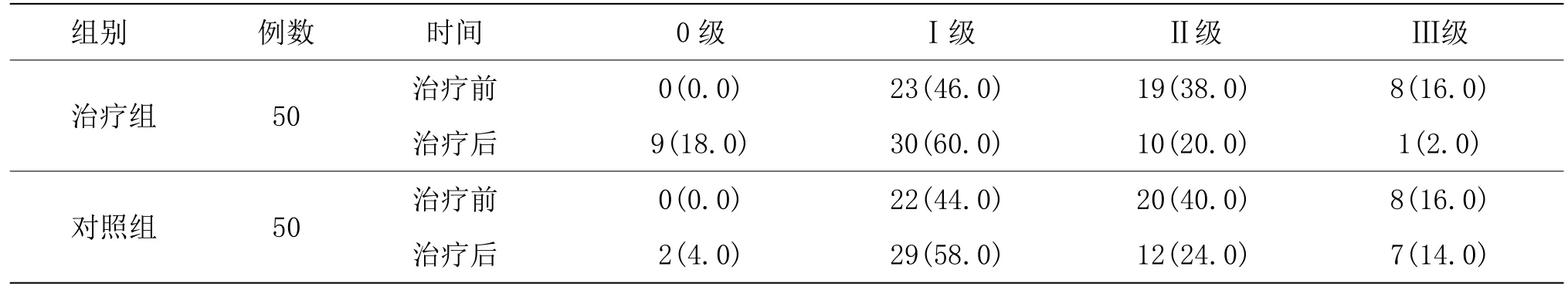
表3 两组治疗前后改良Ashworth分级比较 [例(%)]
3.3.4 两组治疗前后FMA 评分及MWS 比较
由表 4 可见,两组患者治疗前FMA评分及MWS比较,差异无统计学意义(P>0.05)。两组治疗后FMA 评分及 MWS 与同组治疗前比较,差异均具有统计学意义(P<0.05)。治疗组治疗后FMA 评分及MWS 与对照组比较,差异具有统计学意义(P<0.05)。
表4 两组治疗前后FMA评分及MWS比较 (±s)
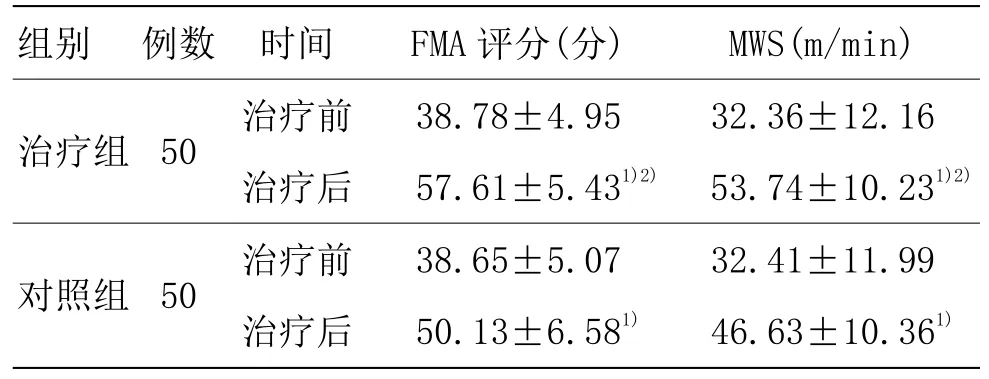
表4 两组治疗前后FMA评分及MWS比较 (±s)
注:与同组治疗前比较1)P<0.05;与对照组比较2)P<0.05
组别 例数 时间 FMA 评分(分) MWS(m/min)治疗组 50 治疗前 38.78±4.95 32.36±12.16治疗后 57.61±5.431)2) 53.74±10.231)2)对照组 50 治疗前 38.65±5.07 32.41±11.99治疗后 50.13±6.581) 46.63±10.361)
4 讨论
近年来,随着人口老龄化进程的加快,卒中的发病率逐渐上升,其所致偏身肢体障碍发生率有所上升,且以下肢活动障碍为主[11-12]。目前对卒中下肢偏瘫康复治疗的重点在于改善患者下肢运动功能,最大限度恢复患者步行能力。常用治法包括经颅磁刺激、低频电刺激、肌电生物反馈等,均可促进患者患肢功能恢复,降低致残率[13-14]。其中低频神经肌肉电刺激可通过低频脉冲电流刺激小脑区体表,调节大脑皮质血流量,扩张脑血管,促进局部血流量增加,诱发肌肉自主运动,改善或恢复肌肉及肌群功能,并将电刺激信号反复传输至中枢神经,促进其产生可塑性变化,调节患肢运动,改善神经功能。同时,低频神经肌肉电刺激可强化中枢神经系统对下肢运动功能的控制能力,重建患肢被动节律性收缩,延缓患肢肌肉萎缩,促进肌肉运动功能恢复及神经再生[15]。田亮等[16]对卒中偏瘫患者采用低频电刺激干预发现其可促进患者神经再生,提升其神经传导功能,促进患者运动功能改善。
卒中属中医学“中风”范畴,卒中后偏瘫则归于“偏枯”“筋痹”等范畴,以半身不遂、口眼歪斜、语言不利为特点,轻症者见肢体乏力、口眼歪斜,重症者伴意识丧失,猝然昏仆。中医学认为中风主要由气血逆乱、阴阳失调、肝肾亏虚引起,该病本虚标实,风、气、瘀、火、痰为发病之标,以气虚、血虚、阳虚、阴虚为本,邪实、肝肾阴虚共同作用而发病[17]。发病早期邪气旺盛、风火痰盛,气血上犯,故以标实为主,病之后期,正气未复,邪气未散,虚实夹杂,病久耗损阴液,肝肾阴虚则风气动,痰瘀阻,经脉不通,故见筋痹。有研究发现,针刺可疏通经络,畅通气血,调节脏腑气机,对中风不同阶段均有较高的干预作用[18]。且针刺可直达肌肉深层组织,刺激神经系统,疏通经络,补泻得宜,调和阴阳、气血,舒筋活络,改善脑内血液循环,加快气血循环,提升肌力,分离粘连。本研究中,对照组采用单纯NMES治疗,治疗组在此基础上加用针刺治疗,结果显示,两组患者治疗后下肢功能FMA 量表评分、步行功能、肌张力、关节运动功能均有不同程度的改善,但治疗组对上述指标改善幅度均优于对照组,这主要与针刺可纠正肌张力过大的问题,刺激脑细胞,重建脑神经网络,减少梗死灶神经细胞损伤范围,舒张血管,增加脑血流量有关;同时针刺具有镇痛作用,可改善中风患者关节及肌肉疼痛程度,其中头针刺入帽状腱膜,紧贴骨膜,施提插泻法刺激骨膜后产生生物电,可传入脊髓、纤维、丘脑等组织至大脑皮层,从而促进肢体功能恢复;同时针刺可促进患者体内生物肽释放,从而发挥止痛效果,优化细胞自我修复能力。此外,针刺刺激可传入系统反射环路,促进感觉功能恢复,通过本体感受器传入冲动,促进神经元突触再生,建立全新突触连接,整合中枢神经系统功能,恢复中枢神经系统控制功能,改善患肢运动功能。
综上所述,针刺配合NMES 可促进卒中后下肢偏瘫患者运动功能恢复,改善关节活动能力,恢复患者步行能力,减轻肌痉挛程度,有较高的临床应用价值。

