基于数字化实验的原电池效率实验探究
杨香涛 朱冬萍

摘要:利用数字化手持技术探究锌与硫酸铜溶液直接反应、锌铜单液原电池和锌铜双液原电池在相同条件下工作时体系的温度、电流和压强等方面的不同,得出锌铜双液原电池工作时体系的温度变化小,化学能转化为热能少,热损耗小,产生的电流、电压稳定,由化学能转化为电能效率高。
关键词:数字化手持技术;锌铜单液原电池;锌铜双液原电池;效率
文章编号:1008-0546(2019)08-0091-04
中图分类号:G633.8
文献标识码:B
doi: 10.3969/j .issn.1008-0546.2019.08.030
一、问题提出
原电池知识是中学电化学部分的重要知识点,现行高中化学苏教版必修教材《化学2》将原电池定义为“将化学能转变为电能的装置”[1],并选用锌、铜和稀硫酸构成的锌铜单液原电池进行实验来探讨原电池的工作原理,而高中化学苏教版选修教材《化学反应原理》则选用由(一)Zn/ZnSO4( aq)//CuSO4(aq)/Cu(+)构成的锌铜双液原电池进行实验对原电池工作原理进行进一步探讨。在教学中,学生经常会产生这样的疑问——同样是探讨原电池的工作原理,为什么必修教材选用锌铜单液原电池,而选修教材则选用锌铜双液原电池?锌铜单液原电池和锌铜双液原电池在构造上有明显的区别,但二者相比各有什么优缺点?哪种原电池的放电效率更高?我们教师对于这些问题一般是从理论角度进行解释,并运用教材上的实验验证电流的产生,却忽视了教材中的2个实验在设计上都存在着一个明显的缺陷,即只能根据实验过程中电流计的偏转定性说明装置中有电流产生,却不能定量说明原电池工作时产生的电流强度大小、电压和能量转换效率高低。
本文设计的实验就是基于教材中2个实验的改进和创新,为了便于比较,引入了锌与硫酸铜溶液直接反应的实验,并将锌铜单液原电池中的电解质溶液由稀硫酸换成CuSO4溶液,同时为了保证对反应体系温度测定的准确性,有效防止反应体系与外界的热交换,将实验中的烧杯改成简易量热计,并借助数字化实验技术,利用SWR数字化信息系统,通过锌与硫酸铜溶液直接反应、锌铜单液原电池和锌铜双液原電池在工作时体系的温度、电流和压强等的对比,让学生知道不同原电池的效率高低,认识不同原电池的优缺点,帮助学生建构原电池的概念和工作原理,培养学生的辩证思维能力、实践能力和创新精神[2],发展学生的化学学科核心素养,
二、实验原理
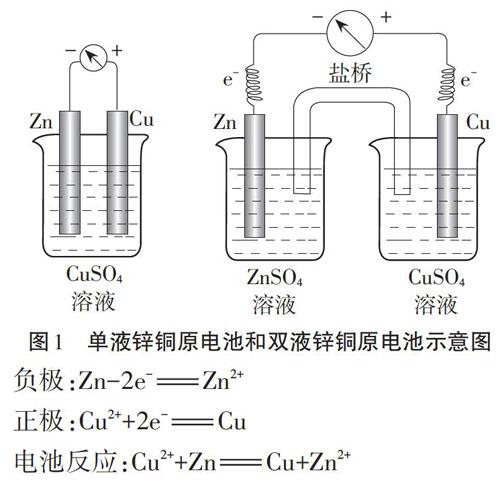
锌铜单液原电池和锌铜双液原电池的实验装置不同(见图1)[3],但反应原理相同,即负极锌上发生氧化反应,给出电子,正极铜上发生还原反应,得到电子,电子由负极通过外电路流向正极,电流则由正极通过外电路流向负极,发生的电极反应和电池反应分别为[4]:
负极:Zn-2e=Zn2+
正极:Cu2++2e= Cu
电池反应:Cu2++Zn=Cu+Zn2+
三、实验探究
1.实验仪器和用品
烧杯、量筒、简易量热计、盐桥、砂纸、导线、温度传感器、电流传感器、电压传感器、图形数据采集器、手提电脑或平板电脑。
2.实验药品
铜片、锌片、l.Omol.L-1的CuSO4溶液、l.Omol.L-1的ZnSO4溶液。
3.实验步骤
(1)准确配制1.Omol.L-1的CuS04溶液和1.Omol.L-1的ZnSO4溶液各500mL备用。
(2)用砂纸打磨几片铜片和锌片。
(3)组装如图2所示的实验装置,注意连接好温度传感器、电流传感器、电压传感器和数据采集器。
图2实验装置图
(4)将数据采集器与电脑连接,并进行调试(数据采集器设置为Is测定10个数据,测定时间为600s)。
(5)量取lOOmL l.Omol.L-1的CuSO4溶液于简易量热计中,将温度传感器探头插入到溶液中2min左右,使探头温度和溶液温度保持一致,取一片打磨过的锌片置予CuSO4溶液中。
(6)连接数据采集器与电脑,测定随着时间的变化反应体系的温度和电流,采集数据。
(7)同理,量取lOOmL l.Omol.L-1的CuSO4溶液于简易量热计中,将温度传感器探头插入到溶液中2min左右,使探头温度和溶液温度保持一致,在简易量热计中同时插入打磨过的铜片和锌片,用导线连接,并连接数据采集器与电脑,测定随着时间的变化反应体系的温度、电流和电压,采集数据。
(8)同理,分别量取lOOmL l.Omol.L-1的CuSO4溶液和lOOmL l.Omol.L-1的ZnSO4溶液于2个简易量热计中,将温度传感器探头分别插入到2种溶液中2mln左右,使探头温度和溶液温度保持一致,在盛CuS04溶液的量热计中插入一片打磨过的铜片,在盛ZnSO4溶液的量热计中插入一片打磨过的锌片,并分别用导线连接,2个量热计之间用盐桥相连,连接数据采集器与电脑,测定随着时间的变化反应体系的温度、电流和电压,采集数据。
(9)保存数据。
(10)整理仪器,回收、处理药品。
四、实验结果与分析
1.锌与硫酸铜溶液直接反应和锌铜单液原电池工作时的温度和电流比较
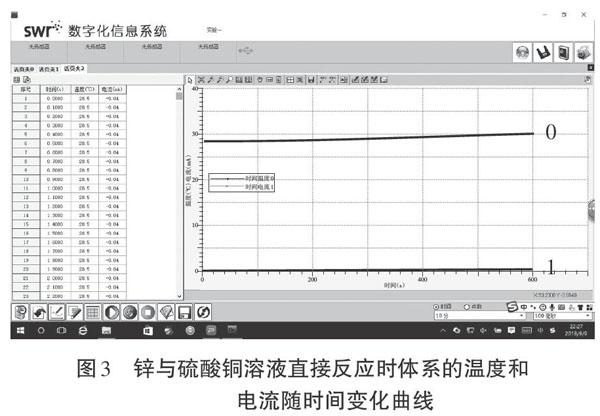
图3是锌与硫酸铜溶液直接反应时体系的温度和电流随时间变化曲线,其中“1”表示电流变化曲线,“0”表示温度变化曲线。从曲线的变化可以看出,随着时间的变化锌与硫酸铜溶液直接反应时电流的变化几乎为0,说明在锌置换铜的反应中几乎无电流产生。事实上当置换反应发生后,由于锌置换的铜会覆盖在锌的表面,并在锌的表面形成了若干个微小的原电池,电子在这些微小的原电池内部定向移动会产生微弱的电流,但由于产生的电流过于微弱,在测定的曲线上反映不明显,导致测出的电流近似为0。另外由曲线上的数据还可以看出,反应时CuSO4溶液的温度从28.5℃左右上升到了30℃左右,说明锌与硫酸铜溶液反应时能量的转化形式主要表现为化学能转化为热能。

