孕激素受体与Ki- 67指数组合对激素受体阳性中分化早期乳腺癌预后的评估价值
张燕娜,周易冬,茅 枫,姚 儒,孙 强
中国医学科学院 北京协和医学院 北京协和医院乳腺外科, 北京 100730
乳腺癌是女性最常见的恶性肿瘤,近年来其发病率呈上升趋势。对于其中激素受体(hormone receptor, HR)表达阳性且人类表皮生长因子受体2(human epidermal growth factor receptor- 2, HER- 2)表达阴性的早期乳腺癌患者,化疗获益及预后评估是临床关注的问题。美国国家综合癌症网(National Comprehensive Cancer Network, NCCN)乳腺癌临床指南自2011年起推荐在HR阳性HER- 2阴性腋窝淋巴结阴性早期乳腺癌中使用21基因检测[1],为预后判断及化疗决策提供帮助。鉴于21基因检测费用高昂(8000~10 000元/例),目前国内常规开展这一检测的医疗机构尚为少数。在众多中小型医疗机构中,乳腺癌临床治疗决策的制定更多依赖于病理分期和免疫组化结果。本研究通过对389例行21基因检测的HR阳性HER- 2阴性腋窝淋巴结阴性中分化早期乳腺癌患者的临床、病理资料进行分析,探讨在中分化早期乳腺癌中应用孕激素受体(progesterone receptor,PR)与Ki- 67指数(PK)组合和21基因复发风险评分(recurrence score, RS)的一致性及对乳腺癌预后的评估价值。
1 资料与方法
1.1 研究对象
回顾性分析2012年5月至2017年5月间于北京协和医院乳腺外科行手术治疗的早期浸润性乳腺癌患者的临床及病理资料。
纳入标准:(1)HR阳性、HER- 2阴性且淋巴结未见转移的早期浸润性乳腺癌;(2)肿瘤组织学分级为中分化(即组织学分级为Ⅱ级);(3)完成21基因检测。
排除标准:(1)术前已行新辅助化疗或新辅助内分泌治疗;(2)同侧或对侧乳腺曾患乳腺癌;(3)合并其他恶性肿瘤。
1.2 病理检测
所有病理切片均由两位经验丰富的病理科医师复核诊断并核定病理学参数,包括组织学分级、雌激素受体(estrogen receptor,ER)、PR、HER- 2及Ki- 67的表达情况。病理诊断采用世界卫生组织2012年版的乳腺肿瘤组织学分类标准:(1)≥1%的癌细胞核ER或PR表达阳性定义为HR(+);(2)HER- 2免疫组化(-)或(+)为HER- 2阴性,(+++)为阳性,HER- 2(++)则行荧光原位杂交(fluorescence in situ hybridization, FISH)检测,无基因扩增为阴性(结果不确定按照阴性处理),有基因扩增则为阳性。
1.3 21基因检测方法及复发风险评分
应用基因分支DNA-液相芯片技术对全部病例的手术组织标本进行基因mRNA表达水平检测,并计算RS评分[2]。RS<18为低复发风险(RS低危组),18≤RS<31为中复发风险(RS中危组),RS≥31为高复发风险(RS高危组)。
1.4 PK组合
依据本研究小组的前期临床研究结果[3],将组织学分级为中分化的患者按照PR表达及Ki- 67指数分为PK低危组(PR≥10%且Ki- 67≤20%)、PK高危组(PR<10%且Ki- 67>20%)及PK中危组(非高危或低危组),并将这一分组命名为PK组合1;将PK组合1中的PR临界值由10%提高为20%,保持Ki- 67临界值不变,即以PR≥20%且Ki- 67≤20%为低危组,以PR<20%且Ki- 67>20%为高危组,将该分组命名为PK组合2;同理,分别或同时调整PR及Ki- 67指数的临界值,设定不同的PK组合,分析并比较不同PK组合与RS评分的一致性。
1.5 随访
采用查阅电子病历系统、门诊随访和电话随访的方式,由科室随访员每隔半年进行统一随访。随访内容包括术后辅助治疗情况、复发和转移、影像学检查以及生存情况等。
1.6 统计学处理
应用SPSS 24.0软件进行统计学分析。符合正态分布的计量资料采用均数±标准差表示,非正态分布的计量资料以中位数(四分位数间距)表示。计数资料采用频数(率)表示,组间比较采用χ2检验或Fisher精确概率检验,不同分组事件数比较采用McNemar检验。P<0.05为差异有统计学意义。
2 结果
2.1 一般临床资料
573例早期浸润性乳腺癌患者按照组织学分级及21基因RS评分进行分组(表1),依据纳入及排除标准共389例中分化乳腺癌患者纳入本研究。纳入患者均为女性,其中RS低危组 247例(63.5%,247/389),平均年龄(48.8±8.8)岁;RS中危组 115例(29.6%,115/389),平均年龄(48.4±8.8)岁;RS高危组27例(6.9%,27/389),平均年龄(50.3±8.6)岁,差异无统计学意义(P=0.213)。
2.2 乳腺癌临床病理特征与21基因复发风险评分的关系
389例中分化早期乳腺癌患者根据21基因RS评分分组后,组间在ER表达、PR表达及Ki-67指数方面差异具有统计学意义(P均≤0.001);在乳腺手术方式的选择、腋窝淋巴结处理及术后辅助内分泌治疗方面差异无统计学意义(P=0.651、P=0.122和P=0.489);化疗选择上,高危组相对于中、低危组有更高比例的患者接受了术后辅助化疗,差异有统计学意义(P<0.001)(表2)。
2.3 PK组合对复发风险预估与21基因复发风险评分的关系
按照PR表达及Ki- 67指数将389例患者分为PK低危组248例(63.8%,248/389),PK中危组 125例(32.1%,125/389)及PK高危组16例(4.1%,16/389)。247例RS低危组中186例(75.3%,186/247)被PK组合正确判断为低危,60例进入PK中危组,1例高估为PK高危组; 27例RS高危患者中10例(37.0%,10/27)被PK组合判断为高危,16例进入PK中危组,1例低估为PK低危组(表3)。
2.4 不同PK组合对21基因复发风险评分分组预估的准确性
从敏感度、阳性预测值(positive predictive value,PPV)及不一致性(RS低危预估为PK高危或RS高危预估为PK低危)3方面进行比较,以高敏感度、高PPV以及低不一致性作为选择标准。在对RS低危组的预估中,PK组合1的敏感度明显高于PK组合2(75.3% 比55.8%),PPV及不一致性两者近似;在对RS高危组的预估中,PK组合1的敏感度与PK组合2一致,但PK组合1的PPV更高(62.5% 比35.7%)而不一致性更低(6.3% 比17.9%)(表4)。逐一比较不同PK组合与RS评分的一致性,最终将PK组合1确定为本文推荐的预估组合。

表 1 不同组织学分级早期乳腺癌RS分组[n(%)]
RS:复发风险评分
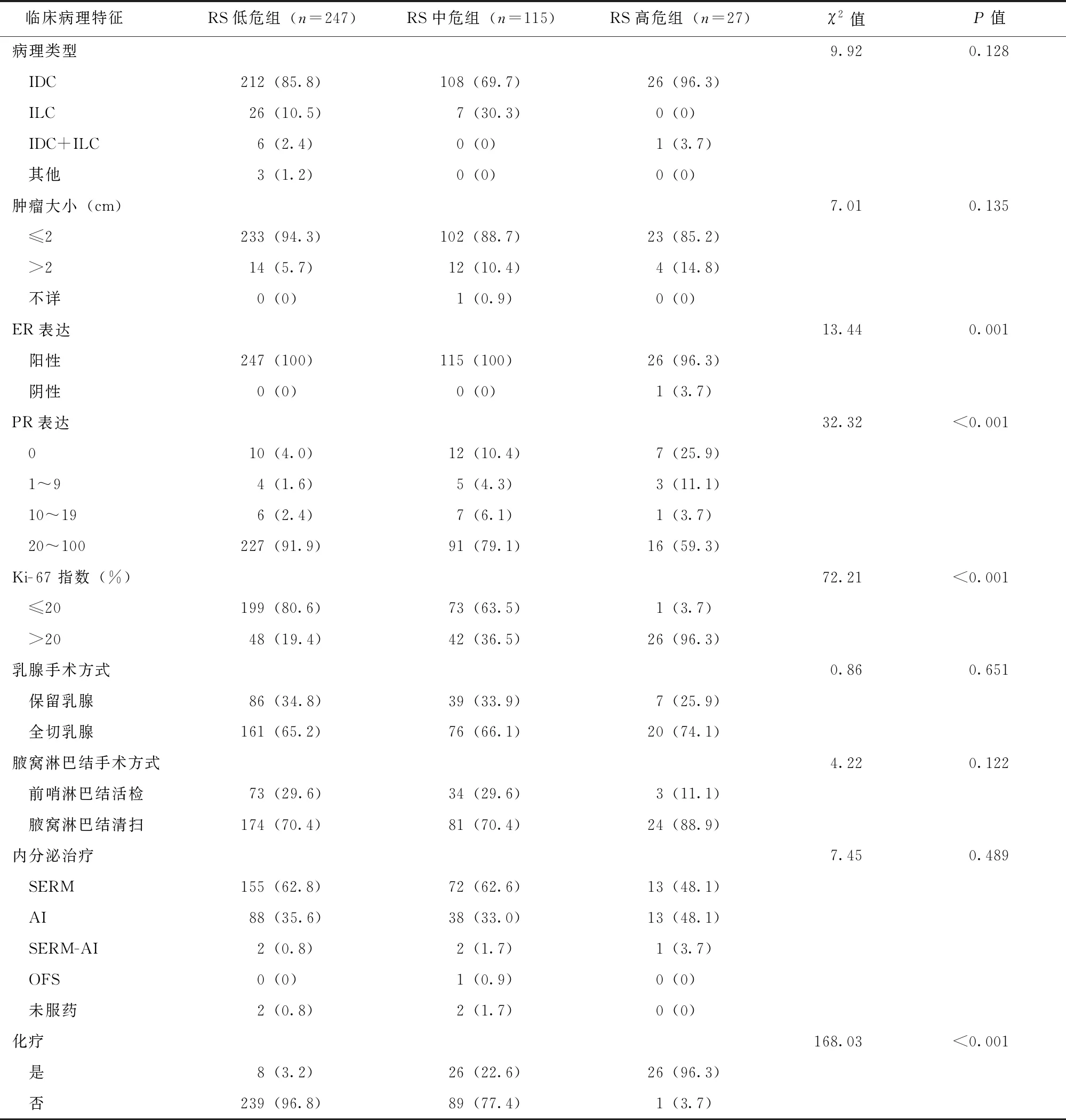
表 2 389例中分化早期乳腺癌患者不同RS分组的临床病理资料[n(%)]
RS:同表1;IDC:浸润性导管癌;ILC:浸润性小叶癌;SERM:选择性雌激素受体调节剂;AI: 芳香化酶抑制剂;OFS:卵巢功能抑制
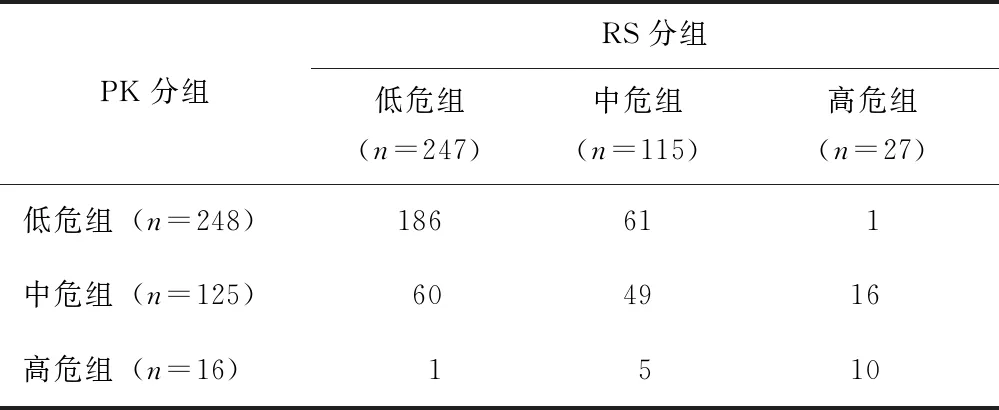
表 3 PK组合对复发风险预估与RS分组的关系(n)
RS:同表1;PK组合:孕激素受体与Ki- 67指数组合
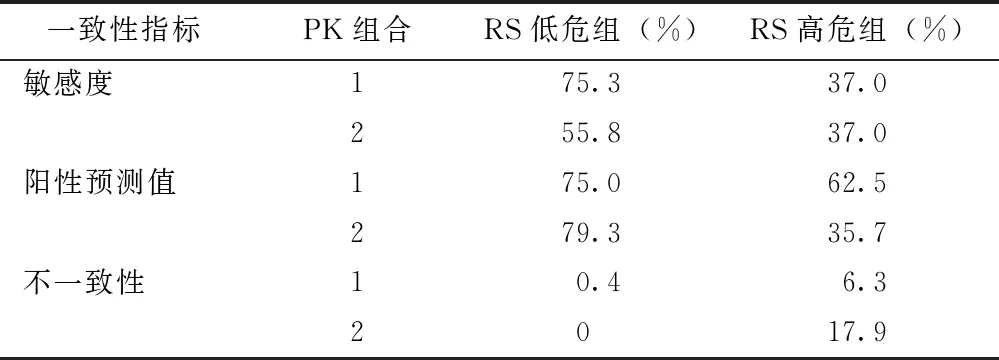
表 4 不同PK组合对RS分组预估的一致性比较
RS:同表1;PK组合:同表3;PK组合1:以PR≥10%且Ki- 67≤20%为低危,以PR<10%且Ki- 67>20%为高危;PK组合2:以PR≥20%且Ki- 67≤20%为低危,以PR<20%且Ki- 67>20%为高危
2.5 PK组合分组及21基因RS分组与复发转移的关系
截至2018年1月,本研究中位随访时间为40(8~68)个月,全组共有局部区域复发14例(包括胸壁复发7例,同侧乳腺复发1例,同侧腋窝或锁骨上淋巴结转移6例),其中RS低、中、高危组分别为5例、7例和2例;PK低、中、高危组分别为6例、6例和2例。全组共有6例远处转移(包括骨转移4例、肺转移1例、纵隔及腹腔淋巴结脑转移1例),RS低、中、高危组分别为3例、3例和0例,PK分组与其一致。按总事件数统计,RS低、中、高危组的总事件数分别为8例(3.2%)、10例(8.7%)和2例(7.4%),PK低、中、高危组的总事件数分别为9例(3.6%)、9例(7.2%)和2例(12.5%),PK分组与RS分组总事件发生率差异无统计学意义(χ2=0.200,P=0.655),且总事件发生率随PK组合危险度的升高而升高(表5)。
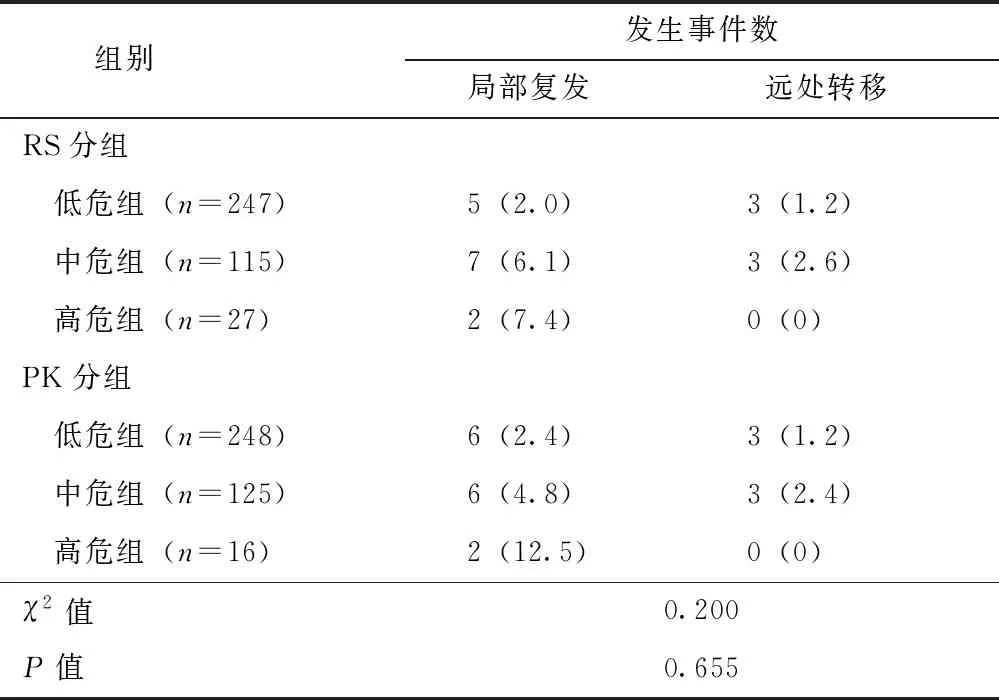
表 5 不同RS分组及PK分组事件数比较[n(%)]
RS:同表1;PK组合:同表3
3 讨论
本研究通过回顾性分析行21基因检测的HR阳性HER- 2阴性腋窝淋巴结阴性中分化早期乳腺癌患者的临床、病理资料,首次提出按照PR表达及Ki- 67指数设定PK组合,将患者分为PK低危组(PR≥10%且Ki- 67≤20%)、PK高危组(PR<10%且Ki- 67>20%)及PK中危组(非高危或低危组),发现针对该患者群的PK组合具有与21基因RS评分相当的预后评估价值。
随着基因检测技术的不断提升和推广,HR阳性HER- 2阴性早期乳腺癌的预后判断及治疗选择不再仅仅依赖于肿瘤的临床病理分期。自2011年美国NCCN乳腺癌临床指南推荐在该患者群中使用21基因检测至今[1],已有众多国内外临床研究证实21基因RS评分在辅助化疗决策以及预后判断中的作用[2- 7]。但考虑到目前中国庞大的人口基数、发病率以及基因检测的可获得性和昂贵费用,21基因检测在国内医疗机构的广泛开展尚需时日。本研究小组的前期研究显示,RS评分是影响HR阳性HER- 2阴性早期乳腺癌患者无复发生存的独立影响因素[8],组织学分级、ER/PR表达及Ki- 67指数是影响RS评分的主要免疫组化指标[3, 8]。在RS评分不可获得的情况下,如何根据现有的免疫组化结果对RS评分作出一定预估,是现阶段值得研究和探索的方向。
从本研究有明确组织学分级的573例患者的RS分组情况来看,136例高分化乳腺癌中RS低危者占86.0%,RS高危者仅占0.7%;而低分化乳腺癌仅48例(8.4%,48/573),低、中、高危组约各占1/3。由此来看,高分化肿瘤中绝大多数为低复发风险患者,而低分化肿瘤往往因肿瘤增殖较快、预后欠佳而少有患者选择先行21基因检测再决定化疗。细化组织学分级后,ER/PR表达及Ki- 67指数成为影响21基因RS评分的主要因素。
本研究389例中分化乳腺癌中ER表达阴性者仅1例,PR表达阴性者有29例,PR<10%者有41例,高危组的PR阴性率及低PR表达率分别为25.9%和37.0%,明显高于中、低危组。研究显示,ER阳性PR阴性的乳腺癌具有侵袭性强且对他莫昔芬耐药的特点,是一种预后相对较差的独特的乳腺癌亚型[9]。Prat等[10]在分析了PR表达水平在luminal A样乳腺癌中的预后价值后提出,将PR阳性表达率20%作为区分luminal A样及luminal B样乳腺癌的临界指标,并被2013年St. Gallen共识所采纳[11]。Kurozumi等[12]在对ER阳性HER- 2阴性乳腺癌的PR和Ki- 67指数进行联合分析后发现,PR表达水平是独立的预后因素,尤其是对Ki- 67指数介于10%~30%之间的患者而言,PR<20%的预后效应尤为显著。在本研究中,PR<20%的患者在RS低、中、高危组中所占比例分别为8.1%(20/247)、20.9%(24/115)及40.7%(11/27),逐级递增趋势明显,与上述研究吻合。但在预估模型中,将PR临界值设为20%是否为最佳选择,尚需验证。本研究分别以0、10%及20%作为临界值计算预测的敏感性和PPV,发现PR临界值设置越低,对低危患者的预测敏感度越高,对高危患者的预测敏感度越低;随临界值降低,RS低危组的PPV稳中有降,RS高危组的PPV则明显升高(具体数据未列出),故最终选定PR≥10%作为本文预估低危的条件之一。
Ki- 67作为细胞增殖的相关抗原,其表达水平与细胞周期活性有关,被认为是较理想的检测细胞增殖活性的指标[13]。研究显示,Ki- 67是HR阳性HER- 2阴性早期乳腺癌的化疗预测及预后因子[14- 15]。2017年的St. Gallen早期乳腺癌共识[16]仍将Ki- 67作为区分luminal A样和luminal B样乳腺癌的参考因素,但并未对临界值作出具体定义。考虑到现阶段各医疗机构Ki- 67检测方法(手工和全自动计数)的不一致性、肿瘤内部异质性以及由此造成的Ki- 67相对较差的观察者间和观察者内的可重复性,Ki- 67的临界值的确定需充分考虑所在医疗机构的临床经验。尤其是对于中分化乳腺癌,Ki- 67指数的可重复性似乎更差[17]。本研究中将PR和Ki- 67组合,并根据本研究小组前期的研究结果推算,将Ki- 67≤20%作为低增殖的临界值,以期获得PK组合对RS分组预估最高的敏感度和阳性预测值,并尽量降低不一致性。
从中位随访40个月的结果来看,PK低、中、高危组的总事件发生率分别为3.6%、7.2%和12.5%,与RS低、中、高危组的总事件发生率(3.2%、8.7%和7.4%)具有可比性,考虑到随访时间有限,远处转移事件数较少,局部复发事件发生率随PK组合危险度上升而升高的趋势更为明显(表5),PK组合的预估价值得到初步验证。
从Magee公式[18]到IHC4分数[19],再从乳腺癌预后分数(the Breast Cancer Prognostic Score)[20]到改良的Magee公式[21],用肿瘤的免疫组化结果预估RS评分是众多学者历年来研究的方向。本文推荐的针对中分化乳腺癌患者的PK组合相较于上述分数和公式更加简单易用,尤其对于21基因检测尚不可获得的医疗机构,PK组合的应用能够更准确地评估预后。
由于本研究是单中心回顾性分析,选择偏移难以避免,同时因21基因检测开展时间不长随访时间有限,PK组合对远处转移的预测价值尚不能肯定。
综上所述,应用肿瘤免疫组化指标预估激素受体阳性淋巴结阴性早期乳腺癌的预后是切实可行的,本研究针对中分化早期乳腺癌的PK组合具有与RS评分相当的预后评估价值。未来将进一步开展相关研究,并进一步调整PK组合,以完善PK预估模型。

