脑血流动力学及脑氧饱和度变化与感染性休克患者预后的相关性:前瞻性队列研究
冯 清,艾美林,黄 立,彭倩宜,艾宇航,张丽娜
1北京大学深圳医院重症医学科,深圳 5180002中南大学湘雅医院重症医学科, 长沙 410008
Sepsis和感染性休克是全球性临床问题。全世界每年Sepsis患病人数超过1900万,死亡率高达31.6%,且存活患者中有23.1%出现认知功能障碍[1]。随着对Sepsis病理生理改变和血流动力学认识的逐步深入,现有指南推荐的感染性休克患者大循环群体化复苏目标策略受到挑战。以脑循环和脑功能复苏为代表的器官血流动力学管理策略越来越受到认可[2]。经颅多普勒超声(transcranial doppler ultrasound,TCD)可直观监测患者大脑动脉血流速度等变化,已逐步用于床旁脑血流动力学评估[3]。局部脑氧饱和度(regional cerebral oxygen satura-tion,rSO2)监测可提供实时连续脑氧供需平衡信息,是脑血流量是否充足的敏感指标[4],研究证实,在rSO2监测指导下对心血管大手术[5]、心肺复苏术后[6]、重型颅脑损伤[7]、休克[8]等疾病患者进行管理可明显改善患者预后。
本研究通过TCD和rSO2监测仪,观察感染性休克患者复苏治疗6 h后大脑中动脉血流速度、脑灌注指数、动态脑血管自动调节功能和大脑前额脑氧饱和度的变化,分析其与感染性休克患者预后的相关性,为实现以脑功能导向的感染性休克器官血流动力管理提供依据。
1 对象与方法
1.1 研究对象及分组
本研究为前瞻性队列研究,收集2018年5月至2019年3月在中南大学湘雅医院重症医学科住院治疗的感染性休克患者临床资料。所有患者及监护人自愿参加本研究,并获得知情同意书,研究程序经过中南大学湘雅医院伦理委员会批准(伦理号:2018101082)。
纳入标准:符合2016年美国重症医学会(Society of Critical Care Medicine, SCCM)与欧洲重症医学会(European Society Intensive Care Medicine, ESICM)联合发布的Sepsis 3.0中感染性休克诊断标准[9]。
排除标准:(1)年龄小于18周岁;(2)既往有精神障碍病史或开颅手术史;(3)有服用抗抑郁或抗癫痫药物病史;(4)存在神经系统疾病,有明确的颅内病变,如脑出血、蛛网膜下腔出血、颅脑创伤、中风、颅内感染等;(5)肝衰竭合并肝性脑病可疑;(6)妊娠;(7)颈部血管检查、头颅磁共振成像/CT及TCD检查发现异常者(如颈动脉斑块、血栓等);(8)TCD在颞窗无法探查血流信号者。
根据是否在28 d内死亡,将纳入观察的感染性休克患者分为死亡组和存活组。
1.2 临床治疗
纳入本研究的患者均按照2016年Sepsis与感染性休克治疗国际指南[10]进行治疗,即以平均动脉压达到65 mm Hg(1 mm Hg=0.133 kPa)和乳酸正常化作为初始复苏的目标。
1.3 观察指标
1.3.1 一般资料
记录感染性休克患者一般资料特征,既往病史、急性生理和慢性健康状况评估(acute physiology and chronic health evaluation Ⅱ,APACHEⅡ)评分、Sepsis相关序贯性器官衰竭评分(sequential organ failure,SOFA)、是否使用镇静镇痛药物以及是否行连续肾脏替代治疗(continuous renal replacement therapy,CRRT)。
1.3.2 血流动力学管理指标
记录感染性休克患者收入重症医学科即刻(t0h)和复苏治疗6 h(t6h)后动脉和中心静脉血气指标,如乳酸(lactic acid,Lac)、中心静脉-动脉二氧化碳分压差值(central venous-to-arterial carbon dioxide difference,Pcv-aCO2),中心静脉血氧饱和度(central venous oxygen saturation,ScVO2)、氧分压(oxygen partial pressure,PaO2)、二氧化碳分压(partial pressure of carbon dioxide,PaCO2)、乳酸清除率、中心静脉压(central venous pressure,CVP),以及复苏6 h后的去甲肾上腺素用量、复苏液体总量和尿量。所有患者在入室1 h内完成重症心脏超声检查,测量心输出量(cardiac output,CO)、左心室射血分数(left ventricular ejection fraction,LVEF)、下腔静脉呼气末绝对直径(inferior vena cava diameter,IVCD)及下腔静脉变异度(inferior vena cava collapse index,IVC-CI)。重症心脏超声筛查均由接受中国重症超声研究组培训合格的重症医学医师完成。
1.3.3 器官功能和Sepsis生物标志物
记录感染性休克患者入室后6 h内的血常规指标、肝肾功能指标、凝血常规指标、降钙素原(procalcitonin,PCT)、神经元特异烯醇化酶(neuron specific enolase,NSE)、中枢神经特异蛋白S100β。
1.3.4 TCD监测
使用TCD(深圳德力凯,EMS-9A双通道,1.6 MHz TCD探头)经颞窗获取感染性休克患者初始复苏治疗6 h后的双侧大脑中动脉(middle cerebral arterys,MCA)血流频谱,测量收缩期血流速度(the systolic velocity of middle cerebral arterys,VsMCA)、舒张期血流速度(the diastole velocity of middle cerebral arterys,VdMCA)、平均血流速度(the mean velocity of middle cerebral arterys,VmMCA)和搏动指数[pulsatility index,PI,PI=(VsMCA-VdMCA)/ VmMCA],并计算脑血流指数(cerebral blood flow index,CBFi, CBFi=10×MAP/1.47PI)[3](双侧MCA血流速度存在差异时,取测量值高的一侧结果并记录,如只获得一侧MCA信号,则使用相应侧的血流速度测量值)。记录MCA收缩期S1峰与S2峰是否融合,并完成动态脑血管自动调节功能评估。采用瞬时充血反应率(transient hyperemia response rate,THRR)作为评估动态脑血管自动调节功能的指标,即通过压颈试验造成MCA血流速度稳定下降到基线值30%~50%并维持3 s,解除压迫,观察血流速度与基线血流速度的比值。当THRR>1.09时,认为具有动态脑血管自动调节功能;反之,则认为是动态脑血管自动调节功能受损[11]。
1.3.5 脑氧饱和度监测
使用无创rSO2监测仪(美国CASMED, FORE-SIGHT)床旁持续采集感染性休克患者初始复苏后的大脑前额rSO2值(大号探头,探测深度为颅骨下2.5 cm)。其原理是基于近红外光谱技术,应用比尔-朗伯定律,通过氧合血红蛋白和脱氧血红蛋白对两种波长光的差异吸收,使用减法算法消除浅层信号影响,估计组织深部的平均血红蛋白饱和度[12]。探测前先用消毒纸巾擦拭患者前额,保证前额皮肤清洁干燥,将脑氧探头贴片固定于患者前额位置,待仪器平衡5~10 min稳定后,连续记录至少1 h rSO2值,包括rSO2的平均值、最小值和最大值,记录rSO2平均值<60%、<55%、<50%的患者例数[13]。
1.4 统计学处理
采用SPSS 24.0软件对数据进行处理。连续性变量资料中符合正态分布或近似正态分布的计量资料采用均数±标准差表示,两样本间比较采用独立样本t检验;不符合正态分布的计量资料采用中位数(四分位数间距)表示,两样本间的比较采用秩和检验。计数资料组间比较采用卡方检验,理论频数<5时采用连续校正法,理论频数<1时采用确切概率法。使用Logistic回归分析28 d死亡的独立预测因素。使用Kaplan-Meier曲线进行生存分析。P<0.05为差异有统计学意义。
2 结果
2.1 一般临床资料
共纳入51例符合入选和排除标准的患者,男性31例,女性20例,平均年龄(53±13)岁。22例患者在28 d内死亡,28 d死亡率为43%。死亡组患者的SOFA评分(P=0.007)、入室APACHEⅡ评分(P=0.026)以及高峰APACHEⅡ评分(P<0.001)均高于存活组(表1)。
2.2 大循环血流动力学相关指标比较
51例感染性休克患者入重症医学科即刻(t0h)及复苏治疗6 h(t6h)后的动脉及中心静脉血气分析显示,与存活组相比,死亡组患者初始复苏治疗6 h后的氧合指数更低(P=0.047),且复苏后Pcv-aCO2更高(P=0.044)。比较两组重症心脏超声指标发现,CO、LVEF、IVCD及IVC-CI均无统计学差异(P均>0.05)(表2)。
2.3 器官功能与实验室指标比较
死亡组患者的血小板计数低于存活组(P=0.049),余指标及Sepsis相关生物标志物差异均无统计学意义(P均>0.05)(表3)。
2.4 经颅多普勒监测
51例感染性休克患者中,22%(11/51)出现动态脑血管自动调节功能受损(即THRR<1.09),死亡组明显高于存活组(36%比10%,P=0.025)(表4)。
2.5 脑氧饱和度监测
51例感染性休克患者中,死亡组rSO2均值较存活组更低[(56±7)%比(60±7)%,P=0.031],两组rSO2最大值及最小值无统计学差异。51例患者中,19例rSO2均值<60%,且死亡组的比例显著高于存活组(77%比41%,P=0.010)(表5)。
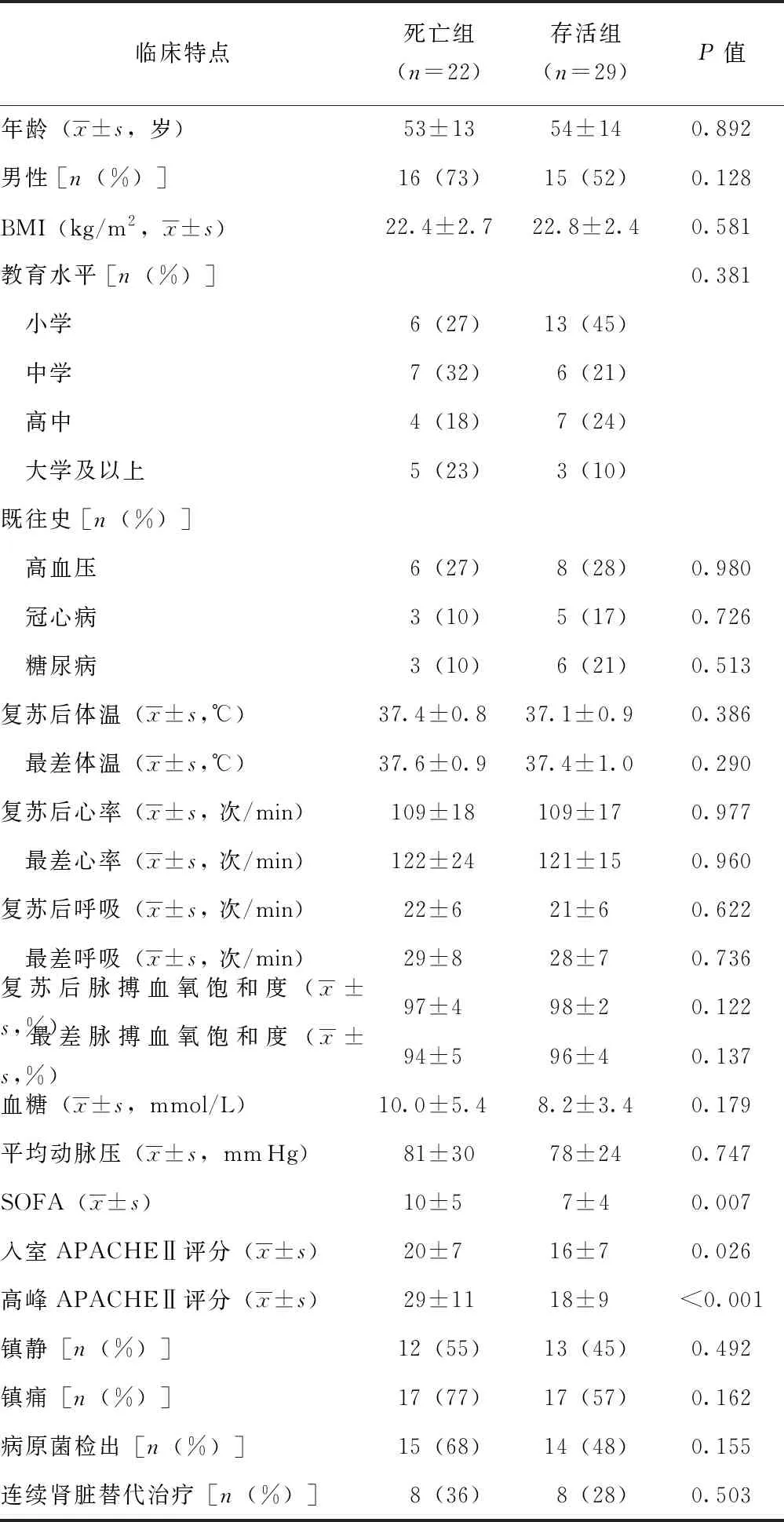
表 1 51例感染性休克患者的一般临床特点
BMI:体质量质数; SOFA:序贯性器官衰竭评分;APACHEⅡ:急性生理和慢性健康状况评估
2.6 感染性休克患者死亡危险因素的多因素分析
将表1~5中P<0.05的变量作为自变量,28 d死亡作为因变量,进行多因素Logistic回归分析,结果显示,高峰APACHE Ⅱ评分(OR=1.099,95% CI:1.009~1.196,P=0.030)、复苏6 h后Pcv-aCO2值(OR=1.320,95% CI:1.001~1.742,P=0.050)、THRR<1.09(OR=4.952,95% CI:1.130~21.7,P=0.034)、rSO2均值<60%(OR=4.817,95% CI:1.392~16.663,P=0.013)分别是预测感染性休克患者28 d死亡的独立危险因素(表6)。
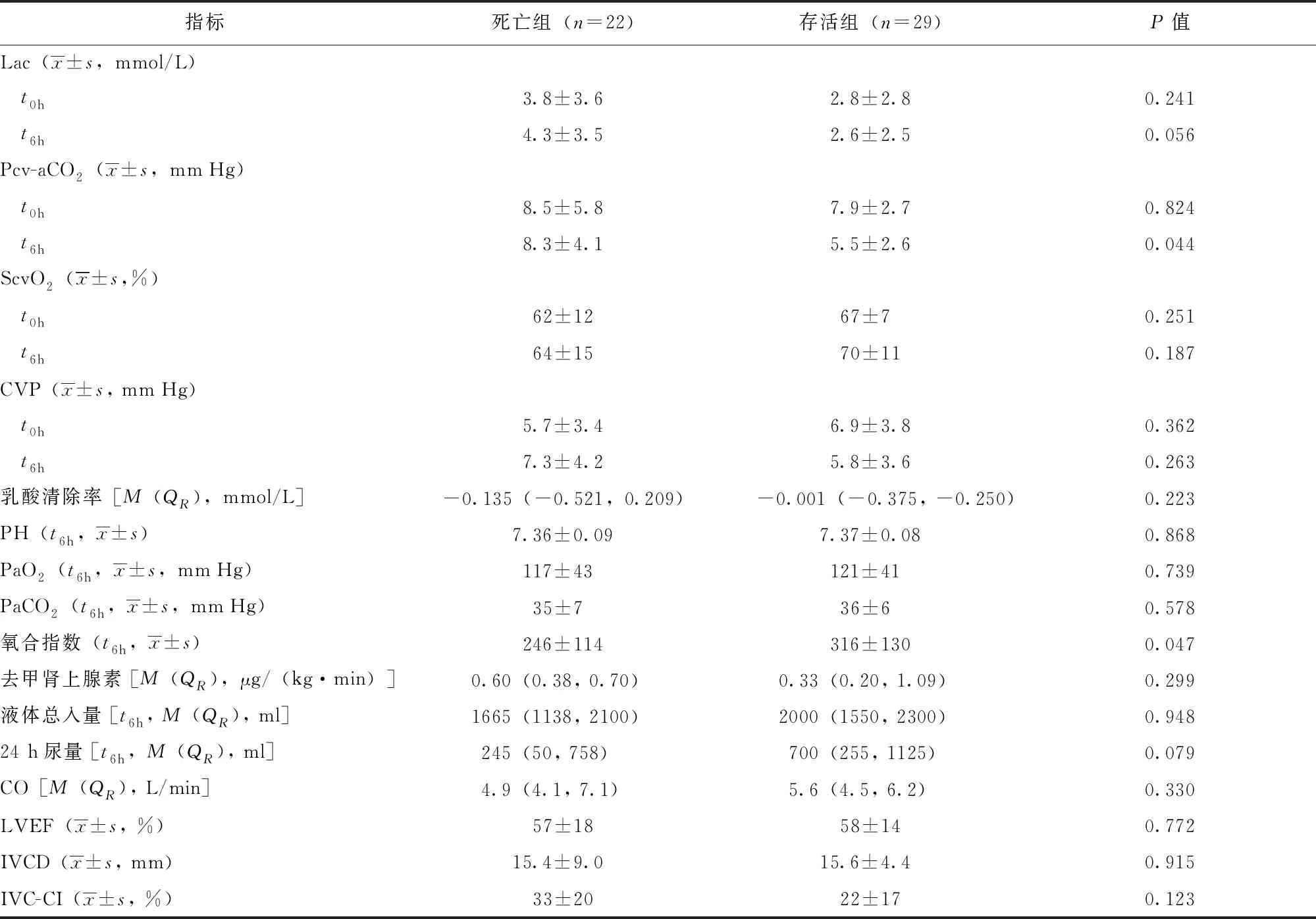
表 2 两组感染性休克患者血流动力学相关指标比较
t0h:入重症医学科即刻;t6h:入重症医学科初始复苏6 h后;Lac:乳酸;Pcv-aCO2:中心静脉-动脉二氧化碳分压差值;ScVO2:中心静脉血氧饱和度;CVP:中心静脉压;PaO2:氧分压;PaCO2:二氧化碳分压;CO:心输出量;LVEF:左心室射血分数;IVCD:下腔静脉呼气末绝对直径;IVC-CI:下腔静脉变异度
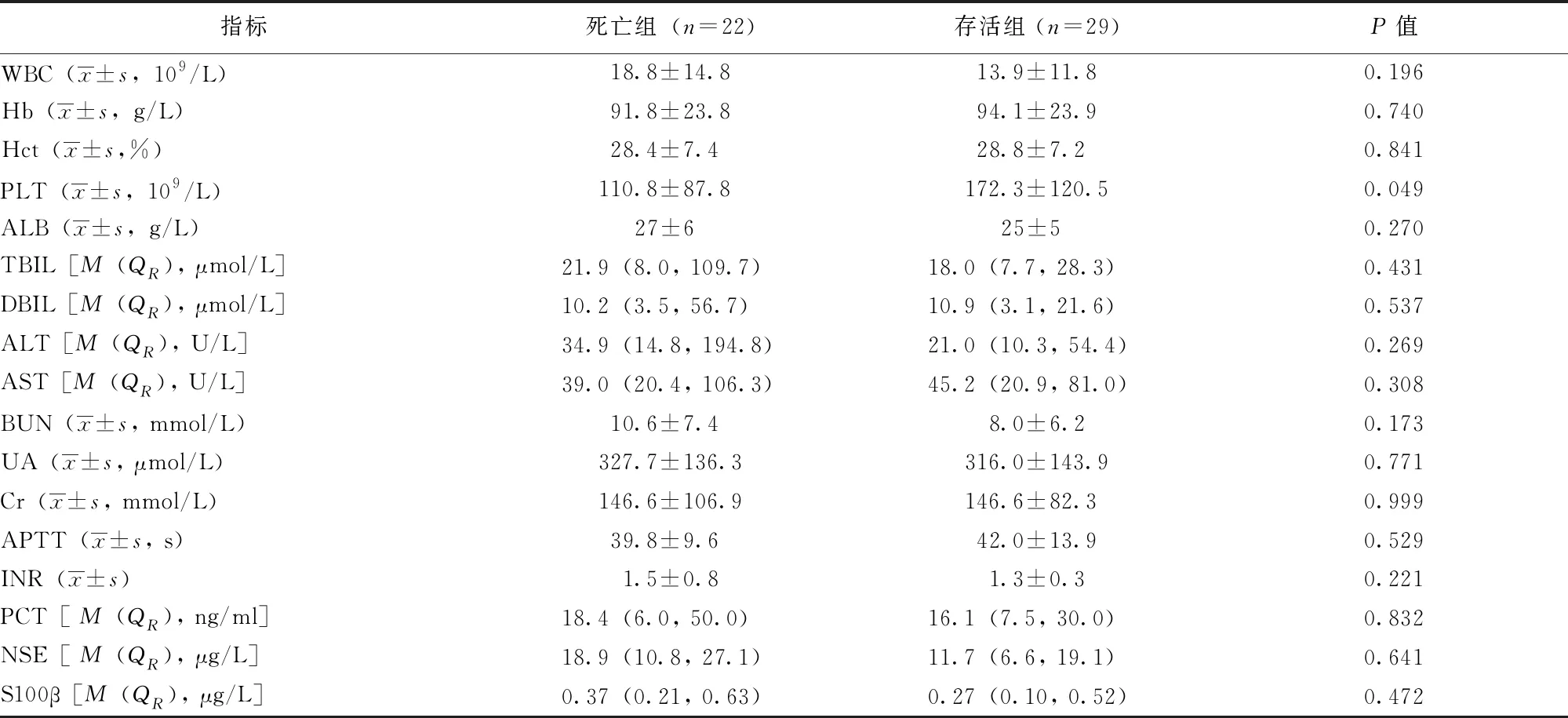
表 3 两组感染性休克患者器官功能及实验室指标比较
WBC:白细胞计数; Hb:血红蛋白;Hct:血细胞比容;PLT:血小板;ALB:白蛋白;TBIL:直接胆红素;DBIL:间接胆红素;ALT:谷丙转氨酶; AST:谷草转氨酶; BUN:尿素氮; UA:尿酸; Cr:肌酐; APTT:活化部分凝血酶原时间;INR:国际化标准比值;PCT:降钙素原;NSE:神经元特异烯醇化酶
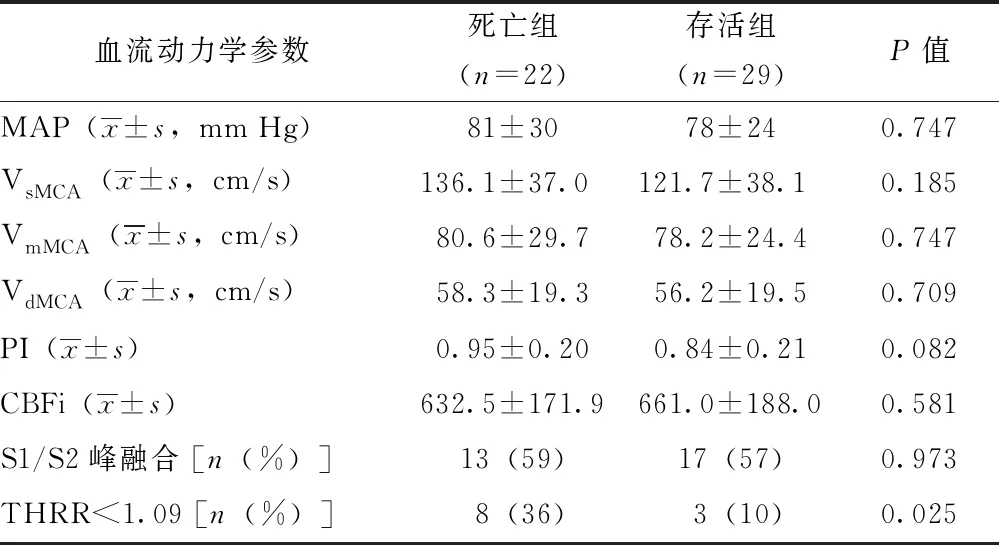
表 4 两组感染性休克患者复苏后经颅多普勒脑血流动力学参数比较
MAP:平均动脉压;VsMCA:大脑中动脉收缩期血流速度;VmMCA:大脑中动脉平均血流速度;VdMCA:大脑中动脉舒张期血流速度; PI:搏动指数; CBFi:脑血流指数;THRR:瞬时充血反应率
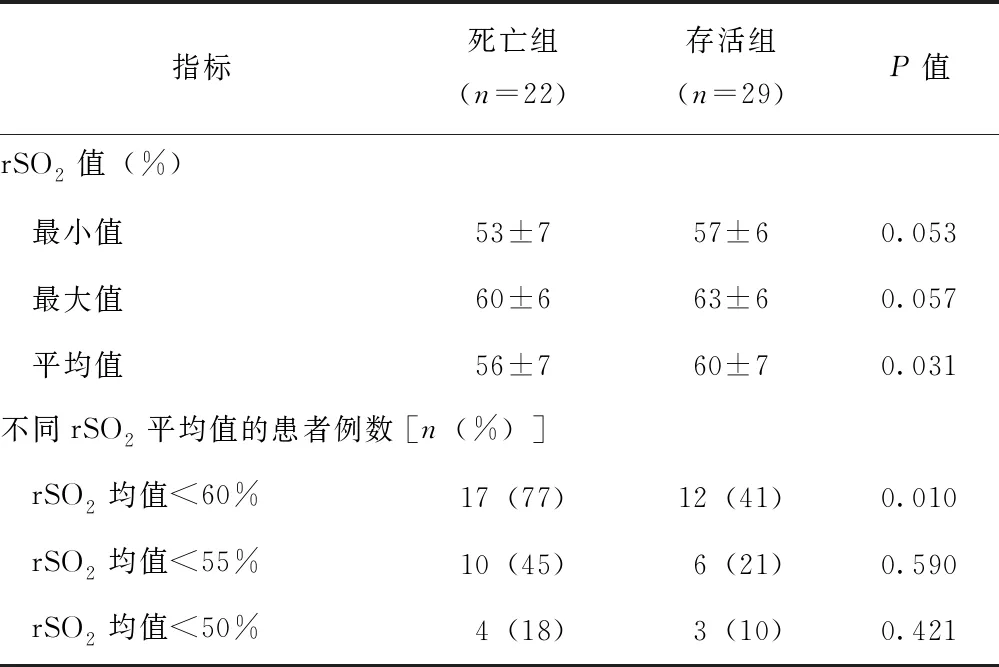
表 5 两组感染性休克患者复苏后rSO2比较
rSO2:局部脑氧饱和度
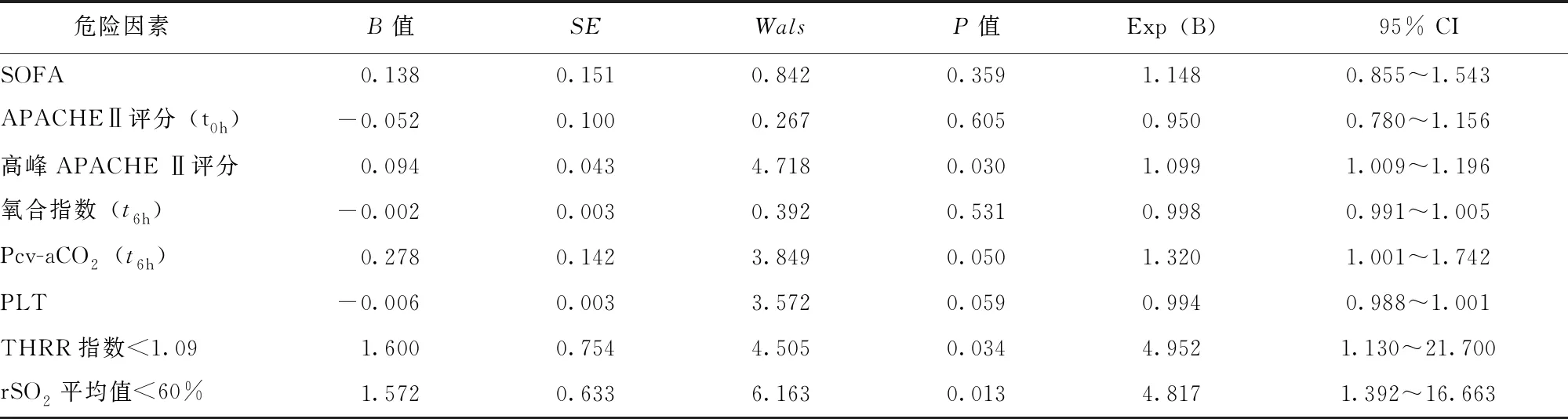
表 6 51例感染性休克患者28 d死亡危险因素的多因素分析
SOFA、APACHEⅡ、Pcv-aCO2、PLT、THRR、rSO2:同表1~5
2.7 Kaplan-Meier曲线生存分析
将rSO2≥60%作为感染性休克患者死亡的低风险因子,rSO2<60%作为高风险因子,两组间通过对数检验分析Kaplan-Meier曲线,并通过回归模型进行Log-rank检验,显示两组间差异具有统计学意义(χ2=6.775,P=0.009)(图1)。
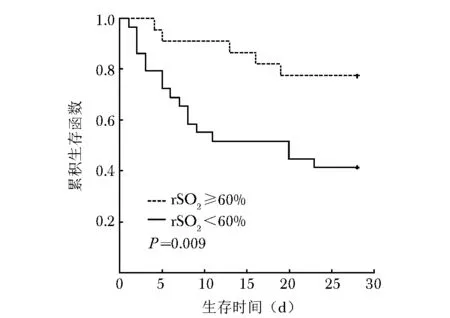
图 1 51例感染性休克患者低风险组(rSO2≥60%)和高风险组(rSO2<60%)Kaplan-Meier生存曲线分析rSO2:同表5
3 讨论
重症患者血流动力学管理的目标是保证理想的器官血流和氧输送,避免器官功能损伤[14]。脑血流动力学及脑氧代谢紊乱对感染性休克患者预后至关重要。本研究分析了51例感染性休克患者液体复苏治疗后MCA的脑血流动力学相关指标及大脑前额脑氧饱和度变化情况,结果显示,Sepsis休克患者28 d死亡率为43%,脑血管自动调节功能受损(即THRR<1.09)和rSO2均值<60%是预测感染性休克患者28 d死亡的独立危险因素,提示感染性休克患者出现脑血管自动调节功能受损及脑氧代谢失衡与不良预后密切相关。
Sepsis休克以动脉低血压、组织灌注改变和血Lac水平升高为特征,是Sepsis最严重的一种形式,其循环和细胞/代谢参数的深层次异常导致死亡率显著增加[9,15]。由于定义和诊断标准的不同,以及不同环境和国家在治疗和护理方面的差异,造成不同地区感染性休克患者28 d死亡率存在较大差异。2016年一项对针当前判断感染性休克临床标准进行的系统评估显示,感染性休克相关的粗略医院死亡率为46.5%[16]。而最近的欧洲和北美感染性休克死亡率荟萃分析显示,感染性休克患者28~30 d的死亡率为36.7%(95% CI:32.8~40.8)[17]。感染性休克死亡率高,这对早期识别不良预后的危险因素提出了挑战。
动态脑血管自动调节功能是大脑在脑灌注压发生改变时保持脑血流动力学稳定性的一种能力,是用于预防继发性缺血损伤的内在保护机制[18]。当脑血管自动调节功能受损时,伴随灌注压改变可能发生的脑缺血或脑充血改变均可导致神经损伤,进而对预后产生不利影响。动态脑血管自动调节能力有多种评估方法,THRR简便易行,床旁可重复,是评估动态脑血流调节功能的传统经典金标准。早在1997年,有学者即发现THRR消失与重型颅脑损伤患者不良预后有关[19]。对蛛网膜下腔出血患者的研究中发现,THRR预测5 d内延迟性脑缺血发生的特异度为100%,敏感度为80%(AUC=0.801, 95% CI: 0.660~0.942)[20]。目前国内外通过TCD监测评估Sepsis及感染性休克患者颅脑血流动力学的研究较少,仅在动物研究有证实。Rosengarten等[21]对内毒素诱导的大鼠休克模型采用颈动脉压迫技术测量皮质区THRR,以此评估动态脑血管自动调节功能,发现高内毒素剂量组大鼠在实验结束时缺乏对较低血压水平的自动调节补偿能力,提示内毒素休克时脑血管自动调节功能存在障碍。
本研究发现,感染性休克患者早期(液体复苏后6 h)即存在脑血管自动调节功能的明显损害(THRR<1.09),且脑血管自动调节功能受损是导致感染性休克患者预后差的原因之一。TCD能早期发现脑血管自动调节功能障碍,可为及时实施干预措施赢得更多时间,改善患者脑灌注情况,甚至达到改善预后的目的。
神经重症管理的核心是脑保护治疗,在优化脑灌注过程中评估是否存在氧供需失衡非常重要。脑氧饱和度监测是一种无创连续监测局部脑组织氧饱和度的技术,可提供多种疾病状态下处于危险状态的脑组织中氧的相关信息。John等[22]研究发现,心脏术后出现重要器官病变或死亡的患者,术中基线和平均rSO2较低,监测心脏手术患者的脑rSO2,避免rSO2严重下降,可显著减少器官功能障碍的发生。研究发现,rSO2<60%的患者心脏手术死亡率更高,且是死亡率增加的独立预测因子[23]。一项前瞻性研究发现,感染性休克幸存者入院72 h后的rSO2值明显高于死亡患者[8],提示rSO2对预后具有预测价值。
感染性休克患者初始复苏治疗后rSO2均值下降(<60%)的患者,28 d生存率亦显著降低,提示复苏过程中脑氧供与氧耗间的总体不均衡与预后较差相关。rSO2监测是局部微循环水平氧输送和利用充分的潜在替代标志物,这对Sepsis患者的rSO2持续监测提出了要求,未来应该作为感染性休克继血压、心率、呼吸、氧饱和度后的常规监测指标。然而,静态rSO2读数仅是对传感器下方组织中所有血管(静脉和动脉)平均氧饱和度的估计值,不提供关于血流和血管动力学的相对变化信息,且易受一些因素干扰[24- 25],包括外部因素(如环境温度变化)、内源性因素(如年龄、体重、体温、组织水肿、血管疾病和躁动)、改变血管张力的药物[26]以及皮肤色素沉着变化等[27]。亦有研究指出,rSO2监测数据与神经预后或死亡率的相关性有限,虽然rSO2有望测量区域脑组织氧饱和度变化,但尚缺乏显示结局改善的数据,这限制其广泛实施,需要未来进一步探讨其在重症领域的应用价值[28]。
本研究存在一定局限性,首先,TCD具有操作者依赖性,受操作者技术的影响,而且老年患者,尤其是老年女性,会出现颅骨增厚、钙化等情况,影响颞窗血管探查,影响总体评估。其次,本研究仅评估了初始复苏治疗6 h后的颅脑血流动力学、rSO2变化,未进行动态复查。最后,因为研究的样本量较小,不能很好地反映总体人群情况,且研究为观察性研究,未来,可能还需要大样本随机对照临床试验进一步验证。
感染性休克患者死亡率高,动态脑血管自动调节功能障碍(THRR<1.09)与rSO2均值<60%是28 d死亡率增加的独立预测因子。以脑血流动力学和脑组织氧饱和度为目标导向的管理是感染性休克器官血流动力学管理的重要内容。

