灌注压的维持:缩血管药物如何选择?
管向东,刘紫锰
中山大学附属第一医院重症医学科,广州 510080
休克是临床常见的重症状态。1/3的ICU患者经历过休克的打击,约20%的ICU患者死于休克[1]。休克状态下,多种原因导致机体血管张力、循环血容量或心脏收缩/舒张功能的急剧变化,组织灌注不足,细胞代谢紊乱和器官功能受损。改善灌注压是休克复苏治疗的基本目标之一。要维持器官足够的灌注压,必须有与之匹配的心输出量、血容量以及血管负荷。缩血管药物是休克复苏中改善血管张力、维持灌注压的重要手段。临床上判断灌注压是否足够需要结合大循环血流动力学指标及微循环灌注指标来综合评估。其中,血压是评估灌注压的关键指标[2]。
理想的缩血管药物,不仅要能迅速提高血压,还应在维持灌注压的同时,改善心、脑、肾脏和肠道等重要内脏器官的血流灌注,纠正组织低氧,防止多器官功能障碍综合征的发生[3]。根据受体作用机制的不同,缩血管药物可分为拟交感神经药、血管加压
素及其类似物和血管紧张素Ⅱ。大量临床实践及研究证实,这些常用缩血管药物如拟交感药物、血管加压素及其类似物有确切的改善休克患者血压的作用。但各种药物在维持休克患者灌注压、改善器官功能等方面的有效性及安全性存在一定差异,也是近年来血流动力学治疗的研究热点之一。缩血管药物的使用可改善血压,一定程度上有利于改善灌注,但血压提高并不意味着组织灌注就一定得到改善。与此同时,大量动脉的收缩可能会加重微循环缺血,对组织灌注产生不利影响。
本文从缩血管药物的药理特性、临床应用及研究进展等方面进行总结,为临床医师在休克治疗中如何选择缩血管药物提供依据。
1 拟交感神经药
1.1 药理特性
拟交感神经药,又称儿茶酚胺类药,是临床上最常用的一类血管活性药物。儿茶酚胺类药物通过激动α或β受体起作用。α和β受体可分为α1、α2和β1、β2,不同的α和β受体类型分布在机体的不同部位,发挥各自的生理作用。儿茶酚胺类药物提高灌注压的作用,主要通过两方面受体作用实现:一方面通过激动血管平滑肌上的α1受体使血管收缩,进而引起血管阻力及静脉回流增加;另一方面通过激动心脏β1受体,增加心肌收缩力以及心率[4]。不同的儿茶酚胺类药物对α或β受体特异性不同(表1),从而产生不同的血流动力学药理作用(表2)。
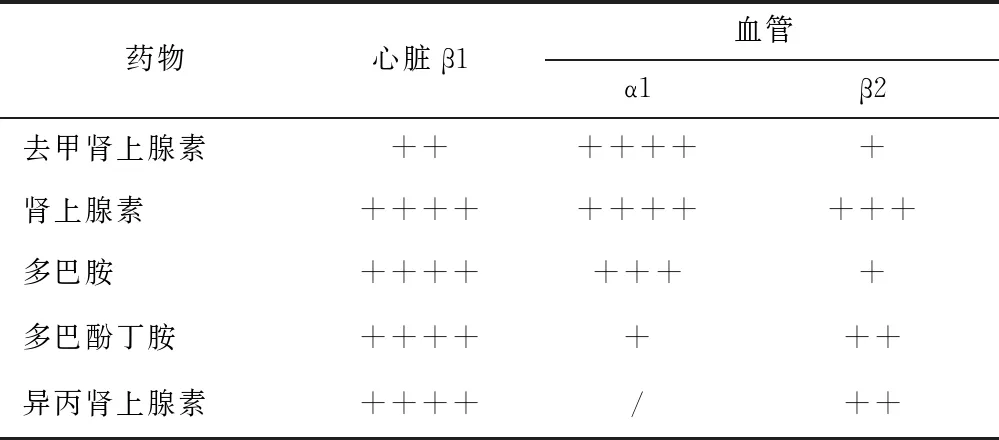
表 1 拟交感神经药物的受体药理特性
1.2 临床应用研究进展
儿茶酚胺类药物中去甲肾上腺素、肾上腺素及多巴胺是休克治疗中维持灌注压的主要传统药物。近年来,许多研究探讨了此3种药物在休克治疗中的优劣及选择。
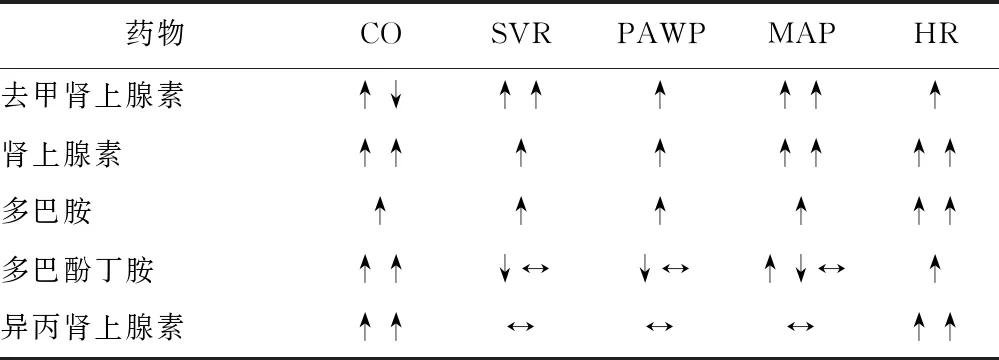
表 2 拟交感神经药物的血流动力学作用
↑代表增加;↓代表下降;↔代表不变;CO:心输出量; SVR:体循环阻力; PAWP: 肺动脉楔压; MAP:平均动脉压; HR:心率
2010年,De Backer等[5]在NEnglJMed上发表了著名的SOAPⅡ研究,该研究是一项比较多巴胺和去甲肾上腺素在休克治疗中应用的多中心、随机、对照临床研究。该研究共纳入了1679例休克患者,其中858例使用多巴胺,821例使用去甲肾上腺素。结果显示,两组的主要研究终点(28 d病死率)差异无统计学意义。但在并发症方面,多巴胺组心律失常的发生率显著高于去甲肾上腺素组;亚组分析结果显示,心源性休克亚组多巴胺组的病死率显著高于去甲肾上腺素组。除此之外,感染性休克的系列临床研究及相关Meta分析研究结果显示,去甲肾上腺素组的病死率较多巴胺组低,心律失常等不良事件发生率低。因此,目前包括系列指南在内的共同认识与临床推荐为:发生严重低血压时,无论是未分类的休克、分布性休克还是心源性休克,去甲肾上腺素均是维持灌注压首选的血管活性药物。不少研究进一步探讨了去甲肾上腺素改善器官组织灌注以及微循环的作用。在感染性休克患者中,去甲肾上腺素可提高冠状动脉的灌注,且在改善动脉负荷同时不增加静脉阻力,通过增加可回心血量增加心输出量,从而提高器官组织灌注[6- 7]。与非感染性休克患者相比,去甲肾上腺素可改善感染性休克患者的肾脏灌注,增加尿量[8],但在微循环及氧代谢方面,使用去甲肾上腺素维持不同的血压水平对舌下黏膜微循环、胃黏膜PH、动静脉二氧化碳分压差等微循环指标的改善作用无明显差别[9]。另外,去甲肾上腺素使用时机、合适剂量及血压维持目标等也是近年来讨论的热点。目前研究发现,在感染性休克患者中,早期使用去甲肾上腺素有利于改善灌注压、心输出量及组织微循环[10]。使用过大剂量去甲肾上腺素,可能会造成微循环障碍、心输出量下降、心律失常等不良反应[10]。回顾性研究发现,在感染性休克患者中,去甲肾上腺素剂量超过1 μg/(kg·min)患者的病死率为90%,而整体患者病死率为40%,但目前尚缺乏证据证实去甲肾上腺素的合适剂量范围及其最大安全剂量[11]。因此,虽然去甲肾上腺素是目前治疗休克的首选缩血管药物,但其临床应用仍有许多需要思考及探讨的问题。
肾上腺素同样具有强烈的α和β受体激动作用。研究发现,在心脏手术后低血压或急性心肌缺血心源性休克患者中,去甲肾上腺素联用肾上腺素,较联用多巴酚丁胺更能显著增加心输出量和平均动脉压,而心律失常较少发生[3]。在感染性休克的临床研究中,发现肾上腺素与去甲肾上腺素两组病死率无差异。 因此,目前认为,在较大剂量去甲肾上腺素下仍难以维持灌注压时,肾上腺素可作为去甲肾上腺素的首选替代药物[3- 4]。
既往研究认为,小剂量多巴胺可通过激动多巴胺受体产生增加尿量、保护肾脏的作用。但随后的动物研究和临床研究均证实,小剂量多巴胺虽可增加尿量,但不能改善肌酐清除率及预防急性肾衰竭的发生。值得提醒的是,目前不推荐采用小剂量多巴胺保护肾功能[3- 4]。在感染性休克中,指南推荐仅在极少数患者(如心律失常风险极小,且表现为绝对或相对心动过缓的患者)中建议使用多巴胺作为去甲肾上腺素的替代药物。
2 血管加压素及其类似物
2.1 药理特性
血管加压素是由下丘脑合成的九肽物质。由于人体合成的血管加压素含有精氨酸,因而也称之为精氨酸加压素,并以此区别于人工合成的血管加压素类似物[12]。目前得到证实的血管加压素受体包括5个亚型,分别是V1受体、V2受体、V3受体、缩宫素受体和purinergic受体,各受体的分布及相关功能详见表3。血管加压素V1受体的激动,能使皮肤、骨骼肌、肠系膜血管收缩,使血流从非重要器官向重要器官转移,这是血管加压素维持灌注压的主要受体机制[13]。

表 3 血管加压素各受体亚型的分布及功能
2.2 临床应用及研究进展
感染性休克患者体内血管加压素的浓度,随着病情的进展发生变化。研究表明,在初始阶段,患者体内血管加压素浓度升高,但随着感染性休克的进展,浓度会明显下降,此现象被称为“相对性血管加压素缺乏”[13]。这是血管加压素应用于感染性休克的重要理论基础。近年来,血管加压素及其类似物应用于感染性休克维持灌注压的研究,引起广泛讨论和关注。
2008年发表在NEnglJMed的VASST研究,是迄今为止关于血管加压素治疗感染性休克临床系列研究中样本量最大的随机对照研究。该研究显示,在较轻的感染性休克患者中,小剂量血管加压素组的28 d病死率较去甲肾上腺素组下降25.6%,与重症感染性休克组有显著统计学差异,提示小剂量血管加压素在治疗感染性休克时,休克较轻的患者效果可能更显著,早期使用可能较晚期使用效果更好[14]。2016年“拯救Sepsis运动”指南中推荐,0.01~0.03 u/min血管加压素可用于减少感染性休克患者的去甲肾上腺素用量[15]。
血管加压素是非受体选择性药物。血管加压素激动V1受体可产生强大的缩血管作用,但血管加压素对其他受体类型的激动,可能会产生许多不利于休克复苏的影响,如组织水肿加重、血管通透性增加等。因此高选择性V1受体激动的血管加压素类似物如特利加压素、selipressin在感染性休克中的应用引起了更多关注[16]。特利加压素为一种临床上广泛使用的加压素类似物,是高选择性V1受体激动剂,与精氨酸加压素相比具有更高的受体选择比(2.2∶1)。2018年6月,本研究团队发表了一项关于特利加压素在感染性休克应用的多中心、双盲、随机对照临床研究报告,该研究共纳入了617例来自中国11个省份的21例ICU感染性休克患者,探讨了特利加压素与去甲肾上腺素作为首选血管活性药物在灌注压维持效率、 28 d病死率、器官功能保护及并发症等方面的差异。结果显示,特利加压素组与去甲肾上腺素组的28 d病死率差异无统计学意义,特利加压素与去甲肾上腺素均能明显改善感染性休克患者的第7天序贯性器官衰竭评分(sequential organ failure assessment, SOFA),但特利加压素组的指端缺血及严重腹泻的发生率值得关注[17]。该研究首次探讨了特利加压素作为首选血管活性药物用于感染性休克的效果,在28 d病死率及SOFA评分改善方面与去甲肾上腺素相仿,研究中使用的特利加压素剂量可为目前临床上和后续临床研究中药物剂量的选择提供参考。
血管加压素及其类似物用于维持感染性休克患者灌注压时,另一个关注点在于其是否对肾功能有保护作用。2017年发表在JAMA上的VANISH研究,以探讨血管加压素保护感染性休克患者肾功能为主要研究目标。研究结果未能证实早期血管加压素的使用能减少肾衰竭的发生,但早期血管加压素使用可减少肾脏替代治疗的时间[18]。本研究团队关于特利加压素在感染性休克应用的研究事后分析结果显示,特利加压组第5天和第7天的肌酐水平明显低于去甲肾上腺组[17]。然而,血管加压素及其类似物是否可降低感染性休克患者的肾衰竭发生和减少肾脏替代治疗仍需更多研究证据证实。
血管加压素及其类似物维持灌注压的受体机制不同于传统的儿茶酚胺类药物。因此有专家认为,在难治性休克或需要大剂量去甲肾上腺素用量维持灌注压时,首先选择血管加压素作为二线血管活性药物可能较选择肾上腺素或多巴胺更有利于降低去甲肾上腺素的用量和灌注压的维持[19]。
血管加压素及其类似物对器官组织灌注及微循环影响的研究较少,结论不一。有研究发现,特利加压素较后叶加压素和去甲肾上腺素更能改善肾脏皮质与髓质的血流分布,改善髓质缺血,从而改善肾功能[20]。既往认为特利加压素可能会引起肠道血管收缩从而加重肠缺血,但最新的动物研究发现特利加压素与去甲肾上腺素相比并不加重肠缺血,两者在有效维持血压的同时可改善肠道微循环[21]。总体来说,血管加压素及其类似物对器官灌注的影响仍需大量研究进一步探讨。
3 血管紧张素Ⅱ
3.1 药理特性
人体内产生缩血管作用的3大系统分别是儿茶酚胺-交感神经系统、血管加压素系统和肾素-血管紧张素系统。肾素是一种丝氨酸蛋白酶,可介导血管紧张素原转化为血管紧张素Ⅰ。血管紧张素Ⅰ通过被激活血管紧张素转换酶转化为八肽血管紧张素Ⅱ。血管紧张素Ⅱ作用于血管紧张素受体Ⅰ产生缩血管作用。由此可见,血管紧张素Ⅱ是肾素-血管紧张素系统中的关键最后活性产物,其直接作用于血管紧张素受体Ⅰ发挥缩血管作用。这是血管紧张素Ⅱ用于维持休克患者灌注压的主要受体机制[22]。
3.2 临床应用及研究进展
在Sepsis和一些重症状态下,研究发现体内肾素-血管紧张素系统会出现失调现象,主要表现为血管紧张素转换酶活性下降、血管紧张素Ⅱ合成减少、血管紧张素受体合成下降和敏感性下调等。这是在休克时应用血管紧张素Ⅱ的重要理论基础[22]。自从20世纪30年代血管紧张素Ⅱ被人工合成以来,陆续有一些研究探讨了其用于休克的灌注压维持,但数据匮乏。近年来,随着对肾素-血管紧张素系统认识更加深入,血管紧张素Ⅱ用于各种类型的休克如心源性休克、分布性休克或未明确类型休克的研究越来越多。特别是2017年发表在NEnglJMed上的血管紧张素Ⅱ用于血管扩张性休克的Ⅲ期临床研究引起了广泛关注。该研究结果显示,血管紧张素Ⅱ能提高使用高剂量传统血管活性药物后仍难以维持的灌注压[23]。根据这一研究结果,美国食品药品监督管理局批准血管紧张素Ⅱ应用于分布性休克的治疗。但血管紧张素Ⅱ维持灌注压的作用,在众多血管活性药物中的优劣如何,仍需更多有力的数据证实。
4 小结
缩血管药物是休克复苏治疗中维持灌注压的重要治疗选择,其中传统的儿茶酚胺类药物仍是目前最常用的维持血压、改善灌注压药物,去甲肾上腺素是其首选。血管加压素能有效维持休克患者灌注压,是复苏治疗中血管活性药物的选择之一。血管紧张素Ⅱ用于休克的治疗,是否较其他缩血管药物更有优势仍需进一步探讨。根据不同的休克类型、病因及作用机制选择合适的缩血管药物,对优化血流动力学治疗、改善组织灌注及减少不良反应尤为重要。

