肾脏叶间动脉阻力指数对Ⅰ型心肾综合征的诊断价值
林 霖,郭 凯,杨 萌,王冠男
1民航总医院超声医学科,北京 1000202中国人民解放军陆军总医院急诊科,北京 1000103中国医学科学院 北京协和医学院 北京协和医院超声医学科,北京 1007304首都医科大学附属北京胸科医院心脏中心,北京 101149
心脏和肾脏可相互作用,二者任一功能损害均可影响另一器官,从而导致心、肾功能共同损伤,增加疾病的治疗难度。世界急性透析质量会议专家共识于2010年定义了心肾综合征(cardiorenal syndrome,CRS),并将其分为5种亚型[1]:Ⅰ 型为急性CRS,是指急性心功能不全(acute heart failure,AHF)引起的急性肾损伤(acute kidney injury,AKI);Ⅱ型为慢性CRS,是指慢性心力衰竭(chronic heart failure,CHF)导致的肾功能不全(chronic renal failure,CRF)的过程;Ⅲ型为急性肾心综合征,是指急性缺血性肾损伤造成的急性心脏功能损害;Ⅳ型为慢性肾心综合征,是指慢性肾功能不全导致的慢性心力衰竭和冠脉粥样硬化等疾病;Ⅴ型为全身继发性心肾损害,主要为全身性损伤如Sepsis休克引起的心肾功能同时损害[2]。Ⅰ型CRS发病率呈逐年升高趋势,若能早期发现、早期治疗,可降低CRS患者的病死率[3]。
CRS患者的肾血管常处于高阻力状态[4],肾动脉阻力高低可由肾动脉阻力指数(resistance index,RI)直接反映,肾动脉主干进入肾脏后分支为段动脉,在肾锥体底部形成弓状动脉,弓状动脉又发出小叶间动脉入肾皮质。肾动脉RI指肾内主要分支血管(段动脉、弓动脉、小叶间动脉)的RI值,正常值不超过0.70。 多种研究表明肾脏病变时,肾动脉阻力变化最显著的并非主肾动脉而是分支较细的小叶间动脉,这可能是由于肾脏小叶间动脉更靠近肾实质,更容易反映肾脏血流灌注的变化,与肾功能损伤关系密切。尽管可选择段动脉或弓动脉测定RI,但是由于测量点向动脉远端移动时,动脉收缩期流速下降更快,而在肾脏小叶间动脉处测量RI的值较为稳定,可重复性高,故在临床中一般倾向于在此段进行测量。肾动脉RI作为一种新型诊断手段可实时监测患者的肾脏血流动力学变化,与传统诊断方法互补,用于辅助诊断心力衰竭导致的肾脏功能损伤,具有无创、快捷且重复性好等优点。本研究旨在探讨肾动脉RI对急性心力衰竭患者发生Ⅰ型CRS的诊断应用价值,为CRS的诊治提供新的策略。
1 资料与方法
1.1 研究对象
选取2017年6月1日至2018年3月1日在民航总医院急诊综合病房住院治疗并诊断为Ⅰ型CRS的患者作为CRS组,同期诊断为单纯急性心力衰竭的患者作为对照组。
CRS组纳入标准:同时符合急性心力衰竭和AKI的诊断标准。(1)急性心力衰竭诊断标准的主要标准:阵发性夜间呼吸困难或端坐呼吸;肺部啰音;胸片示心影扩大或肺淤血表现;第三心音奔马律;颈静脉怒张;静脉压升高。次要标准:体位性水肿;活动后呼吸困难;肝脏肿大;肺活量降低。符合2项主要标准,或符合1项主要标准及2项次要标准者可确诊[5]。(2)AKI诊断标准:符合2012年3月提高肾脏病整体预后工作组指南定义的AKI诊断标准,48 h内血肌酐水平升高≥26.5 μmol/L,或增加至基线的1.5倍,且明确或经推断其发生在之前7 d之内,或尿量<0.5 ml/(kg·h),持续6 h[6]。
CRS组排除标准:(1)患有慢性肾功能不全或有移植肾病史;(2)并发严重免疫功能障碍、肿瘤近期行化疗治疗或使用免疫抑制剂;(3)因使用造影剂或其他药物引起的AKI;(4)既往合并急性或慢性系统性疾病,如严重Sepsis/休克等应用血管活性药物、急性呼吸窘迫综合征/慢性阻塞性肺疾病等影响通气或需要呼吸机辅助呼吸;(5)肾动脉超声发现肾动脉狭窄、主动脉狭窄或既往诊断为大动脉炎等影响血管顺应性;(6)资料不全或不能配合的患者。
对照组纳入标准:同期入院诊断为单纯急性心力衰竭、一般资料完整且符合上述排除标准的患者。
1.2 肾动脉阻力指数测量方法
入组后6 h内即由超声医学科医师采用飞利浦IU 22彩色超声诊断仪(探头频率5 MHz)进行肾动脉超声检查。嘱受检者侧卧位,取肾脏冠状切面,调整合适的scale,以清晰显示各级肾动脉。肾脏小叶间动脉走行于肾锥体之间入肾皮质,脉冲多普勒取样框置于肾椎体两侧的肾脏小叶间动脉内,取样容积2 mm,声束与血管夹角<60°,通过测量小叶间动脉收缩期峰值流速(peak systolic velocity,PSV)、舒张末期流速(end diastolic velocity,EDV),得到小叶间动脉RI=(PSV-EDV)/PSV。分别测量每例患者两个肾脏的小叶间动脉RI,每次取频谱时获得至少3个有效且连续的多普勒频谱,以两侧肾脏小叶间动脉RI的平均值代表每例患者的肾动脉RI。
1.3 收集临床资料及实验室检查数据
统计两组患者的年龄、性别、心功能不全的诱因、心功能分级、肌酐、收缩压、氨基末端脑钠尿肽(N-terminal pro-brain natriuretic peptide,NT-proBNP)、左心室射血分数(M型),肾小球滤过率根据MDRD简化公式进行估算:肾小球滤过率[ml/(min·1.73 m2)]=186×(肌酐)-1.154×(年龄)-0.203×(0.742女性)[7]。NT-proBNP及肌酐测定在患者入院后第1、3、5天清晨空腹条件下抽取静脉血,NT-proBNP采用Roche生产的Cobas 601系统进行测定,所用的试剂由Roche公司提供,肌酐测定采用酶法。
1.4 统计学处理
采用SPSS 19.0软件进行统计学分析。计数资料采用频数(百分比)表示,组间比较采用卡方检验或Fisher精确检验。符合正态分布的计量资料以均数±标准差表示,组间比较采用t检验;不符合正态分布的计量资料采用中位数(四分位数间距)表示,组间比较采用秩和检验。采用受试者工作特征(receiver operating characteristic,ROC)曲线评价肾动脉RI对Ⅰ型CRS的预测价值,心力衰竭患者发生Ⅰ型CRS的影响因素采用Logistic回归分析。以P<0.05为差异具有统计学意义。
2 结果
2.1 一般临床资料
共20例符合纳入和排除标准的Ⅰ型CRS患者入选本研究(CRS组),其中男性13例,女性7例,平均年龄(68.9±17.6)岁。同期诊断为单纯急性心力衰竭且资料完整的患者20例(对照组),其中男性15例,女性5例,平均年龄(65.5±10.1)岁。两组患者心力衰竭诱因、心功能分级差异无统计学意义(P均>0.05),CRS组患者的28 d病死率(25%)大于对照组(5%),然而P>0.05,差异无统计学意义(表1)。
2.2 相关实验室检查及临床用药
两组患者的左心室射血分数、心功能分级比较差异无统计学意义(P均>0.05),CRS组患者的肾动脉RI、NT-proBNP、肌酐水平及呋塞米剂量均高于对照组,而肾小球滤过率低于对照组,两组差异具有统计学意义(P均<0.05)(表2)。
2.3 ROC曲线对Ⅰ型心肾综合征的预测价值
肾动脉RI对Ⅰ型CRS预测价值的ROC曲线下面积为0.78(95% CI:0.606~0.951,P=0.005),取最佳截点值肾动脉RI为0.70,诊断敏感度和特异度分别为0.800和0.800(图1)。
2.4 亚组分析
根据最佳截点值RI=0.70将所有入组患者进行分组,高阻组(RI>0.70)患者24例,低阻组(RI≤0.70)患者16例,高阻组患者的年龄、脉压差、NT-proBNP、心功能分级和肌酐值均显著高于低阻组,肾小球滤过率显著低于低阻组,差异具有统计学意义(P均<0.05)。两组患者的体质量指数、心率、呋塞米剂量差异无统计学意义(表3)。
2.5 Ⅰ型心肾综合征危险因素分析
对患者出现Ⅰ型CRS影响因素进行单因素分析,以是否发生Ⅰ型CRS为因变量,以性别、肾动脉RI、年龄、心功能分级、脉压差、既往是否高血压、NT-proBNP、呋塞米剂量、肾小球滤过率等单因素分析有意义的变量为自变量,进行多因素Logistic回归分析,进入模型的有肾动脉RI、年龄、呋塞米剂量、肾小球滤过率,结果显示肾动脉RI增高、年龄、呋塞米剂量及肾小球滤过率减低均是心力衰竭患者发生Ⅰ型CRS的独立危险因素(P均<0.05)(表4)。
3 讨论
本研究发现,心力衰竭发生I型CRS患者的肾动脉RI显著高于对照组,且利用ROC曲线评价肾动脉RI值对心力衰竭患者Ⅰ型CRS预测价值的曲线下面积为0.78,取最佳截点值0.70,其敏感度为80%,特异度为80%。说明肾动脉RI对心力衰竭患者发生Ⅰ型CRS具有良好的预测价值。Logistic回归分析模型显示,肾动脉RI增高、年龄、呋塞米剂量及肾小球滤过率减低是Ⅰ型CRS的危险因素。
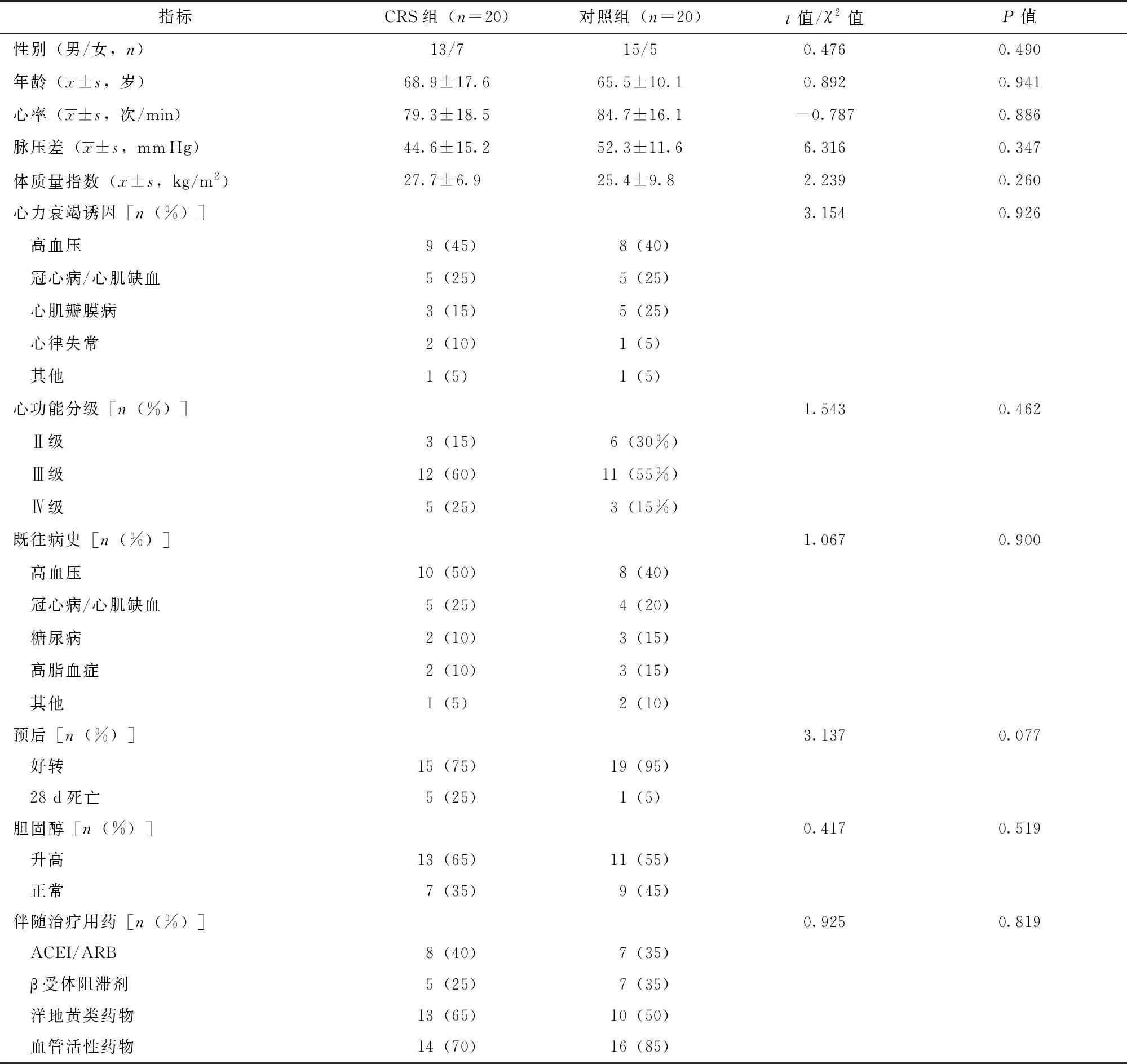
表 1 Ⅰ型CRS患者与单纯急性心力衰竭对照患者一般临床资料比较
CRS:心肾综合征;ACEI:血管紧张素转换酶抑制剂;ARB:血管紧张素受体阻滞剂
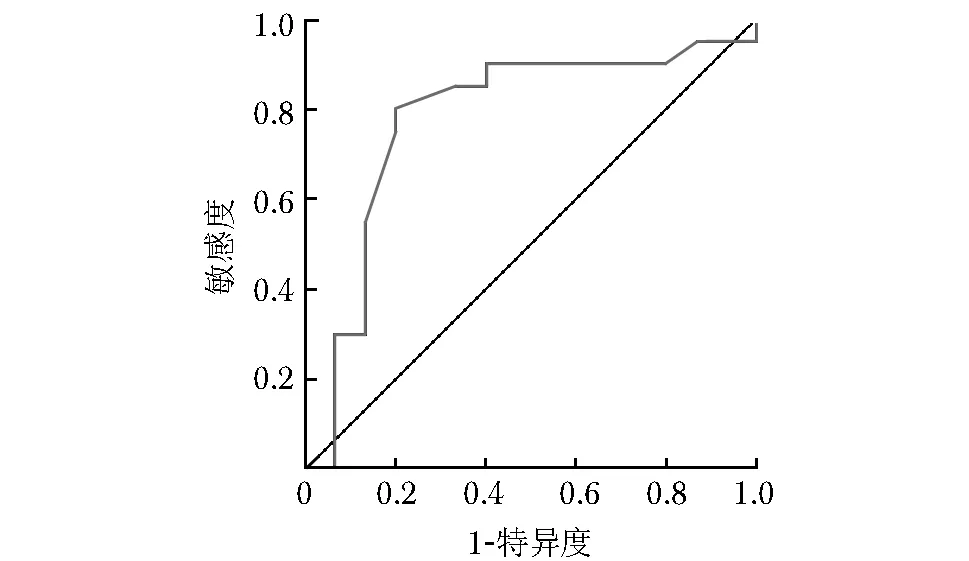
图 1 肾动脉阻力指数对Ⅰ型心肾综合征的预测价值受试者工作特征曲线
2005年初,Bongartz等[8]根据心力衰竭导致肾功能不全发病率显著增加、且当两种疾病共存时造成患者预后显著恶化的病理生理机制特点,首次提出了“严重心肾综合征”的概念,现称为CRS。心脏和肾脏之间存在多种机制进行相互调控,彼此影响,其中I型CRS最为常见,表现为端坐呼吸、水肿、肺淤血等心力衰竭症状,还出现肾功能损伤,同时可合并贫血、高钾血症、利尿剂抵抗等。早期诊断和干预可显著改善预后,故掌握诊治平衡点是目前的工作重点。
已有研究表明,导致CRS发生的可能机制包括血流动力学因素、神经体液因素以及全身炎症反应等几个方面。心力衰竭时心输出量低而发生肾脏灌注减少,同时触发肾素-血管紧张素-醛固酮系统(renin-angiotensin-aldosterone system,RAAS)引起肾血管收缩、有效肾灌注量减少[9]。另外,心力衰竭患者常伴有局部和全身性炎症反应,血浆和心肌中的炎症因子可促进血糖和血脂的异常,继而加重心、肾功能损害[10]。关于CRS最新研究发现,心力衰竭时肾静脉压力升高是导致CRS的主要因素,肾静脉压力升高,肾实质充血,受肾包膜限制,肾间质压力增加,导致肾脏灌注压(肾脏灌注压=平均动脉压-中心静脉压)减低,当肾脏灌注压低于肾血流自我调节的压力阈值时引起肾脏的有效灌注减少,导致肾脏毛细血管床和肾小管缺血缺氧。此外心力衰竭时机体常伴有水钠潴留,而肾静脉压力作为肾脏的后负荷,激活了RAAS系统,引起肾脏血管的广泛性收缩,导致肾小球滤过率的下降,引起AKI和少尿[11]。
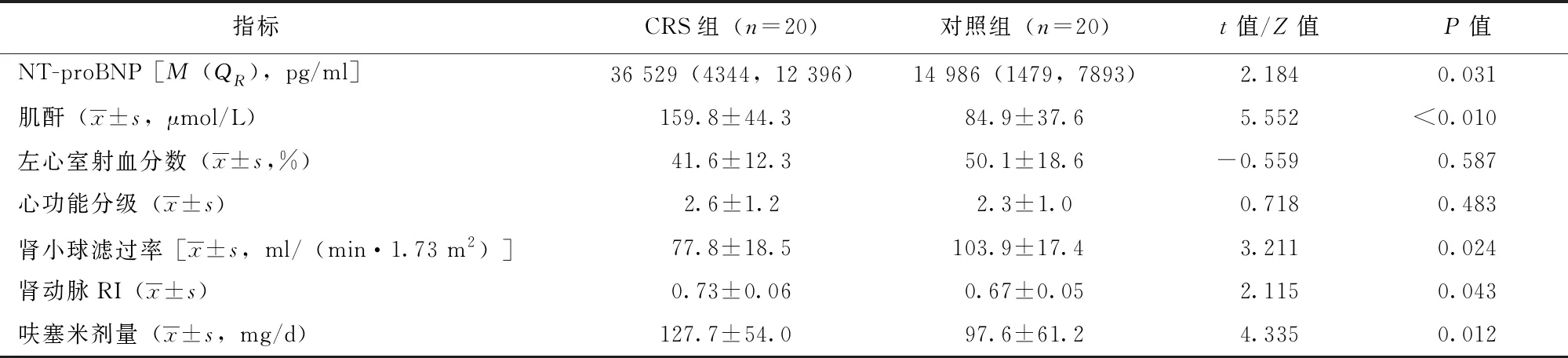
表 2 Ⅰ型CRS患者与单纯急性心力衰竭对照患者相关实验室检查及用药比较
CRS:同表1; RI:阻力指数; NT-proBNP:氨基末端脑钠尿肽
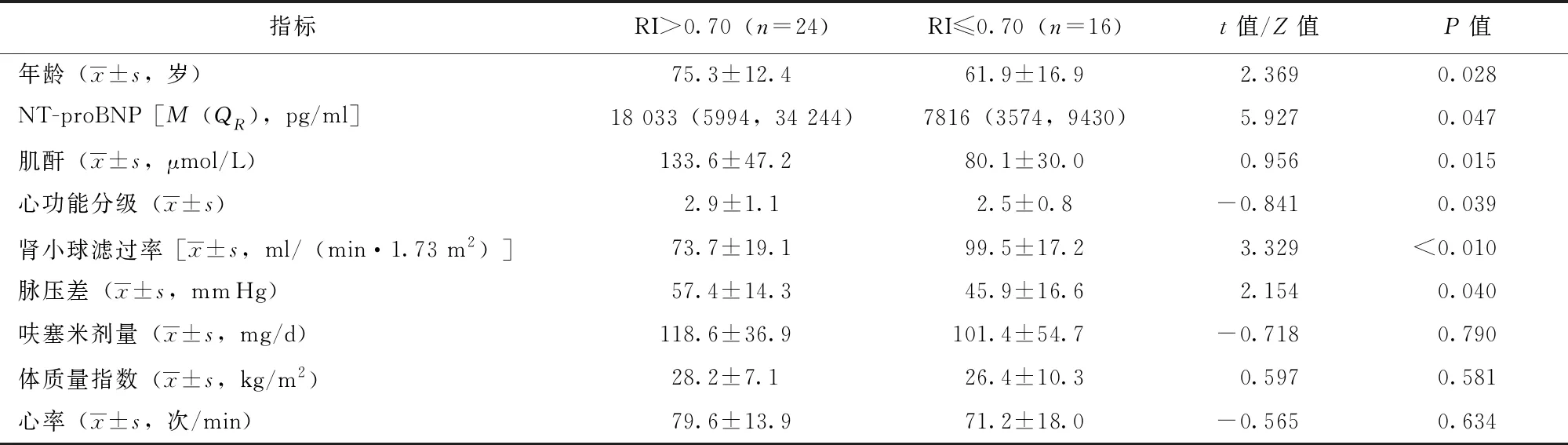
表 3 肾动脉高阻组患者与低阻组患者临床指标比较
RI、NT-proBNP:同表2
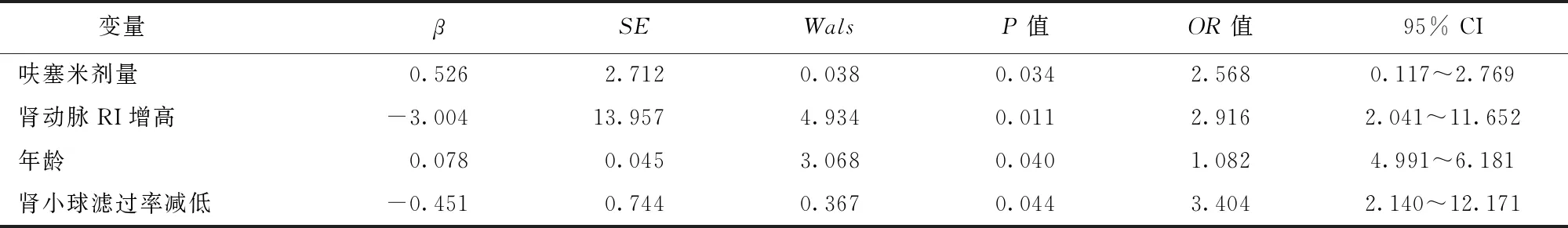
表 4 心力衰竭患者发生Ⅰ型CRS的独立危险因素
CRS:同表1;RI:同表2
肾小球滤过率是公认的评价肾功能的金标准,但目前临床上对于Ⅰ型CRS的诊断依然主要依赖于患者心力衰竭的临床症状和血肌酐的测定,此外胱抑素C、肾损伤分子1和中性粒细胞明胶酶相关脂质运载蛋白等肾损伤生物标志物也逐步推广应用,然而这些检查需要反复抽取静脉血,步骤繁琐且重复性差[12]。最新研究指出,静脉充血是1型CRS的主要病理生理机制,而利尿剂的使用有利于减轻充血水肿,但研究显示过度利尿能使22%的急性心力衰竭患者的血清肌酐升高,而肾脏损伤标志物并不升高,即虽然肌酐升高,但并未引起肾功能的损害,说明I型CRS时由于利尿剂的应用可能会导致血液浓缩造成的伪肾功能恶化而增加假阳性结果[13]。
测量肾脏叶间动脉RI作为一种非侵入性且可重复使用的方式评估肾损伤在临床上被逐步应用。肾小球后血管阻力是肾血管阻力的主要组成部分,而肾小球后血管阻力升高可引起肾动脉RI升高[14]。此外当肾静脉高压等压力负荷因素超过肾血流自我调节的压力阈值而引起肾脏的血供失代偿时,肾脏血管广泛性收缩可引起肾动脉RI的升高[15]。故急性心力衰竭患者肾动脉RI升高时,有可能意味着肾脏血流灌注的失代偿状态,而研究显示血流动力学不稳定可能会造成分子水平病理改变[16],因此肾动脉RI与血清肌酐联合诊断,可为评估I型CRS提供更多的临床信息。本研究与李偲等[17]结论一致,即高肾动脉RI是心力衰竭患者预后不良的独立危险因素,肾血流动力学变化的严重程度与心力衰竭患者不良预后关系密切。肾动脉RI升高同时也能反映肾小球硬化、肾间质纤维化以及肾小管间质损伤等肾脏疾病进展的后期表现[18]。
本研究发现呋塞米剂量是Ⅰ型CRS的危险因素,究其原因,可能由于利尿剂是心力衰竭患者的常规用药,但临床仅仅重视其利尿功能却忽视了患者血容量的补充,从而导致了低灌注肾损伤。
综上,超声测量肾动脉RI虽然并非是对CRS患者全身血流动力学的直接反映,但对心力衰竭患者发生Ⅰ型CRS具有良好的诊断价值,可与传统诊断方法互相补充,为临床提供更多的信息。然而本研究纳入的样本量较少,纳入患者平均年龄在65岁以上且伴有动脉粥样硬化等引起血管弹性降低的因素,此外检查者的主观性,患者呼吸及体位的配合等均是肾动脉RI的影响因素,故仅靠肾动脉RI评价I型CRS存在一定局限性[19]。期待更多大规模多中心临床试验以进一步验证肾动脉RI对Ⅰ型CRS的诊断价值。

