miR-3182调控肝癌细胞凋亡和放射敏感性机制研究
于凤芹 徐云芳 张青
肝癌是一种发病率较高的恶性肿瘤,我国肝癌发病率及死亡率逐年升高,目前临床主要采用手术切除治疗肝癌,但患者术后5年生存期缩短且复发率升高[1-2]。由于部分患者出现放射抵抗性且患者就诊时已错失最佳治疗时机导致治疗效果不佳,因而增强肝癌患者放射敏感性具有重要意义。微小RNA(microRNA,miRNA)在多种恶性肿瘤中异常表达,并可能发挥癌基因或抑癌基因作用,研究表明miRNA 异常表达与肝癌放射抵抗有关,但仍有部分miRNA 与肝癌放射抵抗的关系尚未完全阐明[3]。研究表明微小RNA-3182(microRNA-3182,miR-3182)在肺癌细胞中表达下调,过表达miR-3182 可显著抑制肺癌细胞增殖及侵袭[4]。miR-3182 在骨肉瘤组织及细胞中低表达,lncRNA ODURL 可通过抑制miR-3182 的表达而促进骨肉瘤的发展[5]。但miR-3182 在肝癌中的表达及其相关研究尚未见报道。序列相似性家族83 成员A(family with sequence similarity83,member A,FAM83A)在乳腺癌患者外周血中的表达水平明显升高,且与临床分期、淋巴结转移密切相关[6]。肺腺癌组织中FAM83AmRNA 的表达升高,其高表达与临床分期较晚及肺腺癌预后不良有关[7]。研究表明沉默FAM83A可增强胰腺癌细胞对化疗药物吉西他滨及放射敏感性[8]。starBase 预测显示FAM83A可能是miR-3182 的靶基因,但需进行进一步实验验证,miR-3182 和FAM83A在肝癌细胞中的表达及其对肝癌细胞凋亡和放射敏感性的影响尚未可知。因此,本研究主要探讨miR-3182 对肝癌细胞凋亡及放射敏感性的影响,并分析FAM83A是否为miR-3182 增强肝癌细胞放射敏感性的功能性靶基因,为miR-3182 在肝癌细胞放射增敏作用中的分子机制提供新方向,为miR-3182用于肝癌治疗奠定理论基础。
1 材料与方法
1.1 实验材料与主要试剂
肝癌细胞株MHCC97H、Huh7、MHCCLM3 与正常肝细胞株THLE-2 均购自美国ATCC 细胞库。RPMI 1640 培养基与胎牛血清均购自美国Gibco 公 司;Trizol 试 剂 与Lipofectamine2000 reagent 均购自美国Invitrogen 公司;反转录试剂盒购自大连宝生物工程有限公司;实时荧光定量PCR试剂盒购自中山大学达安基因股份有限公司;兔抗人FAM83A、Bcl-2、Bax 抗体均购自美国Abcam公司;细胞凋亡检测试剂盒购自美国BD 公司;双荧光素酶报告基因检测试剂盒及其基因表达质粒均购自美国Promega 公司;miR-3182 mimics 及阴性对照miR-NC、FAM83A-siRNA 及阴性对照si-NC均购自广州锐博生物科技有限公司。
1.2 方法
1.2.1 细胞转染及分组
细胞培养:取冻存肝癌MHCC97H 细胞,解冻,1 000 r/min 转速离心5 min,弃上清,加入2 mL RPMI 1640 培养基重悬细胞,PBS 洗涤3 次×5 min,每24 h 更换一次培养液,放入37℃、体积分数5%CO2培养箱培养。细胞转染:取对数生长期MHCC97H细胞接种于96 孔板(1×105个/孔),放入37℃细胞培养箱内培养4 h,待细胞生长融合度达到60%-70%时进行转染,miR-3182 mimics 与miR-NC 分别转染至MHCC97H 细胞,分别为miR-3182 组、miRNC 组;将FAM83AsiRNA、siRNA-NC 分别转入MHCC97H 细胞,分别为si-FAM83A 组、si-NC 组。为验证FAM83A 是否为miR-3182 功能性靶基因,将miR-3182 mimics 分别与FAM83A过表达质粒、空质粒共转染入MHCC97H 细胞,分别为miR-3182+pcDNA-FAM83A 组、miR-3182+pcDNA组,转染48 h 后收集细胞用于后续实验。
1.2.2 qRT-PCR 检测miR-3182、FAM83AmRNA表达
取出冻存细胞及转染后各组MHCC97H 细胞,冰上溶解,加入1 mLTrizol 试剂提取总RNA,紫外分光光度计测定RNA 浓度,参照反转录试剂盒合成cDNA,根据实时荧光定量PCR 试剂盒配置qRT-PCR 反 应 体 系,miR-3182 以U6 为 内 参,FAM83A以GAPDH 为内参,检测细胞中miR-3182、FAM83AmRNA 的相对表达量,严格按照试剂盒说明书进行操作,qRT-PCR 反应条件:95℃3 min 循环1 次,95℃变 性15 s,60℃退 火30 s,72℃延伸30 s,共循环40 次。应用实时荧光定量PCR 仪进行扩增反应,反应结束后收集数据,采 用2-ΔΔCt法 计 算miR-3182、FAM83AmRNA 的表达水平。
1.2.3 双荧光素酶报告基因实验
将含有miR-3182 结合位点的FAM83A 3′UTR序列及其突变体插入荧光素酶报告基因载体中,分别得到WT-FAM83A、MUT-FAM83A,分别将质粒与miR-3182 mimics、miR-NC 共转染至肝癌MHCC97H 细胞,转染后继续培养48 h,参照双荧光素酶报告基因检测试剂盒说明书检测各组细胞相对荧光素酶活性。
1.2.4 流式细胞术检测细胞凋亡率
分别收集对数生长期MHCC97H 细胞,胰蛋白酶消化细胞,收集细胞接种于6 孔板,PBS 洗涤细胞,每孔分别加入5 μL Annexin V-FITC、5 μL PI,充分混匀,室温孵育10 min,于1 h 内放入流式细胞仪检测细胞凋亡情况。
1.2.5 克隆形成实验
设定0、2、4、6、8 Gy 剂量组,将细胞培养板置于直线加速器,按照设定剂量组照射细胞(源靶距100 cm,照射野10 cm×10 cm,吸收剂量率300 cGy/min),收集肝癌MHCC97H 细胞,胰蛋白酶消化细胞,收集细胞接种于24 孔板(3×104个/mL),加入RPMI 1640 培养基,放入37℃、5%CO2饱和湿度培养箱内培养10~15 d,PBS 洗涤,细胞呈肉眼可见克隆时终止培养,计算克隆形成率(PE)及存活分数(SF),PE=(克隆数/接种细胞数)×100%,SF=(照射组细胞PE/对照组细胞PE)×100%,应用GraphPad Prism7.0 软件采用多靶单击模型进行曲线拟合。
1.2.6 蛋白免疫印迹(Western blot)检测FAM83A、Bcl-2、Bax 蛋白表达
取对数生长期各组细胞,加入RIPA 蛋白裂解液提取细胞总蛋白,采用BCA 法定量蛋白,每孔30 μg 蛋白样品进行上样,SDS-PAGE 电泳反应分离蛋白,转膜、封闭1 h,TBST 洗涤3 次×5 min,按照1∶1 000 稀释比稀释一抗,加入FAM83A、Bcl-2、Bax 一抗,4℃孵育24 h,TBST 洗涤3 次×5 min,孵育二抗(稀释比1∶2 000),滴加ECL 显影,放入成像系统分析蛋白条带灰度值。
1.3 统计学处理
采用统计学软件SPSS 21.0 进行分析,计量资料以()表示,两组间比较采用独立样本t检验,多组间比较采用单因素方差分析,两两比较采用LSD-t检验,以P<0.05 为差异具有统计学意义。
2 结果
2.1 miR-3182 和FAM83A 在肝癌细胞和正常肝细胞中的表达
与正常肝细胞株THLE-2 相比,miR-3182 在肝癌细胞株MHCC97H、Huh7、MHCCLM3 中的表达水平下调(P<0.05),其中miR-3182 在肝癌MHCC97H 细胞中的表达水平较其他类型肝癌细胞相对降低,而FAM83A mRNA 及蛋白的表达水平显著升高(P<0.05),见图1、表1。

图1 FAM83A 蛋白表达Figure 1 Expression of FAM83A protein
表1 miR-3182 和FAM83A 在肝癌细胞和正常肝细胞中的表达(±s,n=9)Table 1 Expression of miR-3182 and FAM83A in hepatoma cells and normal hepatocytes(±s,n=9)
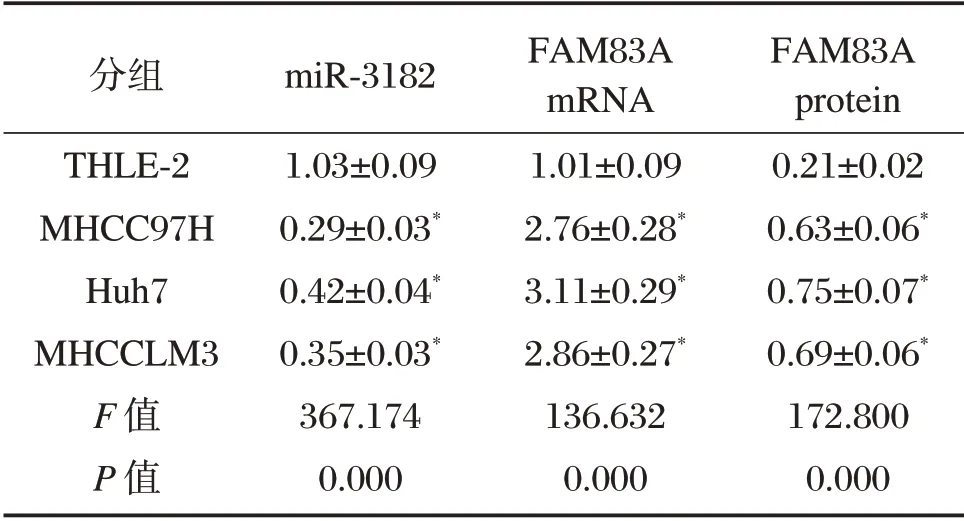
表1 miR-3182 和FAM83A 在肝癌细胞和正常肝细胞中的表达(±s,n=9)Table 1 Expression of miR-3182 and FAM83A in hepatoma cells and normal hepatocytes(±s,n=9)
与THLE-2 组比较,*P<0.05
分组THLE-2 MHCC97H Huh7 MHCCLM3 F 值P 值miR-3182 1.03±0.09 0.29±0.03*0.42±0.04*0.35±0.03*367.174 0.000 FAM83A mRNA 1.01±0.09 2.76±0.28*3.11±0.29*2.86±0.27*136.632 0.000 FAM83A protein 0.21±0.02 0.63±0.06*0.75±0.07*0.69±0.06*172.800 0.000
2.2 miR-3182 靶向调控FAM83A 的表达
starBase 生物信息学预测发现miR-3182 与FAM83A 的3′UTR 区存在结合位点,见图2A。双荧光素酶报告系统基因检测结果显示共转染FAM83A 的3′UTR 双荧光素酶报告基因载体与miR-3182 mimics 的细胞中,荧光素酶活性显著下调(P<0.05);而miR-3182 mimics 或miR-NC 与MUT- FAM83A 3′UTR 双荧光素酶报告基因载体共转染肝癌MHCC97H 细胞时,荧光素酶活性无明显改变(P>0.05),见表2。表明miR-3182 在肝癌细胞中通过靶向作用于3′UTR 区负向调节FAM83A基因的表达。Western blot 实验结果显示,在肝癌MHCC97H 细胞中过表达miR-3182,FAM83A 表达水平下降(P<0.05);抑制miR-3182 表达,FAM83A表达水平升高(P<0.05),见图2B、表3。表明miR-3182 可靶向抑制FAM83A 的表达。
表2 双荧光素酶报告实验(±s,n=9)Table 2 Dual luciferase reporter experiment(±s,n=9)

表2 双荧光素酶报告实验(±s,n=9)Table 2 Dual luciferase reporter experiment(±s,n=9)
与miR-NC 组比较,*P<0.05
MUT-FAM83A 1.04±0.08 1.03±0.09 0.249 0.806分组miR-NC miR-3182 t 值P 值WT-FAM83A 1.02±0.09 0.38±0.04*19.495 0.000

图2 miR-3182 靶向调控FAM83A 的表达Figure 2 miR-3182 targets the regulation of FAM83A expression
2.3 miR-3182 过表达对肝癌MHCC97H 细胞的凋亡和放射敏感性的影响
qRT-PCR 实验检测肝癌MHCC97H 细胞中转染miR-3182 mimics 的转染效果,结果显示,miR-3182 组细胞中miR-3182 的表达水平显著升高(P<0.05),表明成功提高肝癌MHCC97H 细胞中miR-3182 的表达水平。细胞放射及平板克隆实验结果显示,肝癌细胞中过表达miR-3182 后,与miR-NC 组相比,细胞存活分数显著减少(P<0.05)见图3C;流式细胞术检测结果显示与miRNC 组相比,miR-3182 组细胞凋亡率显著增加(P<0.05)见图3A,提示miR-3182 可增强肝癌细胞放射敏感性。Western blot 实验结果显示,在肝癌细胞中过表达miR-3182 后,与miR-NC 组相比,Bcl-2 表达下降(P<0.05),Bax 表达升高(P<0.05),见图3B、表4。表明过表达miR-3182 可增强肝癌细胞放射敏感性。
表3 miR-3182 调控FAM83A 蛋白的表达(±s,n=9)Table 3 miR-3182 regulates the expression of FAM83A protein(±s,n=9)
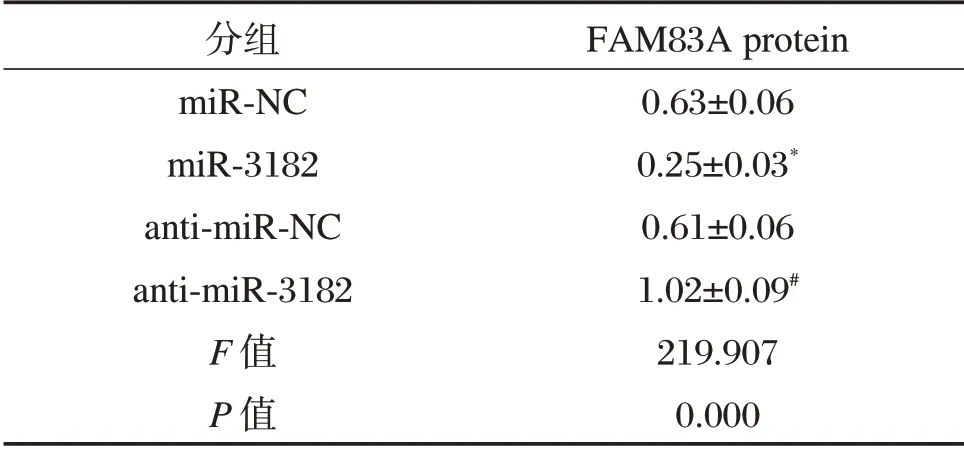
表3 miR-3182 调控FAM83A 蛋白的表达(±s,n=9)Table 3 miR-3182 regulates the expression of FAM83A protein(±s,n=9)
与miR-NC 组比较,*P<0.05;与anti-miR-NC 组比较,#P<0.05
分组miR-NC miR-3182 anti-miR-NC anti-miR-3182 F 值P 值FAM83A protein 0.63±0.06 0.25±0.03*0.61±0.06 1.02±0.09#219.907 0.000

图3 miR-3182 过表达对肝癌MHCC97H 细胞的凋亡和放射敏感性的影响Figure 3 Effect of miR-3182 overexpression on apoptosis and radiosensitivity of hepatocellular carcinoma cell line MHCC97H
表4 miR-3182 过表达对肝癌MHCC97H 细胞的凋亡和放射敏感性的影响(±s,n=9)Table 4 Effect of miR-3182 overexpression on apoptosis and radiosensitivity of hepatocellular carcinoma cell line MHCC97H(±s,n=9)
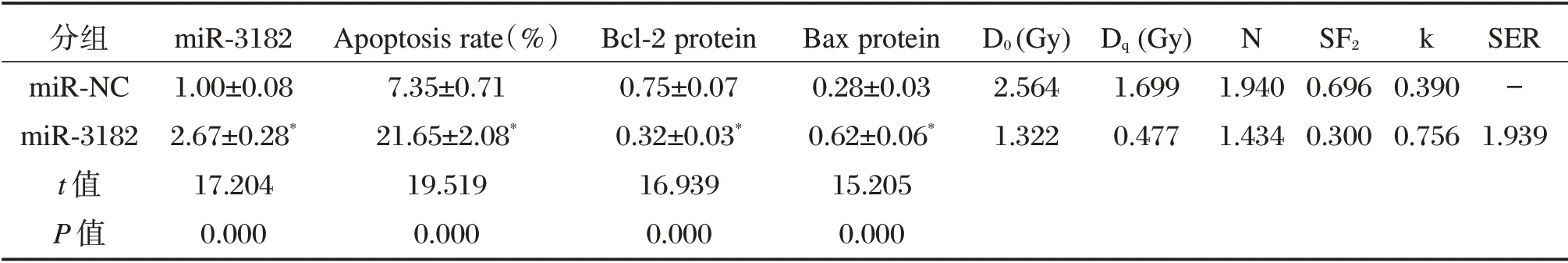
表4 miR-3182 过表达对肝癌MHCC97H 细胞的凋亡和放射敏感性的影响(±s,n=9)Table 4 Effect of miR-3182 overexpression on apoptosis and radiosensitivity of hepatocellular carcinoma cell line MHCC97H(±s,n=9)
与miR-NC 组比较,*P<0.05
分组miR-NC miR-3182 t 值P 值miR-3182 1.00±0.08 2.67±0.28*17.204 0.000 Apoptosis rate(%)7.35±0.71 21.65±2.08*19.519 0.000 N k Bcl-2 protein 0.75±0.07 0.32±0.03*16.939 0.000 Bax protein 0.28±0.03 0.62±0.06*15.205 0.000 D0(Gy)2.564 1.322 Dq(Gy)1.699 0.477 1.940 1.434 SF2 0.696 0.300 0.390 0.756 SER-1.939
2.4 抑制FAM83A 表达对肝癌MHCC97H 细胞的凋亡和放射敏感性的影响
肝癌MHCC97H 细胞中抑制FAM83A 表达后,与si-NC 组相比,细胞凋亡率显著升高(P<0.05),细胞存活分数显著下降(P<0.05),Bax 表达上调(P<0.05),而Bcl-2 表达下调(P<0.05),见图4、表5。

图4 抑制FAM83A 表达对肝癌MHCC97H 细胞的凋亡和放射敏感性的影响Figure 4 Effect of inhibition of FAM83A expression on apoptosis and radiosensitivity of hepatocellular carcinoma cell line MHCC97H
2.5 FAM83A 过表达逆转了miR-3182 过表达对MHCC97H 细胞的凋亡和放射敏感性的作用
为明确FAM83A 是否为miR-3182 的功能性靶基因,通过在过表达miR-3182 肝癌MHCC97H 细胞中转染FAM83A 过表达质粒,探讨FAM83A 能否逆转由miR-3182 过表达对细胞放射敏感性的作用,结果显示,过表达的肝癌MHCC97H 细胞中转染FAM83A 后可逆转miR-3182 过表达对细胞放射敏感性的作用,细胞凋亡率显著降低(P<0.05),细胞存活分数显著升高(P<0.05),Bcl-2 表达上调(P<0.05),而Bax 表达下调(P<0.05),见图5、表6。
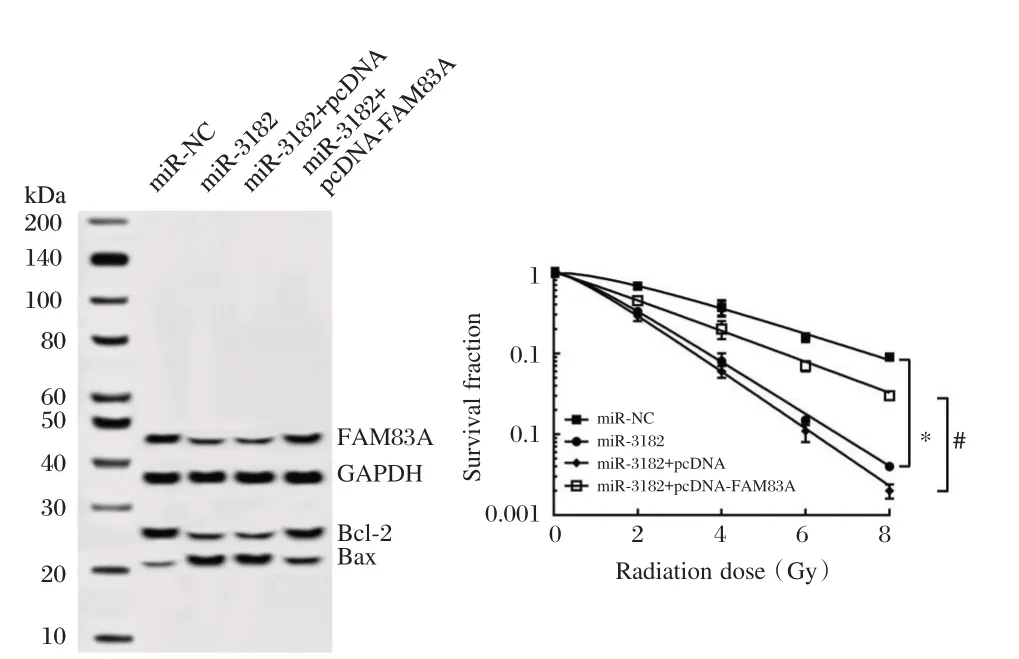
图5 FAM83A 过表达逆转了miR-3182 过表达对MHCC97H 细胞的凋亡和放射敏感性的作用Figure 5 FAM83A overexpression reverses the effect of miR-3182 overexpression on apoptosis and radiosensitivity of MHCC97H cells
3 讨论
miR-3182 在乳腺癌细胞系中表达下调,其可能通过调控mTOR 和S6K1 基因表达进而参与乳腺癌发生及发展过程[9]。miR-3182 表达水平降低还可能作为诊断肺腺癌的重要标志物[10]。索拉非尼可能通过调控miR-3182 表达进而参与结直肠癌细胞发展进程[11]。研究表明miR-3182 表达异常与鼻咽癌远处转移密切相关[12]。miR-3182 在肝癌中的研究尚未见报道,本研究结果显示miR-3182 在肝癌细胞中表达水平降低,提示miR-3182 表达水平降低与肝癌的发生密切相关。本研究通过上调miR-3182 表达,研究结果显示miR-3182 过表达可明显促进肝癌细胞凋亡,降低细胞存活分数,说明miR-3182 过表达可通过诱导肝癌细胞凋亡从而增强细胞放射敏感性。本研究结果显示miR-3182过表达后可促进肝癌细胞中Bax 的表达,而抑制Bcl-2 的表达。研究表明Bcl-2/Bax 比例升高可抑制细胞凋亡,其比例降低可促进细胞凋亡[13-14],说明miR-3182 过表达可下调Bcl-2 的表达及上调Bax 的表达从而促进肝癌细胞凋亡,提示miR-3182 过表达可能通过诱导肝癌细胞凋亡进而增强细胞放射敏感性。
表5 抑制FAM83A 表达对肝癌MHCC97H 细胞的凋亡和放射敏感性的影响(±s,n=9)Table 5 Effect of inhibition of FAM83A expression on apoptosis and radiosensitivity of hepatocellular carcinoma cell line MHCC97H(±s,n=9)
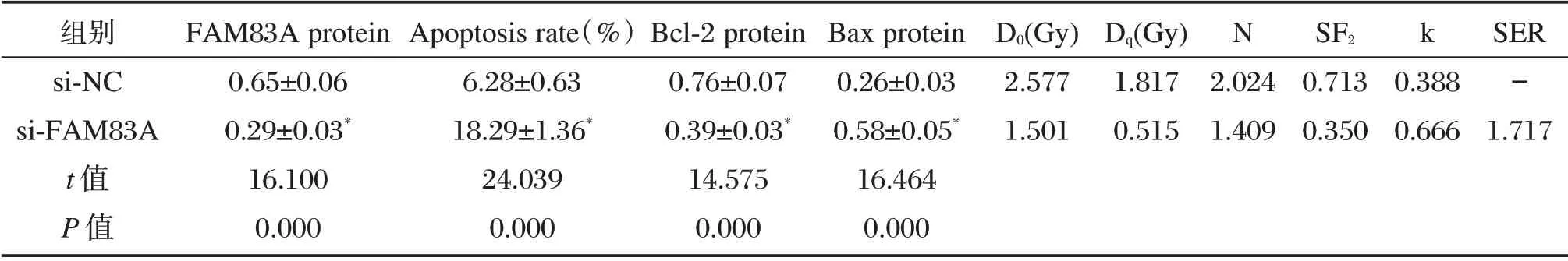
表5 抑制FAM83A 表达对肝癌MHCC97H 细胞的凋亡和放射敏感性的影响(±s,n=9)Table 5 Effect of inhibition of FAM83A expression on apoptosis and radiosensitivity of hepatocellular carcinoma cell line MHCC97H(±s,n=9)
与si-NC 组比较,*P<0.05
组别si-NC si-FAM83A t 值P 值FAM83A protein 0.65±0.06 0.29±0.03*16.100 0.000 Apoptosis rate(%)6.28±0.63 18.29±1.36*24.039 0.000 Bcl-2 protein 0.76±0.07 0.39±0.03*14.575 0.000 Bax protein 0.26±0.03 0.58±0.05*16.464 0.000 D0(Gy)2.577 1.501 Dq(Gy)1.817 0.515 N k 2.024 1.409 SF2 0.713 0.350 0.388 0.666 SER-1.717
表6 FAM83A 过表达逆转了miR-3182 过表达对MHCC97H 细胞的凋亡和放射敏感性的作用(±s,n=9)Table 6 FAM83A overexpression reverses the effect of miR-3182 overexpression on apoptosis and radiosensitivity of MHCC97H cells(±s,n=9)
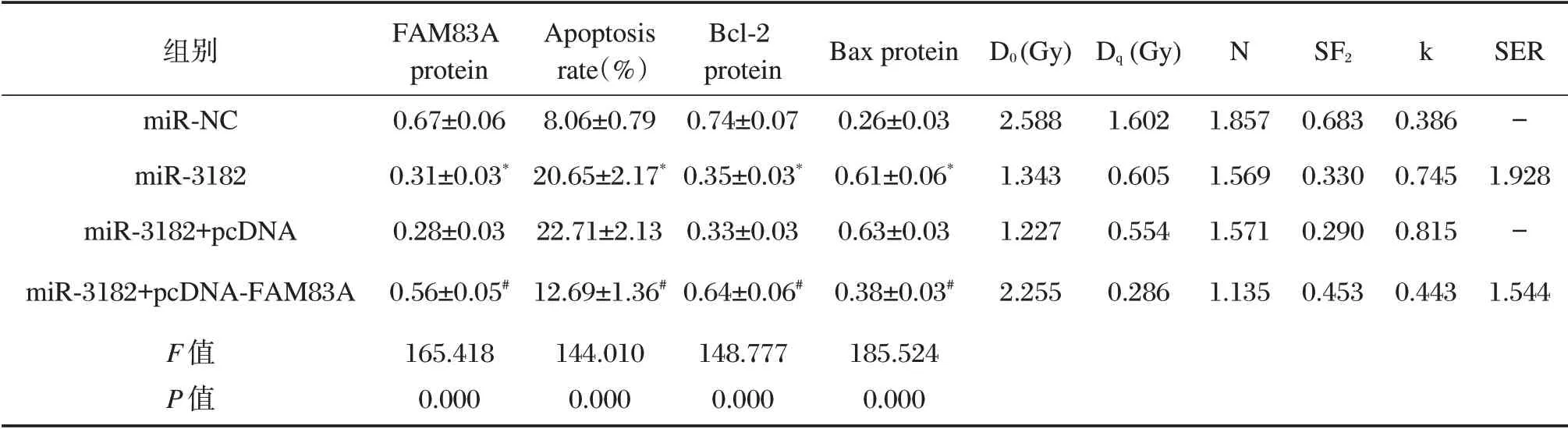
表6 FAM83A 过表达逆转了miR-3182 过表达对MHCC97H 细胞的凋亡和放射敏感性的作用(±s,n=9)Table 6 FAM83A overexpression reverses the effect of miR-3182 overexpression on apoptosis and radiosensitivity of MHCC97H cells(±s,n=9)
与miR-NC 组比较,*P<0.05;与miR-3182+pcDNA 组比较,#P<0.05
组别miR-NC miR-3182 miR-3182+pcDNA miR-3182+pcDNA-FAM83A F 值P 值FAM83A protein 0.67±0.06 0.31±0.03*0.28±0.03 0.56±0.05#165.418 0.000 Apoptosis rate(%)8.06±0.79 20.65±2.17*22.71±2.13 12.69±1.36#144.010 0.000 Bcl-2 protein 0.74±0.07 0.35±0.03*0.33±0.03 0.64±0.06#148.777 0.000 Bax protein 0.26±0.03 0.61±0.06*0.63±0.03 0.38±0.03#185.524 0.000 D0(Gy)2.588 1.343 1.227 2.255 Dq(Gy)1.602 0.605 0.554 0.286 N k 1.857 1.569 1.571 1.135 SF2 0.683 0.330 0.290 0.453 0.386 0.745 0.815 0.443 SER-1.928-1.544
FAM83A 在肺腺癌组织中的表达水平明显升高,且高表达量与患者预后不良有关[15]。研究表明FAM83A 在乳腺癌、膀胱癌等多种恶性肿瘤中高表达,并可在肿瘤发生发展过程中发挥癌基因作用[16]。FAM83A 可通过激活EGFR/PI3K/AKT信号通路进而促使乳腺癌细胞对放疗或化疗产生一定抗性[17]。相关研究表明FAM83A 可能参与食管鳞癌发生及发展过程,并可能作为肿瘤治疗的潜在靶点[18]。本研究结果显示,FAM83A 在肝癌细胞中的表达水平明显升高,提示FAM83A 表达水平升高可能促进肝癌的发生。本研究进一步研究显示沉默FAM83A 可促进肝癌细胞凋亡,增强细胞放射敏感性。提示沉默FAM83A 可能作为肝癌放射治疗的潜在靶点。通过双荧光素酶报告基因证实FAM83A 是miR-3182 的靶基因,经恢复实验证明miR-3182 过表达的肝癌细胞系中过表达FAM83A 可逆转其对肝癌细胞凋亡及放射敏感性的作用,进一步证明FAM83A 是miR-3182 调节肝癌细胞放射敏感性的功能性靶基因。提示miR-3182 可通过下调靶基因表达进而促进肝癌细胞凋亡及增强细胞放射敏感性。
综上所述,miR-3182 过表达可通过抑制靶基因FAM83A 表达,从而调控肝癌细胞放射敏感性,为miR-3182 在肝癌放射增敏作用中的机制提供理论依据。但本研究仅在体外探讨miR-3182 对肝癌细胞放射敏感性的作用,并未进行体内实验验证,后续研究将进行深入探讨。

