高敏HCV RNA检测技术的临床应用
刘娜 李春霞 东冰 周路路 张瑞芹 徐光华
丙型肝炎病毒(hepatitis C virus,HCV)感染是引起全球慢性肝病的主要原因之一[1]。2015年世界卫生组织(WHO)估计全世界约有7 100 万慢性丙型肝炎(Chronic hepatitis C,CHC)患者(全球流行率:1%)[1-2];2006年全国血清流行病学调查显示我国1~59 岁人群抗-HCV 流行率为0.43%[3]。HCV 感染具有隐匿性,且高度慢性化(慢性化率为55%~85%[3]),20%~30%的CHC 患者会在20~30年内发展为肝硬化,而发展为肝硬化的患者肝细胞癌(hepatocellular carcinoma,HCC)的年发生率为2%~4%[4]。基于此,WHO 发布了病毒性肝炎的全球战略,即在2030年之前将丙型肝炎的新发感染率下降90%,死亡率下降65%;要求90%的感染者得到诊断,80%被确诊患者得到治疗[5]。然而在目前7 100 万CHC 患者中,只有1 400 万人(20%)被诊断(70%的差距);在1 400 万被诊断的患者中,只有110 万人(7%)开始接受治疗(73%的差距)[6]。随着2014年sofosbuvir(SOF)的上市,丙肝成为一种可以治愈的疾病[7]。故现阶段,早筛查、早诊断对于丙肝的防控尤为重要。目前,国内外主要以抗-HCV 的筛查试验和HCV RNA 的确认试验来诊断HCV 感染。抗-HCV 检测窗口期较长(8~12 周的窗口期,部分患者甚至可长达5~8个月[8])、无法区分既往感染与现症感染,且易出现假阳性、假阴性结果;而国内常规的PCR 技术虽能区分既往感染与现症感染,但由于最低检测限为500~1 000 IU/mL,故不能满足临床的需求。高敏HCV RNA 检测因其灵敏度高、特异性强、线性范围宽、携带污染低、检测反应时间短、自动化程度高等优点,可实现对HCV 感染的精准诊治,因此具有巨大的临床应用前景。
1 高敏HCV RNA 检测技术的概述
实时荧光定量PCR(Quantitative Real-time,PCR)融汇了PCR 高敏感性、探针杂交高特异性和光谱检测高精确性等技术优点,被认为是检测HCV RNA 定量的标准方法[9]。市面上现有多种FQ-PCR 检测技术。国内传统的非高敏FQ-PCR检测技术由于线性范围窄、灵敏度低,最低检测限为500~1 000 IU/mL,在HCV RNA 载量较低时往往难以检出,特别是不能检测低于检测下限(limit of detection,LOD)的阳性样本,故无法满足临床检测需求。高敏PCR 检测技术应用全自动核酸提纯及荧光PCR 分析系统的HCV RNA 定量检测性能,实现了提取和扩增的全程自动化,在提取试剂中加入内标,可与样本同时进行提取和扩增,实现全程监控实验进程,有效地避免了假阴性结果;利用磁珠法提取可增加反应体积;对扩增体系进行了优化(见图1所示)。且其检测结果采用国际单位(IU)/mL 表示(WH0 制定的统一标准)[10]。目前已在临床广泛应用的2 种高敏HCV RNA 检测方法分别是雅培Abbott RealTime(ART)m2000 PCR 仪(线性范围:12~1×108IU/mL)和罗氏 COBAS AmpliPrep/COBAS TaqMan2.0(CAP/CTM2)全自动病毒载量仪(线性范围:15~1×108IU/mL)[11],均可实现较低水平的LOD。高敏HCV RNA 的检测结果可以用4 种不同的方式来报告:①目标未检测出:HCV 的Ct 值未达到含量测定限值或者未检出HCV 的Ct 值,报告结果有时也表示为“target not detected”或“undetectable”;②可检测/不可量化:可检测到HCV RNA,但计算的IU/mL 值低于测定的定量下限(lower limit of quantification,LLOQ),报告结果为HCV RNA<12 IU/mL (ART) 或 <15 IU/mL (CAP/CTM2);③具体特定值:在相应的测定线性范围内,即≥LLOQ 且≤定量上限(upper limit of quantitation,ULOQ),报告结果为具体的数值的IU/mL;④>ULOQ,计算结果超过了测定的线性范围,报 告 结果为HCV RNA>108IU/mL(ART 或CAP/CTM2);如果希望得到定量结果,原始的标本需要按要求稀释后重复测试。谷金莲等[12]通过比较国产试剂与罗氏进口试剂对HCV RNA 的检测性能,发现3 种国产HCV RNA 定量试剂的阳性检出率11.51%~14.80%,均显著低于进口试剂的阳性检出率(26.97%),而国产试剂检测漏检的样本主要分布在HCV RNA<50 IU/mL 的检测下限中。目前国内外指南均建议应用采用灵敏度和精确度更高的FQ-PCR 方法定量检测HCV RNA[3,10,13-14]。
2 高敏HCV RNA 检测技术的临床应用
随着分子生物学诊断方法的不断革新,近年来,高敏HCV RNA 检测技术已经逐渐被应用于临床中,且临床应用优势越来越明显。
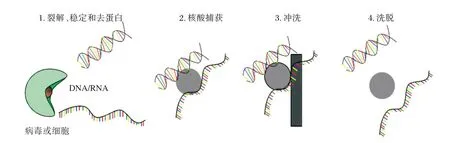
图1 磁珠分离技术Figure 1 Magnetic bead separation technology
2.1 在急慢性丙型肝炎诊断中的应用
抗-HCV 在大多丙型肝炎患者中均可测定,但由于窗口期较长,一般为8~12 周的部分患者甚至可长达5~8 个月[8],故对于急性丙型肝炎(acute hepatitis C,AHC)患者可出现抗-HCV 阴性[3],不能完全满足早期筛查的要求。而血清中HCV RNA 出现较早,暴露HCV 后约1 周在外周血中即可检测到HCV RNA[15];且由于抗-HCV 仅反映HCV 是否感染的主要指标,不能区分HCV 是现症感染还是已被清除,特别对于18 个月以下的婴幼儿,只有通过检测HCV RNA,才能明确感染的状态,因为经过胎盘的母体抗-HCV 可在婴幼儿血液里保持18 个月[10]。高敏HCV RNA 检测技术不但可以缩短检测窗口期,而且对于抗-HCV阳性的婴幼儿可实现精准诊断。HCV 感染的精准筛查非常重要,不仅可以降低传播率,而且对于AHC 患者早期抗病毒治疗可以取得更高的应答率[16]。研究证实,对于AHC 患者早期应用DAAs 治疗后不仅可以改善临床结局,而且与推迟治疗到CHC 阶段相比,具有很高的成本效益[17]。抗-HCV 由于本身技术的局限性在临床中易出现假阳性、假阴性结果(重组蛋白纯度不足、骨髓瘤、类风湿性关节炎、自身免疫性肝炎等患者可出现抗HCV 假阳性[18-19],而血液透析和免疫功能缺陷或合并HIV 感染者可出现抗-HCV 假阴性[20]);尽管第三代ELISA 试剂的特异性已达99%[21],但在低危险人群的假阳性率高达15%~60%(平均35%)[22]。目前大多数实验室对于丙肝的筛查采用两步方法,第一步做抗-HCV 检查,当抗体阳性后第二步做HCV RNA 检测,故易出现漏诊,特别是那些高感染风险(注射吸毒者、艾滋病毒抗体阳性的男男性行为无保护[13])以及抗-HCV 高流行地区,建议有条件尽可能行高敏HCV RNA 检测[23];对于那些免疫功能低下的抗-HCV 阴性者,也应积极进行HCV RNA 检测[24]。早在2009年美国肝脏病研究协会(AASLD)就指出在高危人群中应用敏感的方法筛查和诊断丙型肝炎病毒感染的重要性[20]。研究表明,感染基因型1 和6 的患者HCV RNA 往往高于基因型2 或3的患者[25],故对于基因型2 或3 的低病毒载量患者更建议应用高敏HCV RNA 检测技术进行评估,因为低水平病毒复制仍可能引起肝脏的持续损伤,进而引起肝纤维化、肝硬化甚至HCC,常规的PCR 技术就可能使患者错过最佳的抗病毒治疗时机。此外,2015年国家开始对抗-HCV 阴性献血员筛查HCV RNA,经输血和血制品传播已很少发生,而高敏的HCV RNA 检测仍可发现隐匿性感染病例。因此,应用高敏HCV RNA 检测技术是精准诊断急慢性丙型肝炎的重要保障。
2.2 在判定抗-HCV 灰区标本是否感染中的应用
在抗-HCV 免疫测定中,结果判断是根据被测物的吸光度值(Signal)同诊断界值(Cutoff,CO)的比值(Signal-to-Cutoff,S/CO)来决定的。由于检测技术本身问题,CO 值临界范围内的测定结果难以明确判断是阴性还是阳性,被界定为灰区。ELISA 方法检测抗-HCV 一般将S/CO≥1,判断为反应阳性;S/CO<1,则判断为阴性[26]。闵少菊等人[27]对183 例处于ELISA 灰区(0.7≤S/CO<1)的标本进行了HCV RNA 检测(国产达安试剂),3 例HCV RNA 阳性。而第三代免疫分析仪Architect i2000化学发光微粒子免疫分析(chemiluminescent microparticle immunoassay,CMIA)方法检测抗-HCV一般将S/CO>5,判断为反应阳性;S/CO<1,则判断为阴性。有人将处于Architect i2000 检测灰区的标本(1≤S/CO<5.2)进一步行高敏HCV RNA(LOD≤30 IU/mL),阳性率为0.75%(5/665)[28];杜丽枝等人[29]也将Architect i2000 检测抗-HCV 阳性灰区标本(1≤S/CO≤5)进一步行高敏HCV RNA 检测(LOD≤25 IU/mL),阳性率为0。可见,由于免疫测定技术本身的局限性,抗-HCV 的假阳性结果在一定程度上会给受检者带来不必要的就医和心理压力。此外,由于灰区临界值设置尚未统一化、标准化,合格血液有可能被判定为抗-HCV 阳性而报废处理,不利于血液的合理、有效地利用;不合格的血液有可能被判定为抗-HCV 阴性造成受血者有输血传播性感染(TTI)的风险。可见,确定合适的诊断界值对减少假阳性和假阴性的出现均有重要意义,若误诊会加重患者的心理负担,甚至引起医疗纠纷。因此,高敏HCV RNA 检测为精准判定灰区样本是否存在HCV 感染提供了有效依据。
2.3 在抗病毒应答及停药中的应用
有效抗病毒治疗不一定会造成抗-HCV 阴转,即使感染治愈后抗-HCV 可持续阳性。HCV RNA定量检测适用于HCV 现症感染的确认、抗病毒治疗前基线病毒载量分析,以及抗病毒治疗过程中及治疗结束后的应答评估[3]。精准的HCV RNA定量检测对HCV 感染的治疗意义重大,有助于预测治疗效果、判断停药时机以及评估治疗结局。在干扰素治疗时代,特别强调应答指导治疗(response-guided treatment,RGT)的概念,即在治疗前及治疗4、12 和24 周应采用高敏FQ-PCR 方法监测HCV RNA,根据治疗期间HCV RNA 的水平早期评估对干扰素的应答情况,以确定治疗的疗程[30]。对于实现快速病毒学应答(rapid virological response,RVR)的患者考虑疗程可缩短为24 周(基因1 型或4 型)或12~16 周(基因2 型或3型)[3,31-32]。RGT 有助于提高Peg-INF 的持续病毒学应答(sustained virological response,SVR)率和降低不良反应率[14],还可以减轻患者的经济负担和精神负担。国产试剂检测的灵敏度较低,可能会导致一些部分早期病毒学应答(partial EVR,pEVR))患者被误判为完全早期病毒学应答(complete EVR,cEVR),未将疗程再延长24 周,可能导致复发率升高。王剑等人[33]通过对比国产试剂与Roche COBAS TaqMan 试剂的Peg-IFN/利巴韦林(RBV)的应答率,发现国产试剂判定RVR 的假阴性率为37.3%(28/75),EVR 的假阴性率为20.8%(5/24)。在DAAs 治疗时代,精准检测HCV RNA 水平对个体化诊疗方案的制定也有一定的意义。对于未治疗、非肝硬化、基因1 型的患者,应用ledipasvir(LDV)和sofosbuvir(SOF)治疗时只要基线HCVRNA 水平<6.8log10IU/mL,就可将治疗时间从12 周缩短到8周[34]。缩短疗程后可降低高成本的治疗费用、防止DAAs 的副作用、减少药物的相互作用(drug-drug interactions,DDIs)[11]。由于大多数患者应用DAAs治疗后,早期就可获得病毒学应答,但在治疗第2周、第4 周和治疗结束时检测高敏HCV RNA 水平,可以实时掌握患者的依从性和治疗效果[14]。有研究发现SOF/RBV 治疗基因型1 的CHC 中,治疗2周时,复发患者与SVR 患者HCV RNA 水平差异最大[35]。因此精准的掌握HCV RNA 定量可预测患者SVR 率,识别易治和难治的患者,特别在某些难治疗的患者群中,包括晚期肝硬化、HCV 基因型3的患者,治疗早期HCV RNA 的变化是治疗结果的有效预测因素[36-38]。判断抗HCV 治愈的标准是通过SVR 来判断,被定义为在治疗结束后12 周(SVR12)或24 周(SVR24)中检测不到HCV RNA,LOD 需≤15 IU/mL[16],因为超过99%的SVR 患者不会复发[39]。有研究报到在治疗结束时,经常规PCR(检测限为50~100 IU/mL)检测阴性的血清标本中,应用雅培ART 技术检测高敏HCV RNA 后13.8%(28/202)为阳性,殊不知这种微量残留的病毒血症对治疗后的病毒学复发有很高的预测作用[40]。
总之,国内传统的非高敏FQ-PCR 检测技术HCV RNA 定量已逐渐不能满足临床的需求,而高敏HCV RNA 检可精准评估HCV RNA 水平,是HCV 感染者个体化诊疗的基石,是实现HCV 感染诊疗并重、精准治愈的重要工具,也符合国内外指南对HCV RNA 定量检测的要求,故具有较高的临床应用价值,值得广泛推广应用。

