脂蛋白磷脂酶A2化学发光法质量测定试剂的性能评价①
范雪松 王恩世 贺建勋 宋 扬 桂 媛 孙 奇 曾小莉 崔 颖 袁 慧
(首都医科大学附属北京安贞医院 北京市心肺血管疾病研究所检验科,北京100029)
脂蛋白相关磷脂酶A2(Lipoprotein-associated phospholipase A2,Lp-PLA2)又被称为血小板活化因子乙酰水解酶,是一类能催化脂蛋白和细胞膜上甘油磷脂二位酰基酯键水解形成非酯化脂肪酸和溶血磷脂的酶蛋白,属于水解磷脂酶家族中PLA2的一类成员[1]。Lp-PLA2可水解血管内膜的氧化卵磷脂,生成溶血卵磷脂和氧化型游离脂肪酸,促进动脉粥样硬化性易损斑块生成,导致血栓形成和心血管事件的发生[1]。Lp-PLA2已被写入美国心脏协会和欧洲心脏病学会临床指南,成为临床常规检测指标[2,3]。2015年发布的《脂蛋白相关磷脂酶A2临床应用中国专家建议》明确推荐使用Lp-PLA2的质量法进行检测[4]。传统的Lp-PLA2质量检测方法有酶联免疫法、免疫层析法、免疫荧光法、乳胶增强法等,其中化学发光法操作简便易于自动化,故利于临床应用[5]。本研究拟分析国内第一家化学发光法质量测定Lp-PLA2试剂的基本性能及与第一家国家食品药品监督管理总局(China Food and Drug Administration,CFDA)批准的活性试剂结果的一致性,为其进一步的临床应用提供参考依据。
1 资料与方法
1.1资料
1.1.1一般资料 选取2018年9月3日至27日至在首都医科大学附属北京安贞医院就诊患者的新鲜血清标本336例,男193例,女143例,年龄为31~87岁,平均年龄(57.33±10.56)岁,男女比例为1.35∶1.00,其中高值样本为冠状动脉粥样硬化患者样本,比对样本选取其中326例;健康人群组选取本院同时期查体中心体检健康者40例,男女各20例,年龄16~84岁,上述所有标本均无溶血、无黄疸、无脂血,且本实验经安贞医院伦理委员会同意。
1.1.2仪器与试剂 威高AutolumiS 3000 全自动化学发光测定仪、贝克曼AU5400全自动生化分析仪。
检测试剂为Lp-PLA2测定试剂盒(磁微粒化学发光法)及其配套质控品购自威海威高生物科技有限公司。比对试剂采用上Lp-PLA2活性测定试剂及其配套校准品和质控品,购自上海德赛。所有操作均按照仪器和试剂厂商说明书执行。
1.2方法
1.2.1Lp-PLA2水平检测 采用双抗体夹心法定量测定血浆中Lp-PLA2水平,在磁微粒上共价结合Lp-PLA2抗体,加入待测样本和异鲁米诺标记的Lp-PLA2抗体,形成磁微粒标记抗体-抗原-异鲁米诺标记抗体复合物,充分洗涤后,加入激发液,测定其相对发光强度(Relative light unit,RLU)。样本中Lp-PLA2的含量与RLU呈正相关,通过剂量-反应拟合曲线,定量测定样品中LP-PLA2的含量。
1.2.2精密度评价 根据美国临床实验室标准化委员会(National committee for clinical laboratory standards,NCCLS)EP5-A2[6]和美国临床实验室标准化协会EP15-A[7]文件要求进行精密度验证。批内不精密度按照与临床标本相同的检测方法,取低、中、高3例患者新鲜血清用相同批号的待检试剂在最短时间内对3个水平血清分别重复测定20次,计算测定结果的均值(X)、标准差(SD)和批内变异系数(CV%);批间精密度用相同批号的待检试剂检测低、中、高3例患者新鲜血清,每天重复测试3次,连续测试5 d,统计检测结果,计算出SD和批间CV%。
1.2.3线性范围验证 根据CLSI EP6-A[8]文件的要求,取高值(H)和低值(L)样本各1份,其中L为空白样本,基质为稀释液;H为接近分析测量范围上限浓度的样本,且两样本浓度覆盖仪器说明书给出的线性范围,按如下配比(L、0.9L+0.1H、0.8L+0.2H、0.7L+0.3H、0.6L+0.4H、0.5L+0.5H、0.4L+0.6H、0.3L+0.7H、0.2L+0.8H、0.1L+0.9H、H)制备不同浓度的标本共11个浓度梯度,每个浓度梯度测定3次,记录结果。检查数据差异有无明显统计学意义,如果确定为分析或技术性问题,纠正后整批数据重新实验。若无明显差异,目视每组数据内有无离群值,一个离群值可以从数据中删除,如果发现两个或以上不可解释的离群值,应怀疑检测系统的性能,需查找问题原因。完成初步的数据检查和离群值检查后,进行散点图绘制,以理论浓度为纵坐标(Y),实测浓度为横坐标(X),若所有点在散点图上呈明显直线趋势,用直线回归统计对数据作处理,计算回归方程为Y=ax+b。若相关系数r2≥0.975,a在0.97~1.03范围内,则可判断线性验证通过。若a不接近1(即a<0.97,或a>1.03),有可能是a和1之间差异有显著性统计学意义,须重新对所有实验结果进行分析,以判断是高浓度处还是低浓度处的实测值和预期值间有较大偏倚,尝试舍去某组数据,另作回归统计。若缩小分析范围后回归式有明显改善,a接近于1,则缩小的分析范围是真实的分析测量范围。
1.2.4正确度验证 由于Lp-PLA2既无参考测量程序,也无国际公认的有证参考物质,无经典方法作为参考标准,故本研究选用回收率进行正确度评价。取L为低值血清混合样本,H为接近分析测量范围上限50%~70%之间的高浓度标准品样本。按L、4L+H、3L+2H、2L+3H、L+4H 和H配置成系列测试样本。对系列样本在检测系统上检测,每个样本按随机方式重复测定3次。计算样本3次实测值的平均值与理论值的偏差率,并验证其是否落在允许范围内。完成初步的数据检查和离群值检查后,进行散点图绘制,若所有点在散点图上呈明显直线趋势,用直线回归统计对数据作处理,得直线回归,计算回归方程为Y=ax+b。评价标准为实测结果应落在允许范围内,偏差不超过10%,即以回收率在90%~110%内为验证通过。并对实测值和理论值进行线性回归分析,计算回归方程为Y=ax+b,相关系数r2≥0.975,a应在0.97~1.03范围内。
1.2.5携带污染率试验 分别选取高浓度和低浓度质控品,连续测定3次高浓度质控血清(结果记为H1、H2、H3)后,立即连续测定3次低浓度质控血清(结果记为L1、L2、L3),按公式[(L1-L3)/(H3-L3)]×100%计算携带污染率,以携带污染率<5%为验证通过。
1.2.6生物参考区间验证 参照美国临床和实验室标准协会(Clinical and Laboratory Standards Institute,CLSI)C28-A2[9]文件,若所有检测结果均在引用的参考区间内,又或者仅有5%的结果(2例)超出引用的参考区间,表示该生物参考区间验证通过。
1.2.7临床样本比对及偏差评估 由于Lp-PLA2 没有第二种化学发光试剂作对比,因此参考CLSI EP9-A2[10]文件以CFDA第一个注册的上海德赛公司活性检测试剂作为比对试剂,在贝克曼AU5400上测定的活性结果作为X,化学发光法测定的质量结果作为Y,绘制散点图,并进行相关分析,计算回归系数、截距、相关系数r2和95%可信区间。参考文献中低密度脂蛋白胆固醇(Low density lipoprotein chesterol,LDL-C)的医学决定水平(2.07、2.59、3.37 mmol/L)所对应的Lp-PLA2活性(328、391、485 U/L)为本研究的医学决定水平[11],计算在医学决定水平上的预期偏差。

2 结果
2.1精密度评价 批内精密度CV值在3.76%~4.61%之间(表1),批间精密度CV值2.38%~3.91%之间(表2),均小于厂商标注(10%)及文献中推荐的允许不精密度标准(<5%)[11],可满足临床应用。
2.2线性评价 结果显示该项目线性方程为y=0.998x+27.597,相关系数r2=0.992 7,线性符合NCCLS EP6-A2[8]文件的要求,验证通过。线性统计结果见表3,线性回归方程曲线见图1。
表1 Lp-PLA2批内精密度评价结果
Tab.1 Evaluation results of within-run precision of Lp-PLA2
DetectiontimesLow concentrationsamples(ng/ml)Medium concentrationsamples(ng/ml)High concentrationsamples(ng/ml)1105.44239.42432.162 93.99240.51423.193100.08254.18427.744102.95249.03464.835 98.59240.62451.176 96.10228.46463.027 95.83235.95459.698 98.21235.15440.429103.82255.50422.0110 91.10255.45427.1311103.09251.89465.2112 95.45249.01458.8813102.63251.89464.551493.10243.63424.7215105.58230.30432.6716100.78256.21461.1417102.84229.45439.061892.47236.06466.271997.40255.97453.0620104.06242.69462.65x±s(ng/ml)99.18244.07446.98SD(ng/ml) 4.57 9.54 16.81Repeatability(CV%) 4.613.913.76
表2 Lp-PLA2批间精密度评价结果
Tab.2 Evaluation results of between-day precision of Lp-PLA2
SamplesDayMeasured value(ng/ml)x(ng/ml)SD(ng/ml)Repeat-ability(CV%)Low concentration samples1st104.6297.81100.4192.91104.6298.923.863.912nd100.1892.1795.3596.50100.183rd99.6695.3997.2495.2499.664th100.61103.05104.9495.70100.61Medium concentration samples1st247.55224.24246.65250.97247.55239.908.193.412nd243.82227.25235.66238.2243.823rd254.47233.34241.07230.13254.474th242.92246.83241.09239.35242.92High concentration samples1st440.54426.9442.14438.18440.54440.2210.472.382nd443.67460.42435.05433.93443.673rd438.80443.32443.82447.00438.804th455.91431.16427.44438.2455.91
表3 Lp-PLA2线性统计结果
Tab.3 Evaluation results of linearity of Lp-PLA2

Dilution gradient 1st test(ng/ml)2nd test(ng/ml)3rd test(ng/ml)x(ng/ml)Theoretical value (ng/ml)L 0.10 0.10 0.10 0.10 0.100.9L+0.1H97.0595.1195.5495.9093.000.8L+0.2H218.35225.63206.67216.88186.000.7L+0.3H333.93321.60305.17320.23279.000.6L+0.4H393.82401.55426.54407.30372.000.5L+0.5H513.53527.56492.26511.12465.000.4L+0.6H636.61606.99641.10628.23558.000.3L+0.7H720.67690.09718.29709.68651.000.2L+0.8H741.57779.51764.08761.72744.000.1L+0.9H816.85811.80852.23826.96837.00H894.67941.07954.69930.14930.00
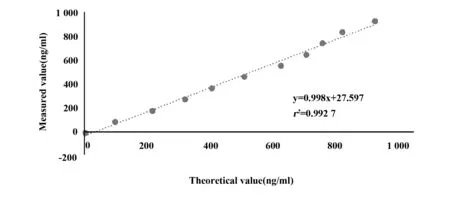
图1 Lp-PLA2检测线性回归方程曲线Fig.1 Linear regression equation curve of Lp-PLA2
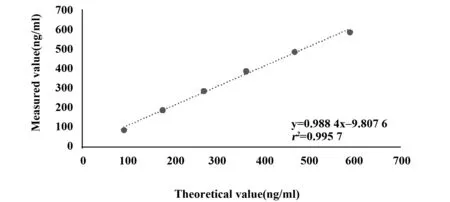
图2 Lp-PLA2正确度评价回归方程曲线Fig.2 Accuracy evaluation of regression equation curve of Lp-PLA2
表4 Lp-PLA2正确度评价结果
Tab.4 Evaluation results of trueness of Lp-PLA2

Dilution gradientL4L+H3L+2H2L+3HL+4HHTheoretical value(ng/ml)90.00190.00290.00390.00490.00590.001st test(ng/ml)100.49177.69279.25381.12469.20597.772nd test(ng/ml)89.93181.99267.87366.07467.74581.353rd test(ng/ml)84.29172.88257.17338.11468.23591.53x(ng/ml)91.57177.52268.10361.77468.39590.22Recovery(%)101.7093.4092.4092.8095.60100.00
表5 326例Lp-PLA2检测结果在医学决定水平处的预期偏差
Tab.5 Expected bias of 326 cases at medicine decide level of Lp-PLA2
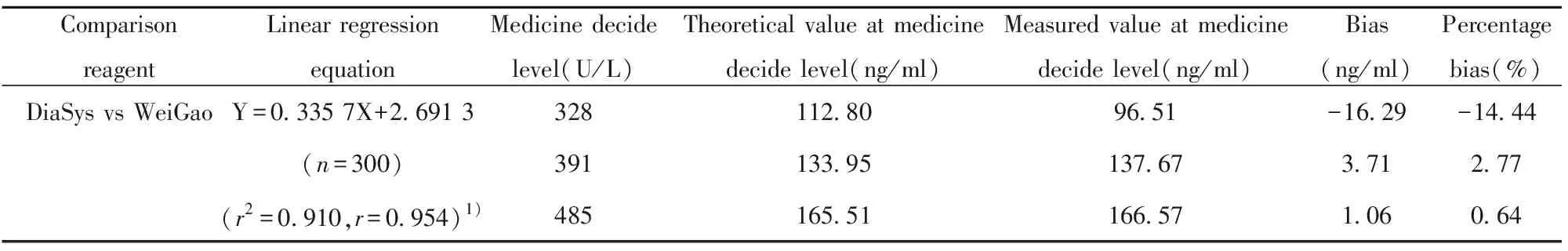
ComparisonreagentLinear regressionequationMedicine decidelevel(U/L)Theoretical value at medicinedecide level(ng/ml)Measured value at medicinedecide level(ng/ml)Bias(ng/ml)Percentagebias(%)DiaSys vs WeiGaoY=0.335 7X+2.691 3328112.8096.51-16.29-14.44(n=300)391133.95137.67 3.71 2.77(r2=0.910,r=0.954)1)485165.51166.57 1.06 0.64
Note:1)P<0.001.
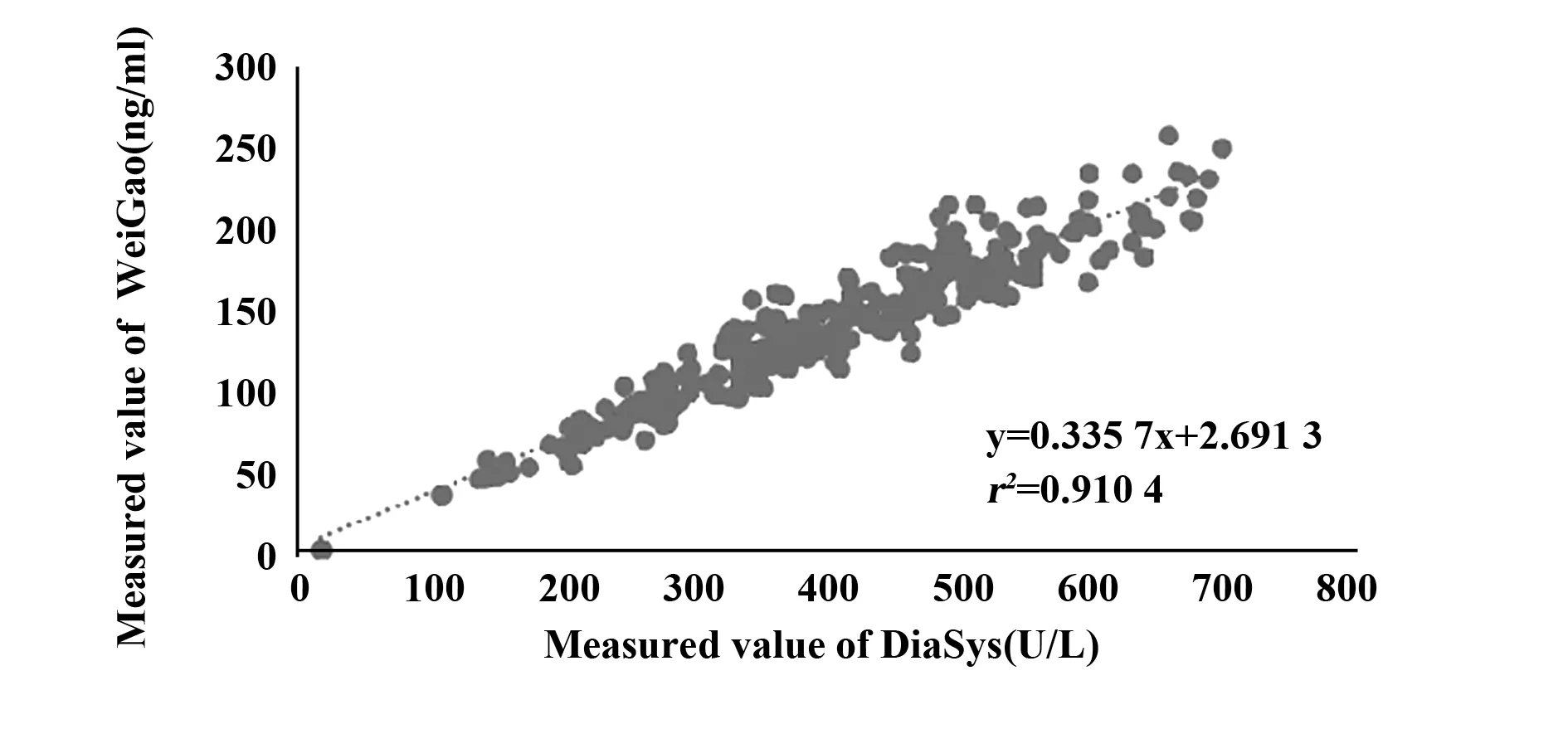
图3 临床样本Lp-PLA2比对回归方程曲线Fig.3 Curve of regression equation of clinical sample for Lp-PLA2
2.3正确度评价 正确度验证结果在仪器运行正常且精密度通过的前提下进行,回收率分别是101.70%、93.40%、92.40%、92.80%、95.60%、100.00%,该项目实测回收率在允许±10%偏差范围内说明正确度验证通过,且该项目线性方程为y=0.988 4x-9.807 6,相关系数r2=0.995 7,符合要求。正确度评价结果见表4,线性回归方程曲线见图2。
2.4携带污染率评价 实验结果通过携带污染率公式计算本实验的携带污染率为1.058%,小于5%的要求。
2.5参考区间评价 试剂厂家提供的生物参考区间为41.24~199.82 ng/ml,本次验证的40例健康者血清的检测结果均在生产厂商声明的参考区间内,说明该生物参考区间适用于本实验室。
2.6临床样本比对实验及偏差评估 临床样本比对回归方程的截距(Intercept)和斜率(Slope)分别为2.691(95%CI∶-2.459~7.842)和0.336(95%CI∶0.323~0.348),r为0.954,相关性良好,见图3。在医学决定水平处的预期偏差分别为-14.44%、2.77%、0.64%,数据见表5。
3 讨论
参照 CLSI 文件对国内第一家Lp-PLA2化学发光法质量检测试剂(威海威高)精密度、分析测量范围、正确度、携带污染率、参考区间验证等指标评价,结果显示,批内不精密度不超过4.61%,批间不精密度不超过3.91%;分析测量范围内线性方程系数为0.998,相关系数r2为0.992 7;正确度评价结果符合正确度评价要求(回收率在±10%范围内,线性方程为y=0.988 4x-9.807 6,相关系数r2=0.995 7),携带污染率和参考范围验证均符合生产厂商声明的可接受范围;与上海德赛酶活性法试剂进行临床样本比对,结果一致性良好。因此该试剂相关性能指标可满足预期要求,符合实验室质量要求。
Lp-PLA2 作为一种新型炎症标志物正在不断引起医学界的广泛关注,人体循环中的Lp-PLA2主要由各种炎症细胞分泌(包括成熟的单核-巨噬细胞、T淋巴细胞、肥大细胞等),进入循环系统中转化为分泌型Lp-PLA2,其中大约80%的分泌型Lp-PLA2结合在LDL-C,其余20%的部分与高密度脂蛋白胆固醇(High density liptein cholesterol,HDL-C)或其他脂蛋白结合[1]。Lp-PLA2可以特异性水解LDL中的氧化型磷脂,并生成两种强效促炎物质溶血卵磷脂(Lysopho-sphatidyl choline,Lyso-PC)和氧化游离脂肪酸(Oxidized free fatty acids,OxFA),后两者通过上调细胞因子和黏附因子的表达,促进单核细胞由管腔向动脉壁趋化,并促进内皮细胞凋亡,Lyso-PC和OxFA还可以促进基质金属蛋白酶的生成,进一步加速动脉粥样硬化斑块形成[12]。《脂蛋白相关磷脂酶 A2 临床应用专家建议》[4]推荐针对一些符合条件的人群检测其血清Lp-PLA2浓度水平可能对预测心血管疾病风险及发生急性冠脉疾病患者的近期、远期预后有一定的作用,因此Lp-PLA2 作为防治动脉粥样硬化的新靶点,具有广阔的前景。
Lp-PLA2的测定方法很多,液相色谱-串联质谱测定法、放射免疫测定法、酶联免疫吸附实验等方法。但是这些方法因灵敏度低、易受到内源性物质的干扰、操作繁琐、耗时较长、成本较高等缺点,不利于临床实验室应用[13,14]。目前临床实验室测定 Lp-PLA2 的方法主要有测定酶活性法和质量法两种,既往研究显示,酶活性法测定比质量法测定更加准确,其原因可能由于质量法的原理是利用抗原抗体结合进行检测,Lp-PLA2与LDL-C的结合阻碍了抗体对酶的检测,使得检测结果不能反映Lp-PLA2的真实水平[15]。但是质量法灵敏度和特异性高,不受体液中其他物质的影响特别是抑制剂和激活剂的影响,为指南中明确推荐的检测项目[4]。如果质量法检测结果能与活性法达到良好的一致性,则更有利于临床应用。上海德赛试剂是目前公认的Lp-PLA2活性检测试剂,故本研究选择与之进行比对,选取326例大样本临床标本,结果呈现了良好的相关性,在推荐的医学决定水平处的偏差均不显著,提示本试剂与上海德赛活性试剂具有较好的检验结果一致性。但是此两种方法的检验结果一致性是否能够满足临床应用,尚需进一步的相关临床样本的深入研究。
总之,Lp-PLA2化学发光法质量测定试剂弥补了传统免疫学方法耗时长等缺点,利于Lp-PLA2 在临床的推广应用,但是由于Lp-PLA2是一个较新的检测项目,无经典方法作为参考标准,因此在应用于临床之时其结果与临床的一致性及结果标准化等问题,尚需进一步的研究。

