病毒性脑炎患儿淋巴细胞亚群及脑脊液炎症因子的检测分析①
屠友权 方春艳 吕 勤
(宁波市妇女儿童医院,宁波315012)
病毒性脑炎是儿科常见的中枢神经系统感染性疾病,近年来在儿童中的发病率有增高趋势,主要表现为发热、头痛和抽搐,多数完全恢复,但少数遗留癫痫、瘫痪、智能发育迟缓等后遗症,其发病机制尚未明确,病毒感染后常在患儿体内沿血行及神经播散,引起炎性反应及脑损伤,并导致机体免疫功能的紊乱,淋巴细胞在该病的发生、发展过程中具有重要作用;细胞因子又引起继发性脑损伤[1,2]。本研究通过检测病毒性脑炎患儿淋巴细胞亚群及脑脊液TNF-α、IL-2、IL-6、IL-10水平的变化,探讨其在病毒性脑炎患儿发病中的作用。
1 资料与方法
1.1一般资料 2015年1月~2018年1月宁波市妇女儿童医院住院的病毒性脑炎患儿128例,年龄3~14岁,平均年龄(8.2±5.4)岁,其中男性68例(53.13%),女性60例(46.87%),重症组66例,轻症组62例,参照重型轻型病毒性脑炎诊断标准进行分组[3]。另选取同期在我院儿外科择期手术腰椎间隙麻醉患儿60例作为对照组,男35例,女25例,其中隐睾25例,斜疝病25例,尿道下裂10例,无近期感染及过敏性疾病等病史,无免疫制剂应用,并排除神经系统疾病的患儿,CSF常规、生化检查无异常。所有研究对象没有免疫系统疾病、进行性肝病、肾病、恶性肿瘤、糖尿病、败血症或其他的感染性疾病。
1.2方法
1.2.1治疗方法 轻型组入院后常规给予控制高热、控制抽搐、脱水降颅压、抗病毒等处理;重型组在常规治疗基础上给予甲基强的松龙冲击治疗,用药3 d,减量至1~2 mg/(kg·d),用药3~5 d,同时予大剂量IVIG静脉输注[1 g/(kg·d)],用药2 d,频繁惊厥者加用丙戊酸钠治疗。
1.2.2T淋巴细胞亚群的检测 所有检测者均用EDTA-K2抗凝管空腹抽静脉血1.8 ml,经相应的荧光标记单克隆抗体染色,避光室温孵育20 min,用FACSLysing solution溶血处理,流式细胞仪测定CD3+、CD4+、CD8+、CD19+、CD16+CD56+、CD4+/CD8+、CD4+CD25+淋巴细胞亚群水平。
1.2.3脑脊液TNF-α、IL-2、IL-6、IL-10水平检测 所有检测者于入院24 h内治疗前行腰椎穿刺,收集脑脊液标本,2 000 r/min离心10 min,取上清液置-80℃冰箱待测。采用双抗体夹心酶联免疫吸附法(ELISA)测定TNF-α、IL-2、IL-6、IL-10含量,试剂盒来自美国BD公司,严格按照说明书进行操作。

2 结果
2.1各组间淋巴细胞亚群比较 CD3+、CD4+、CD8+、CD19+、CD16+CD56+、CD4+/CD8+、CD4+CD25+细胞水平在各组间比较差异有统计学意义(P<0.05);CD3+、CD4+、CD4+CD25+、CD4/CD8重型组低于轻型组和对照组(P<0.05),CD8+、CD19+、CD16+CD56+重型组高于轻型组和对照组(P<0.05);轻型组与对照组比较,CD3+、CD4+、CD16+CD56+、CD4+CD25+差异有统计学意义(P<0.05);CD8+、CD19+、CD4+/CD8+差异无统计学意义(P>0.05)。见表1。
2.2各组间脑脊液TNF-α、IL-2、IL-6、IL-10水平比较 病毒性脑炎患儿脑脊液中TNF-α、IL-2、IL-6、IL-10水平在各组间比较差异有统计学意义(P<0.05),重型组高于轻型组和对照组(P<0.05),轻型组高于对照组(P<0.05)。见表2。
2.3治疗前后淋巴细胞亚群比较 CD3+、CD8+、CD19+、CD4+/CD8+细胞水平在治疗前后比较差异有统计学意义(P<0.05),CD4+、CD16+CD56+、CD4+CD25+治疗前后比较差异无统计学意义(P>0.05)。见表3。


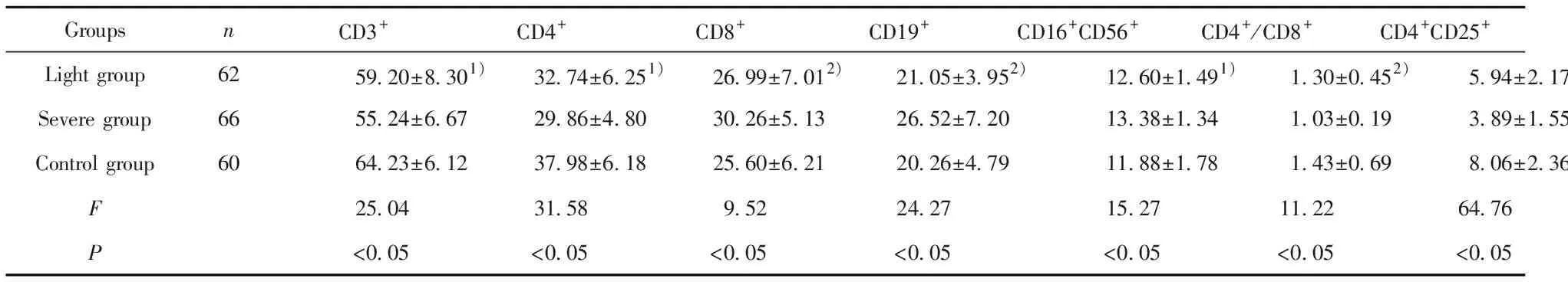
GroupsnCD3+CD4+CD8+CD19+CD16+CD56+CD4+/CD8+CD4+CD25+Light group6259.20±8.301)32.74±6.251)26.99±7.012)21.05±3.952)12.60±1.491)1.30±0.452)5.94±2.171)Severe group6655.24±6.6729.86±4.8030.26±5.1326.52±7.2013.38±1.341.03±0.193.89±1.55Control group6064.23±6.1237.98±6.1825.60±6.2120.26±4.7911.88±1.781.43±0.698.06±2.36F25.0431.589.5224.2715.2711.2264.76P<0.05<0.05<0.05<0.05<0.05<0.05<0.05
Note:Compared with the control group,1)P<0.05,2)P>0.05.



GroupsnTNF-αIL-2IL-6IL-10Light group6267.09±31.58378.46±122.9261.84±29.3119.37±9.14Severe group6687.78±33.39601.77±231.5487.61±18.1234.49±10.46Control group6030.23±11.3385.85±57.3429.90±15.716.38±0.77F68.19168.8993.54187.25P<0.05<0.05<0.05<0.05


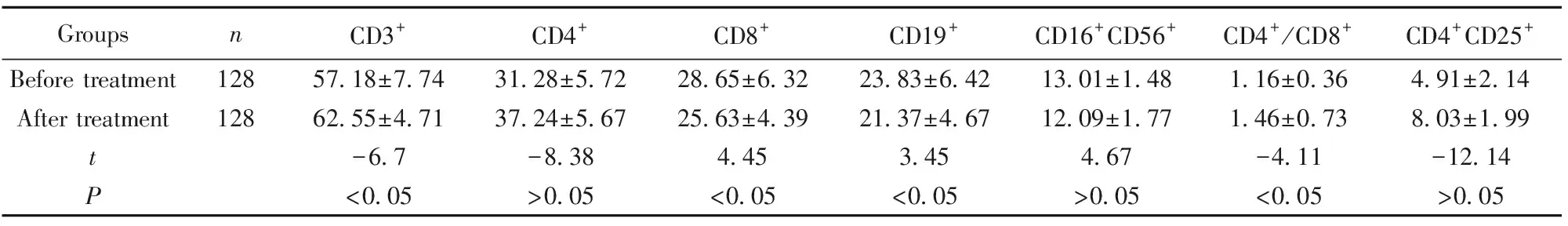
GroupsnCD3+CD4+CD8+CD19+CD16+CD56+CD4+/CD8+CD4+CD25+Before treatment12857.18±7.7431.28±5.7228.65±6.3223.83±6.4213.01±1.481.16±0.364.91±2.14After treatment12862.55±4.7137.24±5.6725.63±4.3921.37±4.6712.09±1.771.46±0.738.03±1.99t-6.7-8.384.453.454.67-4.11-12.14P<0.05>0.05<0.05<0.05>0.05<0.05>0.05

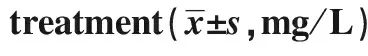
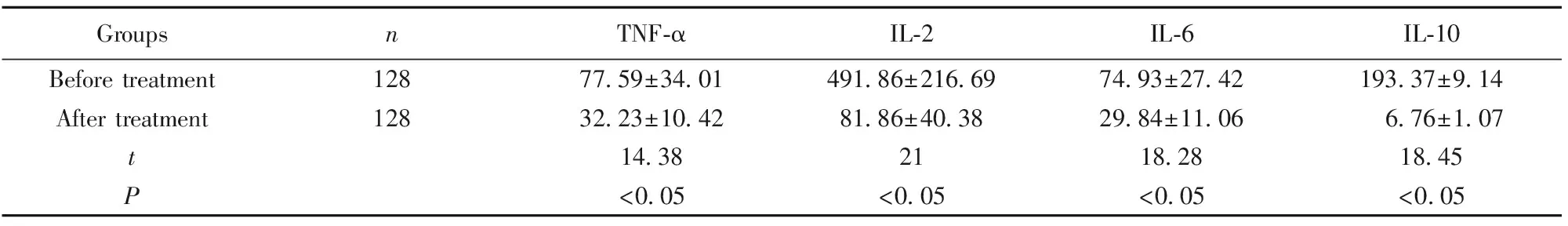
GroupsnTNF-αIL-2IL-6IL-10Before treatment12877.59±34.01491.86±216.6974.93±27.42193.37±9.14After treatment12832.23±10.4281.86±40.3829.84±11.06 6.76±1.07t14.382118.2818.45P<0.05<0.05<0.05<0.05
2.4治疗前后脑脊液TNF-α、IL-2、IL-6、IL-10水平比较 脑脊液TNF-α、IL-2、IL-6、IL-10水平治疗前高于治疗后,差异有统计学意义(P<0.05)。见表4。
3 讨论
病毒性脑炎主要由病毒感染及机体细胞免疫功能降低引起,以脑实质炎症为主的中枢系统疾病。病原体侵入机体及中枢神经系统后,可刺激激活机体免疫细胞,使之活化产生应答,引起宿主对病毒抗原发生免疫反应,继而引起神经元及血管内皮细胞损伤,进一步导致血管及其周围脑组织损害。已有研究表明,病毒性脑炎的发生、发展与机体的免疫功能密切相关,同时大量炎症因子的产生和释放又会破坏机体的免疫平衡,产生多种病理损伤[4,5]。
在本研究中,重型组CD3+、CD4+T 淋巴细胞、CD4+/CD8+、CD4+CD25+较轻型组与对照组明显降低(P<0.05),CD3+代表T淋巴细胞水平,我们推测其降低表明重型组病毒性脑炎患儿T细胞免疫功能降低,CD4+是具有辅助性T细胞亚群,它可以刺激B细胞产生抗体,可以分为Th1和Th2两种类型,它们通过所分泌的细胞因子相互调节,正常情况下,二者处于相对平衡状态以维持机体免疫功能的平衡,当机体受到异常抗原刺激时,上述平衡被打破,可引起异常的免疫应答。Th1主要参与细胞免疫,其分泌的IL-2和TNF-α是其特征因子。Th2 细胞主要刺激B细胞产生抗体,参与体液免疫,维持着机体细胞免疫和体液免疫正常的功能,其主要分泌IL-6、IL-10等细胞因子。本研究结果显示,病毒性脑炎患儿重型组和轻型组CD4+T淋巴细胞比对照组降低,其中Th1类细胞因子IL-2和TNF-α升高,Th2类细胞因子IL-6、IL-10也升高,其水平重型组高于轻型组,轻型组高于对照组,治疗前高于治疗后,我们分析过病毒性脑炎患儿尽管Th细胞减少,但免疫状态异常,Th1和Th2类细胞因子同时升高,Th1/Th2比例失衡在其炎性反应中起着重要作用。有研究表明病毒性脑炎的发生是Th1型细胞和Th2型细胞相互作用、相互反馈的过程[6,7],病毒侵犯中枢神经系统时,活化的免疫细胞释放IL-2、TNF-α、IL-6、IL-10等细胞因子,其分泌不平衡,不能维持Th1/Th2平衡,机体的促炎能力强于抑炎能力,对脑组织造成损害;也有报道病毒感染产生的TNF-α、IL-2、IL-6、IL-10对未感染细胞是一种保护机制,促使机体建立抗病毒状态,阻止病毒扩散,我们分析其在病毒性脑炎中也起到了抗病毒作用[8]。另一方面IL-2、TNF-α、IL-6、IL-10水平和病情轻重及转归密切相关,这与国内相关报道一致[9]。另外,本研究中重型组和轻型组IL-2水平均较对照升高,重型组又高于轻型组,其水平随着病情加重而升高,间接反映了脑损伤的严重程度,但IL-2自身并不具有抗病毒的功能,可能是IL-2与TNF-α、IL-6、IL-10构成了炎症因子系统,共同参与脑组织神经元损伤过程。有研究表明TBEV菌株感染后的小鼠脑组织IL-2 水平显著升高[10],IL-2对T细胞增殖有影响,外周感染TBEV后,外周组织如淋巴结和脾脏发生原发性T细胞活化,然后TBEV进入中枢神经系统后,T细胞浸润脑部感染部位,提示IL-2是重症脑炎致病关键因素。本研究中重型组CD8+T、CD19+B淋巴细胞较轻型组与对照组显著升高(P<0.05),CD8+T细胞代表细胞毒性T 细胞和抑制性T细胞,主要发挥特异性杀伤靶细胞的功能,从而引起靶细胞的溶解与凋亡,有利于病毒的清除,但同时这种特异性杀伤靶细胞的功能若过度激活,也对脑组织损害造成严重损害,有报道称CD8+T淋巴细胞介导的细胞毒性反应可能是单纯疱疹病毒性脑炎患者的脑损伤的重要病因[11];CD19+是B淋巴细胞表面标志分子,其在病毒性脑炎患儿中升高,与Atkinson等[12]报道一致,我们分析B淋巴细胞活化分化成熟为浆细胞,并分泌产生自身抗体,从而引起神经组织的损伤,这是病毒性脑炎患儿的重要发病因素。重型组和轻型组CD16+CD56+比对照组明显升高,CD16+56+代表的自然杀伤细胞(NK 细胞)是机体的第一道防御屏障,在清除病毒感染中起重要作用,病毒性脑炎患儿中其表达升高;我们推测患儿病毒刺激后应激能力增强和其发病有关。但病毒性脑炎患儿重型组CD4+/CD8+比值较轻型组与对照组明显降低,我们推测二者的免疫平衡功能紊乱在该疾病过程中起重要作用。CD4+CD25+调节性T细胞在机体的免疫调节中发挥作用,可通过调节Th1/Th2平衡,抑制Th2细胞的分化而强化Th1细胞的活性。本试验中重型组和轻型组淋巴细胞CD4+CD25+较对照组明显降低,我们推测CD4+CD25+减少对Th2 抑制作用减弱,导致Th1/Th2失衡,可能是病毒性脑炎发生的原因之一,有报道称病毒性脑炎中CD4+CD25+调节性T细胞存在缺陷[13]。
本研究结果显示,病毒性脑炎患儿治疗后CD3+、CD4+/CD8+较治疗前升高,CD8+、CD19+较治疗前降低,治疗前后比较有统计学意义。CD3+治疗后升高,表明T细胞免疫功能在升高;CD4+/CD8+比值在治疗后升高,我们推测二者的免疫平衡功能在病情好转时恢复,这对疾病预后有重要提示意义;CD8+细胞杀伤作用能够清除病毒,治疗后病毒载量减少,其激活也减少,同时也减轻了因其过度激活对正常脑细胞的损害[11];CD19+分泌的抗体是病毒性脑炎患儿脑损伤的重要因素,治疗后对抗原的特异性识别减少,产生抗体也相应减少,因此B淋巴细胞水平下降,体液免疫功能恢复。虽然治疗后CD4+、CD16+CD56+、CD4+CD25+和治疗前比较差异不明显,可能与样本量和预后分组有关系,但也是在趋向好转,我们分析淋巴细胞亚群水平和病情密切相关,治疗后免疫功能的恢复有助于疾病的恢复。本研究中治疗后IL-2、TNF-α、IL-6、IL-10水平较治疗前明显降低,我们分析病毒性脑炎发病时病毒感染中枢系统引起炎症反应,这一过程产生了IL-2等细胞因子,应用糖皮质激素等药物进行治疗后炎症反应被抑制,这些细胞因子含量也减少。
综上所述,病毒性脑炎的发病及预后与T、B 淋巴细胞和NK 细胞功能紊乱及脑脊液IL-2、NF-α、IL-6和IL-10水平相关,其与病情进展的相关性有待扩大样本进一步研究。

