基质辅助激光解吸质谱成像在药用植物分析中的应用
刘芳 张琳 张志信 张四纯
摘要:基质辅助激光解吸电离质谱作为一种软电离质谱技术,可快速、可靠地从植物组织中获得分子组成结构信息,还可以通过成像的方式获得成分分布信息,因此在药用植物分析中受到了越来越多的关注。本文对基质辅助激光解吸电离质谱成像技术及其在药用植物分析中的应用进行了总结和展望。
关键词:基质辅助激光解吸质谱成像;药用植物;直接分析;评述
1引言
药用植物作为药物开发的重要资源受到了越来越多的重视,其成分分析成为生化、制药和临床研究的重要课题[1]。随着仪器分析技术的发展,紫外光谱(UV)[2]、红外光谱(IR)[3~5]、拉曼光譜(RamanSpectrum)[6]、色谱(GC/HPLC)[7~9]、质谱(MS)[10]和核磁共振光谱(NMR)[11]等技术被广泛用于药用植物鉴定、化学成分分析及指纹图谱的建立,推动了药用植物成分定性和定量分析的研究。其中,质谱技术因具有较高的分辨率、选择性和灵敏度成为药用植物质量控制、活性成分筛选及药理毒理研究的有效工具。
基质辅助激光解析电离质谱(MALDI-MS)是20世纪80年代后期发展起来的一种“软”电离质谱技术,具有碎片少、灵敏度高、分辨率高和高通量等特点,非常适用于复杂样品体系研究[12]。采用MALDI-MS分析蛋白质、多肽等生物大分子时,可直接分析完整的蛋白质分子,并具有高灵敏度、高离子传输和高采集速率的优点,在生物化学领域得到了极大的关注,成为蛋白质组学研究的有利工具[13]。新型基质材料和基质抑制剂以及无基质材料的使用推动了小分子化合物的MALDI-MS检测的发展,此项技术的应用范畴也进一步扩展。MALDI-MS与成像技术结合,通过对组织切片表面的扫描,实现了组织中的分子(如蛋白质、多肽、代谢产物)的原位分析,获得了其空间分布信息,在药用植物分析中具有很大的应用潜力。已有一些综述文章对各种质谱成像技术在植物内源性分子原位表征中的应用进展进行了介绍[14]。本文主要针对MALDI-MS成像技术在药用植物分析中的应用进行了评述,对该领域的研究工作进行了总结和展望。
2基质辅助激光解吸质谱成像技术
2.1MALDI-MS的原理
目前被广泛采用的MALDI-MS技术主要是MALDI与飞行时间质量分析器(Timeofflight,TOF)两者的组合,工作原理如图1所示。样品与基质先形成共结晶,激光(337nm的氮激光或355nm的固体激光)照射后,基质吸收大部分的激光能量,将样品分子送入气相。同时,吸收能量后的基质瞬间由固态变成气态,形成基质离子。被分析物与基质离子相互碰撞的过程中,通过能量交换离子化。带电荷的离子在飞行时间质量分析器中按照质荷比(m/z)的不同先后到达检测器进行检测[15]。离子化过程中,基质先吸收激光的能量,然后再传递给样品,对样品起到了保护作用,所以离子化条件比较温和;其次,高浓度的基质将样品分子彼此分开,减弱了样品分子之间的相互作用,使被分析物不容易形成簇群,因此它是一种软电离技术,并具有高耐盐、灵敏度高、准确度高等特点,适用于大分子物质和复杂样品的测定。
2.2MALDI-MS的基质选择
在MALDI-MS技术中,基质对样品的离子化起至关重要的作用,不同基质对分析物的离子化效率不同。近年出现了大量适用于生物大分子分析的基质,如α-氰基-4-羟基肉桂酸(α-Cyano-4-hydroxycinnamicacid)、2,5-二羟基苯甲酸(2,5-Dihydroxyben-zoicacid)、2,5-二羟基苯乙酮(2,5-Dihydroxyacetophenone)、芥子酸(3,5-Dimethoxy-4-hydroxycinnamicacid)、3-羟基吡啶甲酸(3-Hydroxypicolinicacid)。但上述基质大多在低分子量区域产生离子峰,使得小分子物质的检测受到了限制。随着碳、硅、纳米金等无机材[16],新型有机分子基质[17]的出现,以及基质抑制剂[18]和无基质材料[19]的使用,小分子化合物的MALDI检测成为了可能[20~22],此技术在药用植物分析中的应用也得到了进一步的发展。
2.3MALDI-MS成像的操作流程
MALDI-MS成像(MALDI-MSI)的一般过程如图2所示:在低温(-16~-20℃)环境下,使用冷冻切片机将样品进行切片,获取厚度为10~20μm的组织切片;将该组织切片用激光扫描仪进行扫描,选用合适的基质,借助于基质喷涂仪将其均匀覆盖于组织切片表面,使基质与分析物在原位形成共结晶。随后,将装载了组织切片的靶板送入质谱仪进行质谱成像。


由MALDI-MSI的原理和操作流程可知,与其它药用植物分析技术相比,MALDI-MSI具有以下特点[23,24]:可对植物组织切片直接进行分析,样品制备过程简单;获取组织空间分布图像时不需对组织中的检测分子进行体外标记或染色,操作方便;具有较高的检测灵敏度及较强的分子鉴定能力,测定时可在组织切片中同时找到多种分子,并提供这些分子在组织中空间分布的信息,为寻找、阐明和鉴定重要分子等提供了快速、原位、可视化的结果。
2.4MALDI成像与其它质谱成像技术的比较
除MALDI-MSI外,质谱成像技术还有很多种,目前应用较多的是二次离子质谱成像(Secondaryionmassspectrometryimaging,SIMSimaging)和解吸电喷雾离子化质谱成像(Desorptionelectrosprayionizationmassspectrometryimaging,DESI-MSI)。这两种质谱成像方法的电离方式和MALDI不同,都无需基质,避免了基质质谱峰的干扰,同时还避免了由基质对样品的溶解所引起的待测分子移位现象,确保了质谱成像的准确性。然而,DESI-MSI的空间分辨率较低,仅为100~200μm,并且难以实现对蛋白质大分子和非极性物质的解离。SIMSimaging是目前空间分辨率最高的质谱成像方法,可达50nm,但它的电离方式易产生碎片离子,而且对分子量>2kD的分析物显现出较低的灵敏度[25,26]。
相比而言,MALDI-MSI可测定的分子质量范围最宽,但空间分辨率不及SIMSimaging。Soltwisch等[27]通过使用波长可调谐的位置化激光器在气相中二次引发类似MALDI的离子化过程,提高了电离效率,同时分辨率也达到了微米级以下。目前,MALDI-MSI还存在不适合样品定量分析的问题。这是由于基质与样品形成的共结晶在组织切片上分布不均匀,以及激光会剥蚀结晶表面造成样品的损耗等原因造成的[28]。
3药用植物的MALDI-MSI分析
MALDI-MS的软离子化方式对待测物的破坏很小,形成的离子多是单电荷离子,谱图解析更容易,因此在药用植物相关领域逐渐得到关注[29~32]。对药用植物成分进行分析时,以往需要将药用植物研磨成粉末,然后选用合适的溶剂来进行提取、分离和纯化,纯化后的成分进行测定。提取时常需采用不同的溶剂,并通过色谱进行分离,样品制备过程复杂费时,导致活性成分被损坏或损失。而且,通过单一的样品制备过程也不能将药用植物中的活性成分完全提取出来,导致了分析结果的不准确性。因此,对药用植物组织的化学成分进行直接分析显得尤为重要。
3.1药用植物MALDI-MSI分析的制备技术
药用植物的MALDI-MSI分析是否能获得高质量的质谱与样品的制备技术密切相关[33,34]。组织切片的制备是MALDI-MSI的关键环节之一。冷冻切片因具有快速、简便、易操作、易于保持组织原有形态等优点,成为MALDI-MSI样品切片的首选方法[35]。植物细胞因有细胞壁和大液泡,含水量较多,在低温冷冻过程中容易形成冰晶。对于不同的植物,甚至同一植物的不同器官,其质地及含水量的差异也较大,因此给切片過程造成了困扰[36~38]。
通常植物组织在切片前先将其在-80℃冷冻,冷冻后的样品使用冷冻切片包埋剂(OCT)、磷酸盐缓冲溶液(PBS)或水进行固定[39]。使用OCT时只能固定样品,不能将样品包埋起来,因为OCT含有的多聚物会严重干扰质谱测定。切片温度选择-16~-20℃时可获得厚度为10~20μm的完整切片,温度过低易导致植物组织片破碎。组织切片越薄,图谱质量越好。
切片后将基质溶液均匀地覆盖于组织切片表面,与组织表面分子形成良好的共结晶。基质覆盖的方法主要有3种:手动喷涂、全自动喷雾和真空升华[40]。Huang等[41]利用一个小型加湿器沉积基质,不但成本低廉,而且获得了直径<10μm的基质晶体,提高了灵敏度。目前,还出现了利用多孔纳米材料开发出来的离子化辅助基板[19],利用毛细作用使待测样品的分子上升到组织切片表面,实现成像分析。这种离子化辅助基板的使用省略了基质覆盖的操作步骤,极大缩短了样品的处理时间。但只适用于小分子化合物的分析,并且离子化的机理还不清楚。
3.2MALDI-MSI在药用植物分析中的应用
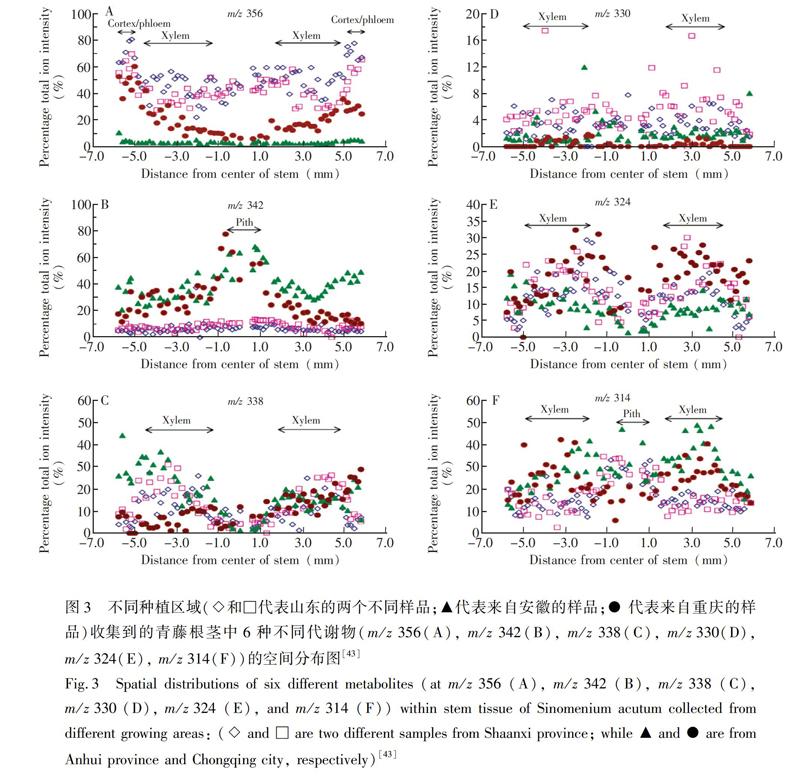
MALDI是研究内源性代谢产物的有力工具。Wu等[42]对4种药用植物进行了MALDI-MS测定,结果表明,使用MALDI-MS直接分析药用植物切片,进而可快速提供可靠有效成分信息。这种从植物组织的直接分析中快速收集信息的方法,对于新化合物的发现和药用植物的质量控制具有重要价值。Ng等[43]在MALDI-MS对药用植物组织直接测定的基础上,通过改良MALDI靶板,记录激光照射植物组织时垂直和水平轴的位置,然后根据不同产地青藤茎部组织区域径向距离对应的6种代谢物的质谱信号(图3),发现不同生长区域的青藤茎部3种代谢物(m/z356、342和314)呈特异性空间分布,其它代谢物则没有表现出这种特点。这项研究表明,MALDI-MS是一种对药用植物代谢物空间分布研究具有潜力的方法。
在专门的成像软件控制下,目前的MALDI-MSI技术就可实现采集数据后自动成像的功能,并同时提供样本表面多种分子组成、丰度及原位空间分布信息,因此,该项技术在药用植物研究方面凸显优势,已逐渐成为质谱领域的研究新趋势之一(表1)。
MALDI-MSI用于人参皂苷的研究较多,Taira等[44]用MALDI-MSI观测了人参皂苷Rb1、Rb2、Rc和Rf的分布,发现人参皂苷在侧根皮层和周皮中的分布比髓质多。同时,皂苷在根尖(直径2.7mm)处的分布多于根的中心(直径7.3mm)。原人参二醇型人参皂苷(Rb1、Rb2、Rc)与原人参三醇型皂苷(Rf)的分布量也存在差异。Bai等[48]利用MALDI-MSI建立了一种简单、可靠的方法直接检测人参组织中的皂苷,共检测到20种原人参二醇型皂苷、7种原人参三醇型皂苷、1种齐墩果酸型皂苷以及3种其它类型皂苷,并通过MALDI-TOFMS/MS进行了鉴定。这些皂苷依据人参根部的植物学结构,明显呈现出5种独特的分布模式(图4),这可对特定组分的提取提供帮助。同时,以1117.5和1147.5两处谱峰为依据,将形貌相似而年龄不同的3种人参区分开来。Wang等[57]以3种人参属的药用植物人参、西洋参和三七为样品,利用MALDI-MSI检测到了51种皂苷,并给出了它们的分布位置,发现皂苷的分布模式和富集位置在不同参类中有着巨大的差异。并通过对富集位置数据的主成分分析(PCA),筛选出了16种鉴别参类的有效标志物,实现了对3种不同人参属药物的快速鉴别。

长春花因含有抗肿瘤活性的萜类吲哚生物碱(TIA)而闻名。Yamamoto等[52]利用MALDI-MSI和活体单细胞质谱研究了TIA在长春花茎中的特异性分布。质谱成像表明,大部分TIA位于异细胞和乳管中。他们还讨论了TIA在异细胞以及乳管中合成与累积的意义,对药用植物次生代谢产物其它方面的研究提供了参考。Heskes等[54]在利用MALDI-MSI寻找到穗花牡荆中二萜类化合物主要分布于果实和叶子毛状体的基础上,通过对毛状体特异性转录组数据库的分析,鉴定出参与二萜化合物生物合成的7个候选基因。Kusari等[47]以金丝桃属植物为研究对象,采用高分辨率MALDI-MSI技术对两种金丝桃属植物叶片的金丝桃素及其前体化合物的分布进行了研究。通过与不含金金丝桃素的植物中相同前体物-大黄素分布的比较,证实了金丝桃素的生物合成理论。同时也对另一种前体物质大黄素蒽酮的分布和合成进行了分析。这项研究工作为进一步研究金丝桃素生物合成途径提供了理论依据,也为药用植物代谢物的生物合成途径研究提供了参考。
Beck等[50]利用MALDI-MSI技术得出了银杏叶中黄酮苷的分布情况,用于研究生物/非生物胁迫和防御机理对分布的特异性进行阐述。黄酮苷分布于叶片的各个部位,但维管束附近含量较高,因为只有在叶片内部均匀分布的情况下,叶片的紫外线防护功能才能发挥作用。同时,他们还发现双黄酮类化合物主要位于叶片的表面,而双黄酮被认为是一种真菌毒素,对昆虫也具有威慑力的物质,根据这一结果,可以得出银杏叶的叶片下面是真菌或昆虫入侵的一个主要位置的结论。
MALDI-MSI除用于药用有效成分分析之外,还被用于蛋白组学以及药物在生命体中的代谢机制研究。植物的内源肽会影响细胞的分裂、發育、结瘤、繁殖、共生固氮体系以及防御反应,因此需要揭示其在分子水平上的作用。Gemperline等[49]通过对蒺藜苜蓿种数百种内源肽以及蛋白片段的成像,发现不同生长阶段的内源肽总数和空间分布存在差异性,为进一步研究内源肽在药用植物物生长中的功能提供了参考。Yang等[58]利用MALDI-MSI对玛卡中提取得到的咪唑类生物碱在小鼠组织中的代谢机制及分布进行了分析,这种无标记的原位成像技术将有助于推进药理作用机制的研究。
4总结与展望
MALDI-MS具有如高通量、高灵敏度、易于样品制备和快速分析等优点,与成像技术结合可实现原位分析,为药物活性成分的空间分布情况提供了理论依据,也为进一步研究药用植物中代谢物的生物合成途径、储存与运输过程奠定了基础。但研究过程中仍然存在不足之处:MALDI离子源对一些低丰度化合物的离子化效率不高;由于不同部位的组织结构不同,在制备植物样品切片过程中需采用不同的切片技术,成像效果不易掌握;切片后基质的调和、涂布、干燥等流程耗时较长,基质涂布的均匀性等对MALDI技术在药用植物分析应用中的推广产生了一定的制约作用。随着离子化效率和成像速率的提升,省时、省力、能大幅提高成像分辨率和重现性的样品前处理方法的出现,该项技术在药用植物的研究中将发挥越来越大的作用。
References
1BoyHIA,RutillaAJH,SantosKA,TyAMT,YuAI,MahboobT,TangpoongJ,NissapatornV.DigitalChineseMed.,2018,1(2):131-142
2WANGYuan-Zhong,ZHONGGui,ZHANGJi,ZHAOYan-Li,YANGTian-Mei,ZHANGJin-Yu.SpectroscopyandSpectralAnalysis,2016,36(6):1789-1793
王元忠,钟贵,张霁,赵艳丽,杨天梅,张金渝.光谱学与光谱分析,2016,36(6):1789-1793
3LIYan-Zhou,MINShun-Geng,LIUXia.SpectroscopyandSpectralAnalysis,2008,28(7):1549-1553
李彦周,闵顺耕,刘霞.光谱学与光谱分析,2008,28(7):1549-1553
4LIYun,XUFu-Rong,ZHANGJin-Yu,WANGYuan-Zhong.SpectroscopyandSpectralAnalysis,2017,37(8):2418-2423
李运,徐福荣,张金渝,王元忠.光谱学与光谱分析,2017,37(8):2418-2423
5TUYa,BAIJin-Liang,ZHOUQun,SUNSu-Qin.ChineseJ.Anal.Chem.,2011,39(4):481-485
图雅,白金亮,周群,孙素琴.分析化学,2011,39(4):481-485
6LINing,ZHUANGZheng-Fei,GUOZhou-Yi,XIONGKe,CHENSi-Jin,LIShao-Xin,LIRui.ChineseJournalofMedicalPhysics,2012,29(1):3173-3176
李宁,庄正飞,郭周义,熊柯,陈思瑾,李绍新,李锐.中国医学物理学杂志,2012,29(1):3173-3176
7ZHANGBing,CHENXiao-Hui,BIKai-Shun.ChineseJournalofPharmaceuticalAnalysis,2010,30(2):233-235
张冰,陈晓辉,毕开顺.药物分析杂志,2010,30(2):233-235
8XUXiao-Qin,HUGuang-Lin,WANGXiao-Ru,LEEFSC.JournalofInstrumentalAnalysis,2004,23(4):112-117
徐晓琴,胡广林,王小如,LEEFSC.分析测试学报,2004,23(4):112-117
9SUNYan-Ni,ZHANGNing,WANGCui-Ling,LIUZhu-Lan,WANGZheng,LIUJian-Li.ChineseJ.Anal.Chem.,2014,42(2):237-277
孙艳妮,张宁,王翠玲,刘竹兰,王征,刘建利.分析化学,2014,42(2):237-277
10DAIYu-Lin,YUEHao,SUNChang-Jiang,GUOYun-Long,ZHENGFei,LIJing,LIUShu-Ying.ChineseJ.Anal.Chem.,2015,43(8):1181-1186
戴雨霖,越皓,孫长江,郭云龙,郑飞,李晶,刘淑莹.分析化学,2015,43(8):1181-1186
11GUOXin-Tian,YUZhong-Yi.AcademicJournalofShanghaiUniversityofTraditionalChineseMedicine,2017,31(4):92-98
郭心甜,俞仲毅.上海中医药大学学报,2017,31(4):92-98
12CaiZW,LiuSY.ApplicationsofMALDI-TOFSpectroscopy.BerlinHeidelberg:Springer-Verlag,2013:146
13HosseiniS,Martinez-ChapaSO.FundamentalsofMALDI-TOF-MSAnalysis.Singapore:SpringerNature,2017:2-4
14HEHui-Xin,CHENLu-Lu,QINLiang,LIUYa-Qin,WANGXiao-Dong.ScientiaSinica(Vitae),2017,47(10):1043-1064
何慧欣,陈路路,秦亮,刘亚琴,王晓东.中国科学:生命科学,2017,47(10):1043-1064
15HillenkampF,Peter-Katalinic′J.MALDIMS.Weinheim:Wiley-VCHVerlagGmbH&Co.KGaA,2007:40-71
16ZHANGSen,NIYu,LIShu-Qi,KONGXiang-Lei.Prog.Chem.,2014,26(1):158-166
张森,倪彧,李树奇,孔祥蕾.化学进展,2014,26(1):158-166
17SUNJie,HEQing,XUEJin-Juan,XIONGCai-Qiao,LIUHui-Hui,CHENSu-Ming,NIEZong-Xiu.ScientiaSinica(Chimica),2016,46(10):1119-1125
孙洁,何清,薛晋娟,熊彩侨,刘会会,陈素明,聂宗秀.中国科学:化学,2016,46(10):1119-1125
18GuoZ,ZhangQC,ZouHF,GuoBC,NiJY.Anal.Chem.,2002,74(7):1637-1641
19NaitoY,KotaniM,OhmuraT.RapidCommun.MassSpectrom.,2018,32(21):1851-1858
20XuSY,LiYF,ZouHF,QiuJS,GuoZ,GuoBC.Anal.Chem.,2003,75(22):6191-6195
21LuMH,LaiYQ,ChenGN,CaiZW.Anal.Chem.,2011,83(8):3161-3169
22LiuQ,ChengMT,JiangGB.Chem.Eur.J.,2013,19(18):5561-5565
23LUOZhi-Gang,HEJiu-Ming,LIUYue-Ying,LITie-Gang,HEJing-Jing,ZHANGSi-Chun,ZHANGXin-Rong,ABLIZZeper.ScientiaSinica(Chimica),2014,44(5):795-800
罗志刚,贺玖明,刘月英,李铁钢,何菁菁,张四纯,张新荣,再帕尔·阿不力孜.中国科学:化学,2014,44(5):795-800
24RohnerTC,StaabD,StoeckliM.Mech.AgeingDevelop.,2005,126(1):177-185
25PEIXing-Li,GONGCan.JournalofTechnology,2017,17(4):369-370
裴兴丽,龚灿.应用技术学报,2017,17(4):369-370
26ZHANGQi-Yue,NIEHong-Gang.AnalyticalInstrumentation,2018,(5):1-10
张琦玥,聂洪港.分析仪器,2018,(5):1-10
27SoltwischJ,KettlingH,Vens-CappellS,WiegelmannM,MuthingJ,DreisewerdK.Science,2015,348(6231):211-215
28TaiwanSocietyforMassSpectrometry.PrinciplesandApplicationsofMassSpectrometry.Beijing:SciencePress,2019:31
台湾质谱学会.质谱分析技术原理与应用.北京:科学出版社,2019:31
29ZhuF,CaiYZ,XingJ,KeJX,ZhanZQ,CorkeH.RapidCommun.MassSpectrom.,2009,23(11):1678-1682
30LuL,YueH,SongFR,TsaoR,LiuZQ,LiuSY.Chem.Res.ChineseUniver.,2010,26(1):11-16
31MonagasM,Quintanilla-LópezJE,Gómez-CordovésC,BartoloméB,Lebrón-AguilarR.J.Pharmaceut.Biomed.Anal.,2010,51(2):358-372
32WuW,QiaoCF,LiangZT,XuXH,ZhaoZZ,CaiZW.J.Pharmaceut.Biomed.Anal.,2007,45(3):430-436
33XUJing,WANJia-Yu,XUNa,XUQin,LINan,WANGJing-Long,LIUWen-Sen.ChineseJournalofLaboratoryDiagnosis,2012,16(10):1939-1942
徐靜,万家余,许娜,许琴,李楠,王景龙,刘文森.中国实验诊断学,2012,16(10):1939-1942
34SchwartzSA,ReyzerML,CaprioliRM.J.MassSpectrom.,2003,38(7):699-708
35LIJian-Xia,ZHANGChu-Lan,XIAXiao-Fei,ZHAOLiang-Cheng.BulletinofBotany,2014,48(6):643-650
李建霞,张出兰,夏晓飞,赵良成.植物学报,2013,48(6):643-650
36ZHANGJian-Kui,WANGBing,XULiang,KANGTing-Guo.ResearchandPracticeonChineseMedicines,2013,27(1):28-30
张建逵,王冰,许亮,康廷国.现代中药研究与实践,2013,27(1):28-30
37LINYue-Hui,LIHan-Bing,HEXin-Qiang.ChineseBulletinofBotany,2001,18(1):118-120
林月惠,李寒冰,贺新强.植物学通报,2001,18(1):118-120
38LIUJian-Feng,CHENGYun-Qing,YANXiu-Feng,ZHOUGe,WANGShu-Fan.JournalofNanjingForestryUniversity(NaturalSciencesEdition),2006,30(3):128-130
刘剑锋,程云清,阎秀峰,周革,王淑范.南京林业大学学报(自然科学版),2006,30(3):128-130
39SujiuraY,ShimmaS,SetouM.J.MassSpectrom.Soc.JP.,2006,54(2):45-48
40ZHANGYing,LUHao-Jie,YANGPeng-Yuan.JournalofChineseMassSpectrometrySociety,2009,30(4):250-256
张莹,陆豪杰,杨芃原.质谱学报,2009,30(4):250-256
41HuangX,SunJ,XueJJ,LiuHH,XiongCQ,NieZX.Anal.Chem.,2018,90(14):8309-8313
42WuW,LiangZT,ZhaoZZ,CaiZW,J.MassSpectrom.,2007,42(1):58-69
43NgKM,LiangZT,LuW,TangHW,ZhaoZZ,CheCM,ChengYC.Anal.Chem.,2007,79(7):2745-2755
44TairaS,IkedaR,YokotaN,OsakaI,SakamotoM,KatoM,SahashiY.Am.J.ChineseMed.,2010,38(3):485-493
45MarquesJV,DalisayDS,YangH,LeeC,DavinLB,LewisNG.Mol.Bio.Syst.,2014,10(11):2838-2849
46LiB,BhandariDR,JanfeltC,RomppA,SpenglerB.PlantJ.,2014,80(1):161-171
47KusariS,SezginS,NigutovaK,CellarovaE,SpitellerM.Anal.Bioanal.Chem.,2015,407(16):4779-4791
48BaiHR,WangSJ,LiuJJ,GaoD,JiangYY,LiuHX,CaiZW.J.Chromatogr.B,2016,1026:263-271
49GemperlineE,KellerC,JayaramanD,MaedaJ,SussmanMR,AneJM,LiLJ.J.ProteomeRes.,2016,15(12):4403-4411
50BeckS,StengelJ.Phytochemistry,2016,130:201-206
51LiB,BhandariDR,RmppA,SpenglerB.Sci.Rep.,2016,6:36074
52YamamotoK,TakahashiK,MizunoH,AnegawaA,IshizakiK,FukakiH,OhnishiM,YamazakiM,MasujimaT,MimuraT.Proc.Natl.Acad.Sci.USA,2016,113(14):3891-3896
53LangeBM,FischedickJT,LangeMT,SrividyaN,SamecD,PoirierBC.PlantPhysiol.,2017,173(1):456-469
54HeskesAM,SundramTCM,BoughtonBA,JensenNB,HansenNL,CrocollC,CozziF,RasmussenS,HambergerB.PlantJ.,2018,93(5):943-958
55LiB,GeJY,GaoW,YangH,LiP,SweedlerJV.PlantCellEnviron.,2018,41(11):2693-2703
56LIUXiao-Ning,PEIXing-Li,GONGCan,XUXu.ChineseJ.Anal.Chem.,2018,46(12):1923-1930
刘晓宁,裴兴丽,龚灿,许旭.分析化学,2018,46(12):1923-1930
57WangSJ,BaiHR,CaiZW,GaoD,JiangYY,LiuJJ,LiuHX.Electrophoresis,2016,37(13):1956-1966
58YangSH,LiuHH,HuangX,ZhanLP,LuoPQ,XueJJ,ChenR,NieZX.Int.J.MassSpectrom.,2018,434:93-99

