水凝胶纳米纤维复合基底捕获循环肿瘤细胞的研究
王志利 丁丕 高田 陈昌冲 曹翼 孙娜 裴仁军

摘要:循环肿瘤细胞(CTCs)检测被认为是一种极具发展前景的癌症液体活检技术。血液中CTCs数量非常稀少,因此,从血液中高效捕获高纯度、高活性的CTCs极具挑战。为提高CTCs捕获纯度,本研究通过自由基聚合反应在玻璃片表面修饰厚度约2.3μm的聚羧酸甜菜碱甲基丙烯酸甲酯(PCBMA)水凝胶,具有抗粘附作用,并提供一种类似细胞外基质的柔软界面。在水凝胶表面修饰抗上皮粘附分子(EpCAM)抗体后,对靶细胞的捕获效率仅约20%。为提高捕获效率,通过静电纺丝技术在水凝胶表面覆盖一层直径约200nm的壳聚糖纳米纤维,使捕获基底具有纳米结构,最后引入EpCAM抗体作为亲和捕获分子用于特异性捕获EpCAM高表达的CTCs。实验结果表明,此水凝胶纳米纤维复合基底对靶细胞捕获效率可达85%,比平面水凝胶基底的捕获效率提高了4倍多;对阴性细胞的粘附率仅0.5%,并且97%的捕获细胞保持活性。对模拟病人样本中少量靶细胞的捕获效率可达79.9%。本研究所发展的捕获基底通过亲和捕获分子、抗粘附水凝胶和纳米纤维结构的协同作用实现了对CTCs的高效率捕获。
关键词:循环肿瘤细胞;高效捕获;纳米结构;水凝胶抗粘附界面
1引言
循环肿瘤细胞(CTCs)是一些携带原始肿瘤信息并从肿瘤部位脱落后,经过迁移、转化等过程,最终进入血液循环系统的肿瘤细胞[1~3]。CTCs检测为肿瘤的研究提供了一种非侵入性方式,因此被认为是最具发展前景的液体活检技术,对肿瘤的早期诊断、预后监控、药物评估以及个体化治疗具有指导意义[4,5]。然而,CTCs在血液中非常稀少,且存在异质性,因此,从血液中高效、高纯度捕获CTCs仍然面临严峻的挑战[6]。目前,已经发展了多种分离技术用于CTCs捕获,如密度梯度离心法[7]、滤膜过滤方法[8]、水动力分离法[9]、介电泳(DEP)细胞分离法[10]、纳米基底亲和捕获方法[11]、磁珠亲和捕获分离技术[12]和微流控技术[13]等。研究发现,细胞表面存在的微纳米结构可与纳米结构基底形成较强的局部作用,同时,纳米结构基底为亲和捕获分子的修饰提供更多的靶点,有望大幅度提高捕获效率[14]。纳米结构基底(如纳米柱、纳米线、纳米纤维等)已经应用于CTCs捕获[15,16]。Liu等[17]制备了基于金属有机骨架(MOF)结构的纳米基底,引入抗体作为亲和捕获分子,用于细胞的识别和捕获以及作为药物的响应性释放载体。Wang等[18]通过在磨砂片表面原位生长硅纳米线并修饰EpCAM抗体用于靶细胞PC-3的捕获,捕获效率达85%,随着硅纳米线长度增加,捕获效率可进一步提高。但是,纳米结构的引入增加了基底对血细胞或其它干扰细胞的非特异粘附,在一定程度上降低了对靶細胞的捕获效率和纯度,尤其是对CTCs的鉴定和分析存在严重干扰的白细胞也会被部分捕获,因此,对于CTCs的研究首先需要发展能够高效高纯度捕获CTCs的平台。
目前,为降低基底对非特异性细胞的粘附作用,主要在纳米结构表面修饰抗粘附分子如牛血清白蛋白(BSA)、聚乙二醇(PEG)等[19,20]。Sun等[19]将BSA蛋白通过化学交联的方式引入到二氧化钛纳米棒表面,达到较好的抗粘附效果。研究发现,两性离子聚合物的亲水性是PEG分子的7~8倍,并具有良好的抗粘附性能[21]。其中,CBMA聚合物在抗蛋白、细菌和细胞吸附等方面具有优异的性能,将CBMA接枝到金表面,该表面在较广pH和离子强度范围内均具有优异的抗蛋白吸附能力[22]。而且CBMA化合物具有双键和羧基官能团,为其广泛使用提供了基础。本研究引入CBMA来解决靶细胞捕获过程中的非特异性吸附问题,以期提高靶细胞的捕获纯度。同时,相比无机纳米材料制备的“硬”界面,细胞更偏向于“软”的捕获界面,为了对捕获的CTCs进行后续研究,需要基底界面具有更好的细胞相容性以保持细胞的活性[23]。水凝胶的结构与活体组织细胞外基质(ECMs)相似,具有良好的亲水性和抗粘附性能,因此被广泛应用于人工ECMs合成的基础成分和CTCs分离基底[24,25]。
本研究构建了一层水凝胶作为捕获界面基层,此基层由两性离子化合物CBMA形成,具有良好的抗粘附性能和类似于细胞外基质的结构。为提高水凝胶基层对CTCs的捕获效率,在此基层上覆盖一层壳聚糖纳米纤维,通过化学交联在纤维表层修饰PEG分子,最终将抗体修饰到其表面。利用水凝胶基层、壳聚糖纤维的纳米结构以及抗体的特异性提高CTCs的捕获效率和纯度,对靶细胞捕获效率可达85%,对阴性细胞的粘附率仅0.5%,对模拟血液样本中少量靶细胞的捕获效率达到79.9%。此基底为CTCs的高效、高纯度捕获提供了新的平台。
2实验部分
2.1仪器与试剂
DW-N303-1ACD8高压直流电源发生器(天津东文高压电源股份有限公司);W0109-1B微量进样器(保定兰格恒流泵有限公司);FEIQuanta400F环境扫描电子显微镜(美国FEI公司);Hitachi*CT6E日立台式离心机(高壹工机商业(上海)有限公司);SW-CJ-1FD超净工作台(苏州安泰空气技术有限公司);FormaSeriesⅡ细胞恒温培养箱(赛默飞世尔科技(中国)有限公司);NikonECLIPSETi荧光倒置显微镜(日本NIKON公司);Varian核磁共振波谱仪(美国瓦里安有限公司)。
壳聚糖(CS,MW=190-310kDa,脱乙酰度为85%)、聚(环氧乙烯)(PEO,MW=1000kDa)、N-羟基丁二酰亚胺(NHS)、1-(3-二甲氨基丙基)-3-乙基碳二亚胺(EDC)、过硫酸铵(APS)、N,N-二甲氨基甲基丙烯酸乙酯(DMAEM,98%)、β-丙内酯(98%)、甲基丙烯酸-3-(三甲氧基甲硅烷基)丙酯(MPS)、N,N-亚甲基双丙烯酰胺(MBA)、25%戊二醛(GA)、人白细胞分离液(Ficoll-Paque)、碘化丙啶(PI)、钙黄绿素(AM)、细胞膜绿色荧光探针(DiO)、细胞膜红色荧光探针(DiI)(试剂级,美国Sigma-Aldrich公司);达尔伯克改良伊格尔培养基(DMEM)、悬浮细胞1640培养基(RPMI1640)、最低必需培养基(MEM)、0.25%(w/V))胰蛋白酶(Trypsin-EDTA)、胎牛血清(FBS)(试剂级,GibcoBRL,赛默飞世尔科技(中国)有限公司);N,N,N',N'-四甲基乙二胺(TEMED)、乙酸、丙酮、无水乙醚(分析纯,上海国药集团化学试剂有限公司);氨基-聚乙二醇-羧基(NH2-PEG2000-COOH,试剂级,北京键凯科技有限公司);链霉亲和素(SA,试剂级,北京索莱宝科技有限公司);生物素修饰的抗EpCAM抗体(anti-EpCAM,试剂级,上海优宁维生物科技股份有限公司)。
2.2细胞培养
人乳腺癌细胞系(MCF-7)、人前列腺癌细胞系(PC-3)、人胚胎肾细胞系(293T)、人慢性骨髓性白血病细胞系(K562)和人宫颈癌细胞系(HeLa)分别使用添加体积比为10%FBS的DMEM、RPMI1640和MEM的培养基培养。细胞系均来源于中国科学院上海细胞库。
2.3实验方法
2.3.1水凝胶纳米纤维复合基底的构建(1)CBMA制备根据实验室已有技术合成[23]。在氮气保护下,将11.89gDMAEM溶解于80mL无水丙酮,冰浴下搅拌,逐滴加入5.73gβ-丙内酯,15℃反应5h。离心,用无水丙酮和无水乙醚洗涤,真空抽干,4℃保存。(2)双键官能团修饰将1cm×1cm玻片,置于含0.5mLMPS的50mL乙醇溶液中,清洗,干燥。(3)水凝胶基层合成根据文献[26]方法合成水凝胶层。用2.5μL40%(w/V)CBMA溶液、2.5μL1%(w/V)MBA溶液、0.15μLAPS(10%(w/V))和TEMED(5%(w/V))配制水凝胶溶液。立即转移至干净大玻片上,然后将步骤(2)修饰后的玻片倒扣在水凝胶溶液上,20min后可观察到水凝胶成型。将水凝胶修饰的玻片从大玻片上取下,保存于干燥器中待用。(4)水凝胶纤维复合基底的构筑壳聚糖纳米纤维根据本研究组前期建立的方法制备[22]。将壳聚糖与PEO按照质量比9∶1溶解于90%(V/V)乙酸-水,制成3%(w/w)的溶液,室温搅拌8h。将电纺溶液转移至5mL注射器中,采用5#针头,针头与铝箔间距为10cm,电压18kV,在水凝胶层表面电纺,4%氨水处理,清洗,过夜干燥。样品命名为CS@Hydrogel。(5)纤维表面修饰PEG将CS@Hydrogel玻片与2.5%戊二醛反应2h,清洗后与1mg/mLNH2-PEG2000-COOH溶液过夜孵育,PBS清洗。样品命名为PEG-CS@Hydrogel。(6)anti-EpCAM-CS@Hydrogel基底的构筑将PEG-CS@Hydrogel玻片用0.1mol/LEDC和0.025mol/LNHS活化,与10μg/mLSA溶液反应,PBS清洗,氮气吹干,滴加2μmol/Lanti-EpCAM抗体溶液,4℃反应过夜,FBS封闭10min。样品命名为anti-EpCAM-CS@Hydrogel。
2.3.2anti-EpCAM-CS@Hydrogel基底最佳捕获时间的考察分别使用浓度为10μg/mL的DiO和DiI对K562和MCF-7染色20min,PBS清洗,计数,分别将0.25×105MCF-7和1×105K562細胞与anti-EpCAM-CS@Hydrogel玻片孵育不同时间,PBS清洗,荧光显微镜记录细胞的捕获情况,计算捕获效率,选择最佳孵育时间用于后续细胞捕获实验。捕获效率定义为捕获的细胞与最初加入细胞的百分比。
2.3.3anti-EpCAM-CS@Hydrogel基底捕获效率的考察将MCF-7细胞染色,清洗,计数,将0.25×105MCF-7细胞与不同修饰界面的基底孵育40min,清洗,用倒置荧光显微镜记录捕获的细胞数,计算捕获效率。
2.3.4anti-EpCAM-CS@Hydrogel基底特异性的考察分别对HeLa、K562、293T、MCF-7和PC-3这5种细胞进行染色,清洗,计数,配制成固定浓度的细胞溶液,分别与anti-EpCAM-CS@Hydrogel基底孵育40min,清洗,荧光显微镜记录结果,统计捕获效率。
2.3.5anti-EpCAM-CS@Hydrogel基底捕获细胞活性的考察将MCF-7与anti-EpCAM-CS@Hydrogel基底孵育40min,清洗,然后与AM和PI的混合溶液孵育20min,清洗。同时将捕获前的MCF-7进行AM和PI的双染色处理,作为对照。其中AM标记活细胞,PI标记死细胞。用荧光显微镜观察细胞的状态,统计细胞的存活率。细胞存活率定义为活细胞数量与总细胞数量的百分比。
2.3.6anti-EpCAM-CS@Hydrogel基底灵敏度的考察将不同个数(10、20、50、100和200)DiI预染的MCF-7分别分散到1mL处理过的健康志愿者新鲜的抗凝血中,模拟病人血液样本。同时用PBS溶液替代血液作对照组。分别与Lab-TekTM4孔腔室内的anti-EpCAM-CS@Hydrogel基底孵育,清洗,用荧光显微镜记录捕获的细胞数。
血液的处理方法:SepMateTM-15离心管中加入5mLFicoll-Paque,然后将PBS稀释1倍的抗凝全血加入离心管中,2000r/min离心20min,提取白细胞(WBCs),PBS清洗,最后根据最初的血液体积加入等量的PBS分散,备用。
3结果与讨论
3.1基底的制备和表征
合成的CBMA用1HNMR(400MHz)表征,结果如下:δ6.01(s,1H,dCH),5.63(s,1H,dCH),4.51(t,2H,OCH2),3.65(t,2H,CH2N),3.54(t,2H,NCH2),3.05(s,6H,NCH3),2.59(t,2H,CH2COO),1.80(s,3H,dCCH3)。
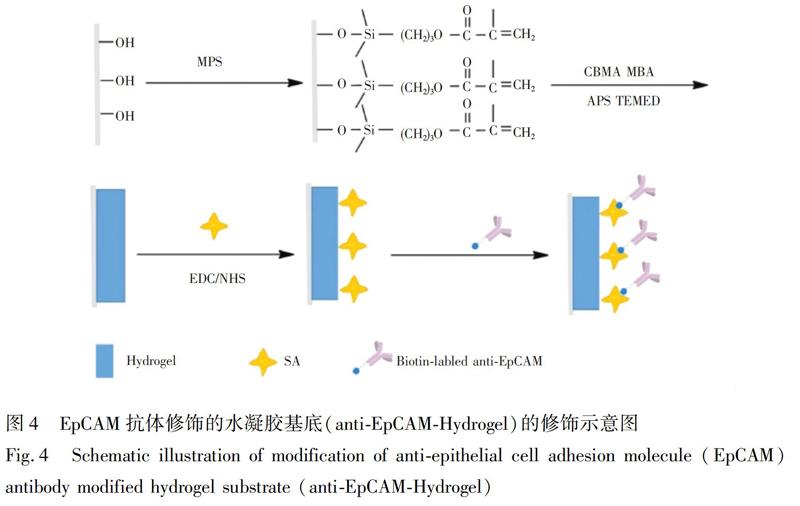
anti-EpCAM-CS@Hydrogel基底的构建和修饰见图1。首先通过自由基聚合反应在玻片表面合成PCBMA抗粘附水凝胶基层。该水凝胶层作为捕获基底需有一定的硬度和交联密度,同时又能保留良好的吸水能力,通过实验,最终确定20%(w/V)CBMA和0.5%(w/V)MBA满足要求。如图2A和2B所示,此水凝胶层表面平整,厚度约2.3μm,完全覆盖玻片。在水凝胶形成过程时,玻片表面修饰的双键参与反应,使水凝胶通过化学方式结合在玻片表面,保证了水凝胶层在后续的实验过程中不会脱落。对水凝胶层进行水接触角测试(图2C和2D),落在水凝胶表面的测试液滴立刻被吸收,说明水凝胶层具有良好的吸水能力。利用静电纺丝技术在水凝胶表面覆盖一层壳聚糖纳米纤维(图2E和2F),纤维直径约200nm,且稀疏地分布在水凝胶层上,通过SEM观察到水凝胶层依然裸露在外,并未被纤维层掩蔽,使其依然能够发挥抗粘附作用。此外,水凝胶基层吸水膨胀变柔软时,纤维的一部分会嵌入到水凝胶中,起到了防止纤维层脱落的作用。然后用戊二醛将PEG分子的氨基端修饰到壳聚糖纤维表面,另
一端的羧基通过EDC/NHS活化后与SA上的氨基反应,最后通过亲和素与生物素的特异相互作用将生物素化的抗体修饰在CS@Hydrogel基底上。此水凝胶纳米纤维复合基底主要是利用水凝胶的抗粘附、纤维的纳米结构及抗体特异识别的协同作用实现CTCs的高效高纯度的捕获。

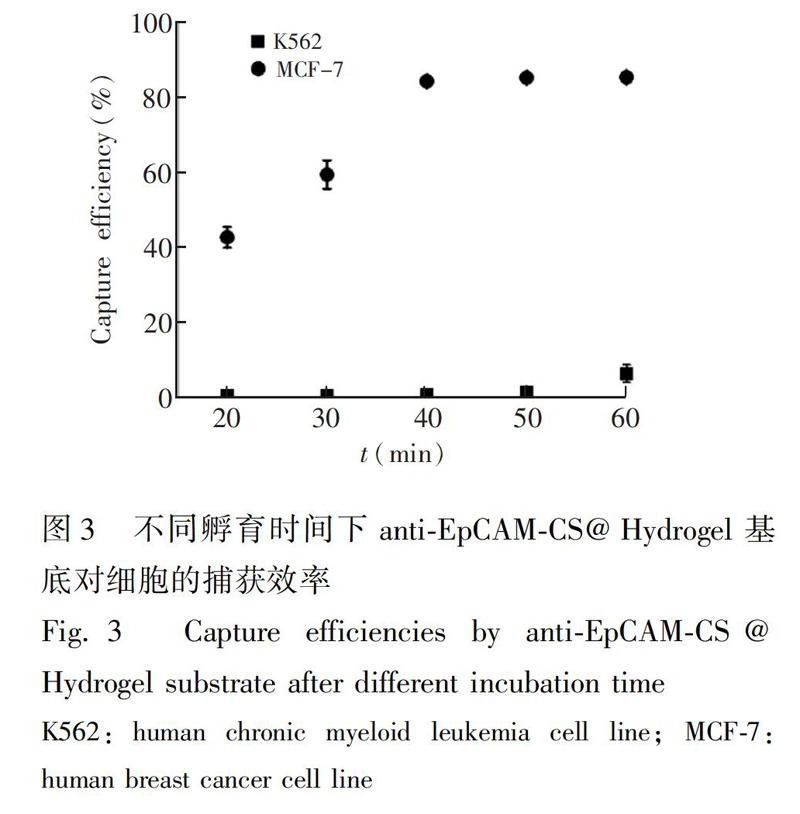
3.2不同孵育时间下的捕获效率
基底与细胞的孵育时间会影响基底对靶细胞的捕获效率,同时也会影响对非特异性细胞的粘附,因此在实验中利用阴性模型细胞K562和阳性模型细胞MCF-7,考察不同孵育时间下,anti-EpCAM-CS@Hydrogel基底对K562和MCF-7细胞的捕获效率以确定最佳孵育时间。不同孵育时间下两种细胞的捕获效率如图3所示。随着孵育时间延长,40min后,对MCF-7的捕获效率达到一个稳定水平,而对K562细胞的非特异性粘附依然在增加,这可能是由于时间的延长增加了非特异细胞与基底的作用,导致其在清洗时不能被清除,在60min时达到了6%。为了确保靶细胞的纯度,减弱非特异性细胞的粘附作用,后续的捕获实验采用40min的孵育时间。

3.3不同修饰基底的细胞捕获效率
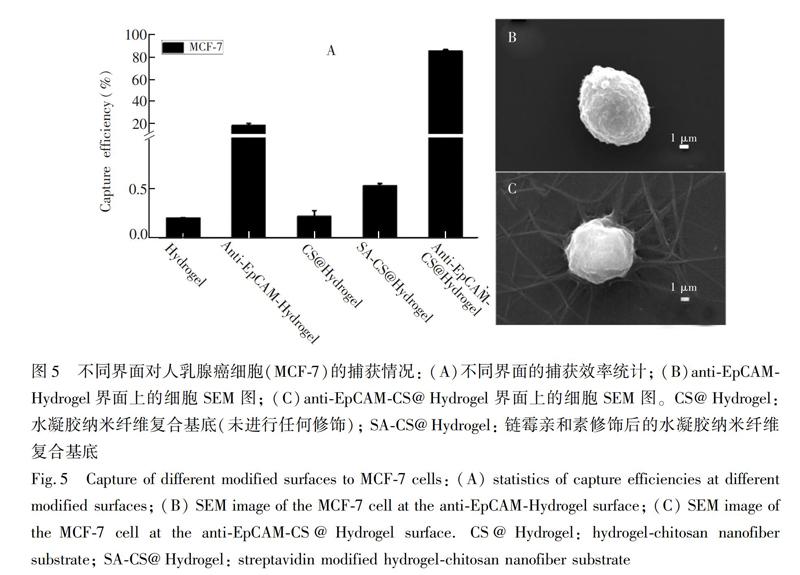
使用MCF-7作为模型细胞,不同修饰的界面互相作为对照,考察基底的抗粘附性能和捕获效率。主要选取了5种界面:(1)Hydrogel:玻片上修饰CBMA水凝胶层,无任何修饰;(2)anti-EpCAM-Hydrogel:通过EDC/NHS活化Hydrogel界面,修饰SA,最后将生物素化的EpCAM抗体修饰在水凝胶表面,修饰过程见图4;(3)CS@Hydrogel:Hydrogel表面覆盖纤维后无任何处理;
(4)SA-CS@Hydrogel:CS@Hydrogel表面修饰PEG后,通过EDC/NHS活化PEG的羧基端,连接SA;(5)anti-EpCAM-CS@Hydrogel:在SA-CS@Hydrogel表面連接生物素化的EpCAM抗体。这5种界面的捕获效率如图5A所示,Hydrogel界面的细胞粘附率为0.20%,说明PCBMA水凝胶基层具有很好的抗粘附作用。
anti-EpCAM-Hydrogel界面的捕获效率仅约为18%,这可能是由于水凝胶的抗粘附性阻碍了细胞与基底抗体的作用,从而导致细胞的捕获效率低。为提高捕获效率,在水凝胶基层表面覆盖一层分布均匀的薄纳米纤维,构成了水凝胶纳米纤维复合基底(CS@Hydrogel),该基底对细胞的粘附率也仅为0.22%,说明水凝胶基层依然能够起到抗粘附作用。纤维层的厚度和密度会影响水凝胶基层的抗粘附作用,因此需严格控制电纺条件。在同样的捕获条件下,anti-EpCAM-CS@Hydrogel界面对细胞的捕获效率可达85%,相比于平面水凝胶anti-EpCAM-Hydrogel界面,水凝胶纳米纤维复合基底的捕获效率提高了4倍多,其中纳米结构起到了关键作用。同时,对孵育时间40min时,anti-EpCAM-Hydrogel和anti-EpCAM-CS@Hydrogel界面捕获的细胞进行了SEM观察(图5B和5C),anti-EpCAM-Hydrogel界面上的细胞依然处于收缩状态,而anti-EpCAM-CS@Hydrogel界面上的细胞已经铺展并有伪足产生,进一步说明纳米纤维结构有效促进了基底对靶细胞的捕获。

3.4基底的特异性和捕获细胞的活性
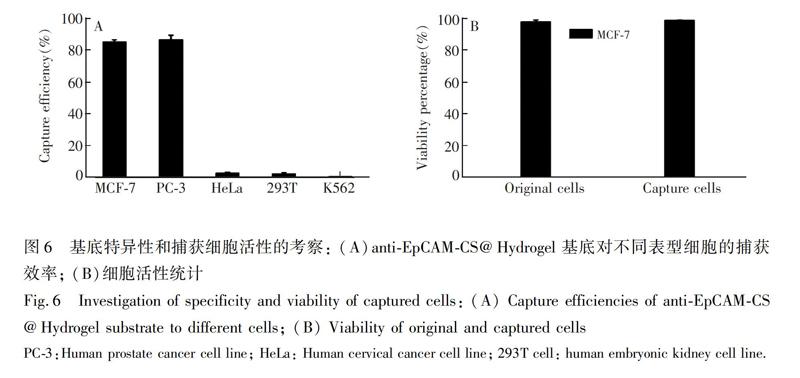
为了证实anti-EpCAM-CS@Hydrogel基底对细胞的捕获具有特异性,选择了5种细胞进行细胞实验,分别是作为阴性模型细胞(EpCAM低表达)的HeLa、K562及293T,阳性模型细胞(EpCAM高表达)的MCF-7和PC-3[27,28]。这5种细胞主要是根据文献报道的细胞表面EpCAM蛋白的表达情况确定其作为阳性模型细胞还是阴性模型细胞,并用于相应细胞捕获实验。在孵育40min后,此基底对MCF-7和PC-3细胞的捕获效率超过85%,而对EpCAM低表达的HeLa、293T、K562的捕获效率分别为2.6%、2.2%和0.5%(图6A),表明此基底对不同类型细胞的捕获具有良的选择性。
通过死/活双荧光染色对anti-EpCAM-CS@Hydrogel基底所捕获细胞的活性进行评估。作为对照,对相同数量的未与基底进行孵育的细胞也进行双染色处理。如图6B所示,捕获前的细胞和捕获后的细胞存活率分别为98.4%和97.5%,两者之间的差异很小,说明此基底具有良好的生物相容性,对细胞后续的研究以及培养有重要意义。
3.5基底的灵敏性
为了验证anti-EpCAM-CS@Hydrogel能否用于临床血液中少量CTCs的捕获,进行了模拟样本实验。将DiI预染色的10、20、50、100和200个MCF-7细胞分散到1mL处理过的血液中,制成临床病人模拟样本,与anti-EpCAM-CS@Hydrogel基底孵育,清洗,固定,用荧光显微镜计数。另外,用PBS溶液代替处理后的血液作为对照组,结果见图7。
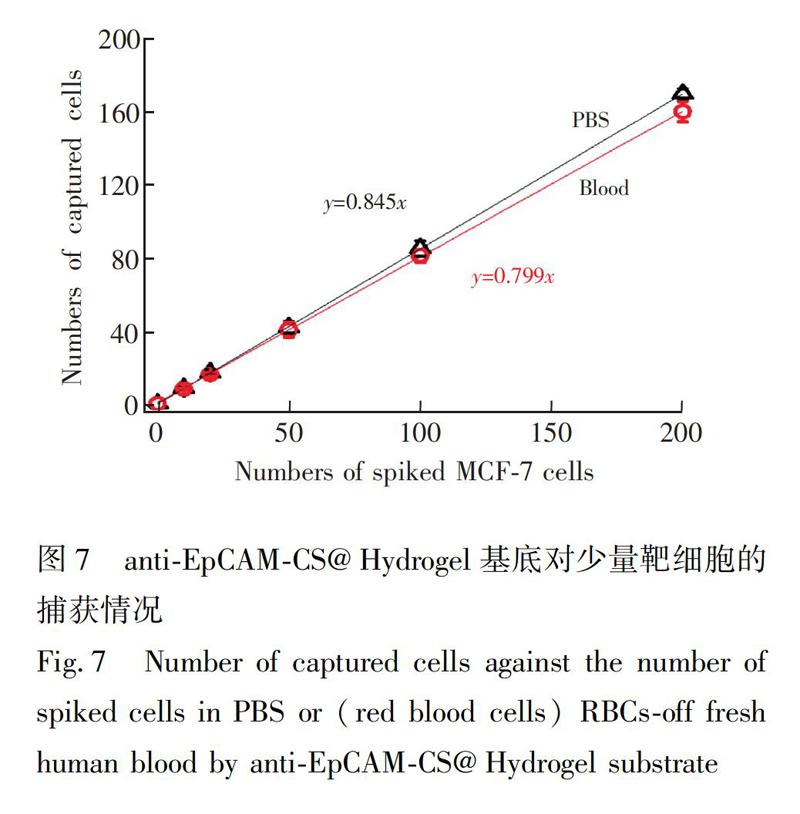
血液中的白細胞对CTCs后续鉴定及分析应用的干扰最大,因此本研究主要考虑白细胞的影响。对PBS和白细胞中少量MCF-7细胞的捕获效率分别为84.5%和79.9%。即当1mL血液中有10个CTCs时,基底约可捕获到8个,且在两种介质中的捕获效率并无显著差异,说明此基底具有较好的灵敏度,表明anti-EpCAM-CS@Hydrogel基底可用于临床血液样本的检测。
4结论
通过水凝胶抗粘附性、纤维的纳米结构和亲和捕获分子抗体的协同作用实现了对CTCs的高效高纯度捕获。此水凝胶纳米纤维复合基底可进一步用于检测临床癌症患者血液样本,探索其实际应用潜能。此基底具有良好的生物相容性,也可进一步研究捕获细胞的原位培养和增殖。
References
1CabelL,ProudhonC,GortaisH,LoiratD,CoussyF,PiergaJY,BidardFC.Int.J.Clin.Oncol.,2017,22(3):421-430
2PramaniKA,JonesS,GaoY,SweetC,VangaraA,BegumS,RayPC.Adv.Drug.Deliv.Rev.,2018,125:21-35
3DONGJian-Wei,XIALing,LIGong-Ke.ChineseJ.Anal.Chem.,2018,46(12):1851-1862
董建伟,夏凌,李攻科.分析化学,2018,46(12):1851-1862
4AzevedoR,SoaresJ,PeixotoA,CottonS,LimaL,SantosLL,FerreiraJA.Urol.Oncol.,2018,36(5):221-236
5HongS,WangAZ.Adv.Drug.Deliv.Rev.,2018,125:1-2
6HongB,ZuY.Theranostics,2013,3(6):377-394
7HuangQ,WangFB,YuanCH,HeZ,RaoL,CaiB,ChenB,JiangS,LiZ,ChenJ,LiuW,GuoF,AoZ,ChenS,ZhaoXZ.Theranostics,2018,8(6):1624-1635
8ChenFF,WangSY,FangY,ZhengL,ZhiX,ChengBR,ChenYY,ZhangCX,ShiDD,SongHB,CaiCL,ZhouPF,XiongB.Oncotarget,2017,8(2):3029-3041
9ZhaoW,ChengR,JenkinsBD,ZhuT,OkonkwoNE,JonesCE,DavisMB,KavuriSK,HaoZ,SchroederC,MaoL.Labchip,2017,17(18):3097-3111
10ChouWP,WangHM,ChangJH,ChiuTK,HsiehCH,LiaoCJ,WuMH.Sens.ActuatorsB,2017,241:245-254
11PanchapakesanB,CapraraR,VelascoV,LoomisJ,KingB,XuP,BurkheadT,SethuP,StallonsLJ,McgregorWG,RaiSN,KloeckerG,WickstromE.CancerNanotechnol.,2010,1(1-6):3-11
12MaXY,WuLL,ChenL,QinYH,HuJ,TangM,XuCM,QiCB,ZhangZL,PangDW.ACSAppl.NanoMater.,2018,1(8):4019-4027
13ParkMH,ReateguiE,LiW,TessierSN,WongKH,JensenAE,ThaparV,TingD,TonerM,StottSL,HammondPT.J.Am.Chem.Soc.,2017,139(7):2741-2749
14ZhangF,JiangY,LiuX,MengJ,ZhangP,LiuH,YangG,LiG,JiangL,WanLJ,HuJS,WangS.NanoLett.,2016,16(1):766-772
15LiM,AnandRK.J.Am.Chem.Soc.,2017,139(26):8950-8959
16LiR,ChenFF,LiuHQ,WangZX,ZhangZT,WangY,CuiH,LiuW,ZhaoXZ,SunZJ,GuoSS.ACSAppl.Mater.Interfaces,2018,10(19):16327-16334
17QiX,ChangZ,ZhangD,BinderKJ,ShenS,HuangYYS,BaiY,WheatleyAEH,LiuH.Chem.Mater.,2017,29(19):8052-8056
18CuiH,WangB,WangW,HaoY,LiuC,SongK,ZhangS,WangS.ACSAppl.Mater.Interfaces,2018,10(23):19545-19553
19SunN,LiX,WangZ,ZhangR,WangJ,WangK,PeiR.ACSAppl.Mater.Interfaces,2016,8(20):12638-12643
20XiaoY,WangM,LinL,DuL,ShenM,ShiX.Mater.Chem.Fron.,2018,2(5):891-900
21MiL,JiangS.Angew.Chem.Int.Edit.,2014,53(7):1746-1754
22ZhangZ,VaisocherovaH,ChengG,YangW,XueH,JiangSY.Biomacromolecules,2008,9(10):2686-2692
23SunN,LiuM,WangJ,WangZ,LiX,JiangB,PeiR.Small,2016,12(36):5090-5097
24ChienHW,TsaiWB,JiangS.Biomaterials,2012,33(23):5706-5712
25LiuL,YangK,GaoH,LiX,ChenY,ZhangL,PengX,ZhangY.Anal.Chem.,2019,91(4):2591-2594
26ZhangZ,ChenN,LiS,BattigM,WangY.J.Am.Chem.Soc.,2012,134(38):15716-15719
27SunN,WangJ,JiL,HongS,DongJ,GuoY,ZhangK,PeiR.Small,2015,11(40):5444-5451
28WangS,WangH,JiaoJ,ChenK,OwensG,KameiK,SunJ,ShermanD,BehrenbruchC,WuH,TsengH.Angew.Chem.Int.Edit.,2009,121(47):9132-9135

