未成熟大鼠睾丸组织玻璃化冻存效果的比较性研究
童越,傅龙龙,安琪,贾艳飞,张开舒,赵海豹,周芳,郭颖,卢文红,梁小薇,唐文豪,谷翊群*
(1. 国家卫生健康委科学技术研究所男性临床研究室/国家卫生健康委男性生殖健康重点实验室/北京人类精子库,北京 100081;2. 北京协和医学院研究生院,北京 100730;3. 兰州大学第二临床医学院神经外科,兰州 730000;4. 青岛大学附属医院生殖中心,青岛 266000;5. 北京大学第三医院泌尿外科,北京 100191)
在生殖医学临床实践中,添加甘油-卵黄-柠檬酸盐冷冻保护剂、采用程控或手工慢速冷冻的精子冻存技术是男性生育力保存的首选方法[1]。对于需要接受生殖腺毒性治疗的青春期前男性患者,由于睾丸内尚无成熟精子,冻存睾丸组织或生精干细胞成为他们保留生育机会的唯一选择[2]。国外已有多家医疗机构为青春期前的男性患者冻存了睾丸组织,以备未来利用辅助生殖技术(ART)帮助患者生育自己的遗传学后代[3-4]。
睾丸组织冷冻技术主要有慢速冷冻和玻璃化冷冻两大类。目前临床上在卵母细胞冻存实践中,玻璃化技术已经逐步取代慢速冷冻技术[5]。对于睾丸组织冻存,玻璃化和慢速冷冻两种方法何者效果更好还存在争议[6-8],但由于玻璃化技术使用便利、成本低,因此更利于临床推广。二甲基亚砜(DMSO)和乙二醇(EG)是睾丸组织玻璃化冻存最常使用的冷冻保护剂成分,然而不同浓度的DMSO和EG对玻璃化冻存的大鼠睾丸组织的结构和细胞功能有何影响还不完全清楚。
本研究选择两周龄大鼠来模拟人在青春期前无精子产生的未成熟发育状态,使用不同浓度的冻存液对大鼠睾丸组织进行玻璃化冷冻,以探讨未成熟大鼠睾丸组织玻璃化冻存的适宜浓度方案。
材料与方法
一、实验材料
1.实验动物:两周龄的SD雄性大鼠购自北京华阜康实验动物中心[证号:SCXK(京)2014-0004],体重为(43.0±5.6)g。饲养温度为(22±2)℃,相对湿度(55±5)%,光照黑暗时间比为14 h/10 h。本研究经国家卫生健康委科学技术研究所伦理委员会审核通过。
2.主要实验仪器:激光共聚焦显微镜(Zeiss,美国)、生物组织包埋机(Leica,德国)、轮转式切片机(Leica,德国)、电热恒温水浴箱(上海智诚)。
3.主要实验试剂:DMSO、EG、蔗糖等购自美国Sigma公司;胎牛血清购自杭州四季青生物公司;TUNEL荧光试剂盒购自瑞士Roche公司;1 μl塑料细菌接种环购自美国Biologix公司;兔抗大鼠SOX9单克隆抗体、兔抗大鼠StAR多克隆抗体、小鼠抗大鼠UCHL1多克隆抗体均购自英国Abcam公司,兔抗大鼠PCNA单克隆抗体购自美国CST公司。
二、实验方法
1.睾丸组织取材:大鼠麻醉后脱颈处死,下腹部切口取出两侧睾丸,于PBS缓冲液漂洗2次,去除白膜后移入含10%FBS的DMEM/F12培养基中,4℃静置,待一次实验中所有睾丸取出后,将每个睾丸分割为大小约为8 mm3~9 mm3的组织块。分到对照组的组织块立即进行固定,冻存组进入冷冻流程。
2.玻璃化冷冻和复苏:参考Curaba等[9]的研究,设计3个不同浓度冷冻保护剂的玻璃化冻存组和1个对照组。对照组的睾丸组织不作冷冻处理,直接进行后续实验。3种不同浓度的玻璃化冻存液配方如下:玻璃化A组(A组)冻存液为含7.5%DMSO、7.5%EG、0.5 mol/L蔗糖和10%FBS的DMEM/F12培养基;玻璃化B组(B组)为含15%DMSO、15%EG、0.5 mol/L蔗糖和10%FBS的DMEM/F12培养基;玻璃化C组(C组)为含25%DMSO、25%EG、0.5 mol/L蔗糖和10%FBS的DMEM/F12培养基。各组平衡液的DMSO和EG浓度是对应冻存液浓度的50%,FBS体积分数不变,不添加蔗糖。各组冻存样本复苏时使用相同的复苏液。复苏液1(WS1):含1.0 mol/L蔗糖、10%FBS的PBS;复苏液2(WS2):含0.5 mol/L蔗糖、10%FBS的PBS;复苏液3(WS3):含0.25 mol/L蔗糖、10%FBS的PBS。将分割好的睾丸组织置于平衡液中4℃孵育20 min,然后转入冻存液(VS)中4℃孵育25 min。取出组织在纱布上稍拭干,稳妥放置在截好的1 μl接种环上,空气中停留5 s后直接浸入液氮中。在液氮液面下,用镊子将载有组织的小环夹入预冷的冻存管中,封口,移入液氮罐。样本在液氮中保存2周后进行复苏。
玻璃化样本的复苏采用快速复温方式:自液氮中取出冻存管,立即置于37℃水浴,快速夹出睾丸组织置于37℃的WS1中停留约1.5 min,使组织从小环上脱落至溶液中并充分浸润。接着将组织依次在37℃的WS2、WS3中各静置5 min,再用含10%FBS的PBS漂洗2次。
3.睾丸组织形态学观察:新鲜或冻融后的睾丸组织在Bouin’s液中固定24 h后,常规石蜡包埋切片,H&E染色后封片,镜下观察。一次实验中每组随机选取5块组织,每块组织分析3个切面,共进行3次独立重复实验。参考Milazzo等[10]研究中提供的半定量评分标准,从生精小管内细胞形态和生精上皮与基底膜完整性两方面对冻融后睾丸组织形态学改变进行评分,每个切面评分之和介于0~10分。
4.免疫荧光染色:选择相应抗体对组织石蜡切片中精原细胞标志物UCHL1、支持细胞标志物SOX9、睾丸间质Leydig细胞标志物StAR和细胞增殖核抗原PCNA进行免疫荧光染色。石蜡切片常规脱蜡水化,柠檬酸钠缓冲液(0.01 mol/L,pH=6.0)加热修复抗原。封闭、PBST清洗后,用稀释的上述蛋白一抗4℃孵育过夜。次日取出后清洗,CY3标记的荧光二抗室温下避光孵育1 h,DAPI复染细胞核。荧光显微镜下观察拍照。
每次实验中,各组对每个指标分析5张切片。对于UCHL1、SOX9和PCNA,每张切片在随机选取的5个视野中共计数25个生精小管横截面中阳性细胞总数,取平均值作为单位小管中阳性细胞数;对于StAR,每张切片随机选取5个视野,计数所有StAR阳性Leydig细胞簇(LC)的数目,除以视野中所有生精小管总数得到单位小管对应的Leydig细胞簇的数量。
5.原位细胞凋亡检测:用罗氏的TUNEL荧光显色试剂盒对睾丸组织中凋亡细胞进行检测。石蜡切片常规脱蜡水化,蛋白酶K处理15 min,清洗后加50 μl的TUNEL反应工作液,避光37℃孵育1 h,清洗,DAPI复染,水性封片剂封片。荧光显微镜下观察,计数TUNEL反应阳性的细胞。每张切片随机选择5个视野(×200),共计数500个细胞,凋亡指数(AI)=凋亡细胞数/500×100%。每组分析5张切片,共进行3次独立重复实验。
三、统计学分析

结 果
一、大鼠睾丸组织形态学结果
1. 各组睾丸组织的形态学特点:未冷冻的睾丸组织切片(对照组)可见生精小管排列紧密,管周间隙较小。小管内的精原细胞和支持细胞形态结构清晰可辨,排列整齐。睾丸间质中可见成簇分布的完整Leydig细胞群,小淋巴管和小血管结构完整(图1)。
玻璃化冻融后的睾丸组织与对照组相比,形态结构有不同程度的改变(图1)。A组冻融后的组织形态学改变最为明显:生精上皮由于收缩和基底膜明显分离,出现较大间隙。精原细胞和支持细胞形态尚可辨认,排列稍有紊乱,生精上皮的部分区域可见细胞脱落。睾丸间质改变相对较小,可见零散分布的Leydig细胞。B组的形态改变相对较小,生精上皮未从基底膜脱离。精原细胞和支持细胞排列整齐,较为紧密,细胞形态清晰可辨。生精小管管周没有出现胶原增厚和纤维化现象。小管之间的间隙较对照组稍增宽。C组睾丸组织的生精上皮轻度收缩,生精上皮与基底膜偶见分离。精原细胞和支持细胞的形态区分比较困难,细胞排列稍紊乱。部分小管的生精上皮出现空泡,可见生精细胞脱落以及核固缩等病理改变。睾丸间质中小淋巴管和血管结构大量消失,完整的Leydig细胞簇较少。
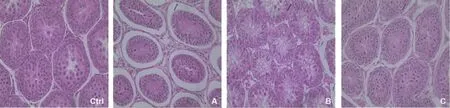
Ctrl:对照组;A:A组(7.5%DMSO+7.5%EG);B:B组(15%DMSO+15%EG);C:C组(25%DMSO+25%EG)图1 不同浓度冷冻保护剂玻璃化冻存睾丸组织的形态学比较(HE染色,×400)
2. 各组睾丸组织形态学改变的半定量评分比较:各组的半定量评分结果如图2所示,冻存组A、B、C评分均显著高于对照组(P<0.05)。三组间,B组形态改变的评分最低,A组评分显著高于B组和C组,差异均具有统计学意义(P<0.05)。
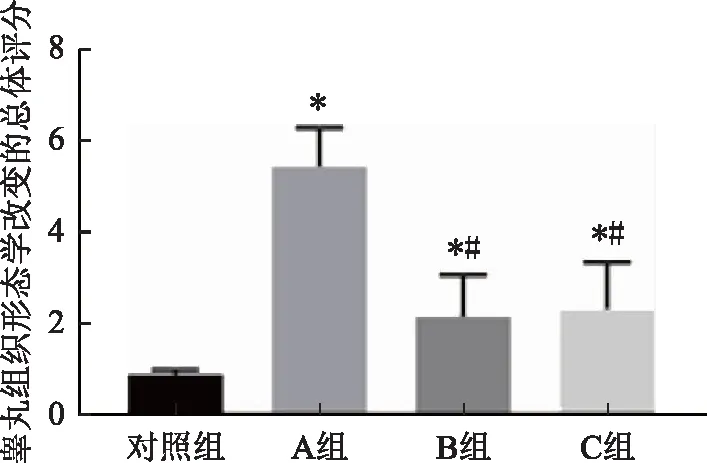
注:与对照组比较,*P<0.05;与A组比较,#P<0.05图2 各组睾丸组织形态学改变半定量评分结果比较
二、大鼠睾丸组织中细胞特异性标志物及细胞增殖标志物表达的结果
1. 精原细胞标志物UCHL1荧光信号分布及阳性细胞数比较:UCHL1荧光信号主要分布在生精上皮基底室靠近基膜的精原细胞核中(图3)。与未冷冻的对照组相比,玻璃化各组UCHL1阳性细胞数均有所下降,A、C组UCHL1阳性细胞数显著减少(P<0.05);冷冻组之间比较,B组的阳性细胞数最多,与C组比较差异具有统计学意义(P<0.05)(图7)。
2.支持细胞标志物SOX9荧光信号分布及阳性细胞数比较:SOX9主要分布在生精上皮中精原细胞之间或偏内侧,呈环形分布(图4)。与对照组相比,A、C组的SOX9阳性细胞数显著下降(P<0.05),而B组与对照组比较无显著性差异(P>0.05);冻存组之间比较,B组阳性细胞数较A、C组显著增多(P<0.05)(图7)。
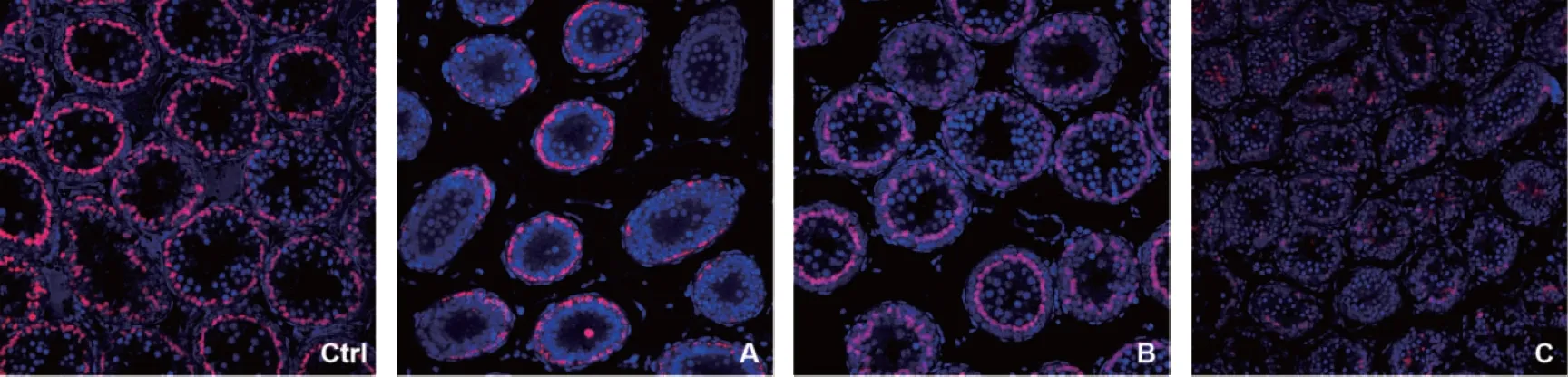
3. 睾丸间质细胞标志物StAR荧光信号分布及阳性细胞数比较:StAR阳性染色主要定位在睾丸间质中的Leydig细胞内(图5)。冻融后的睾丸间质中StAR表达减少,A、B、C组与对照组之间有显著性差异(P<0.05)(图7)。3个冻融组之间,B组荧光信号数量最多,而C组完整的LC簇数量最少(P<0.05)。
4.细胞增殖标志物PCNA荧光信号分布及阳性细胞数比较:PCNA主要分布在精原细胞等DNA复制较为活跃的细胞中,由于2周龄大鼠的睾丸发育尚未成熟,也有部分支持细胞处于有丝分裂阶段,因此也有PCNA表达(图6)。B组与对照组PCNA的表达量最为接近,二者之间无统计学差异(P>0.05);A组和C组的荧光信号较对照组下降显著(P<0.05),但A、C组之间差异不大(P>0.05)(图7)。
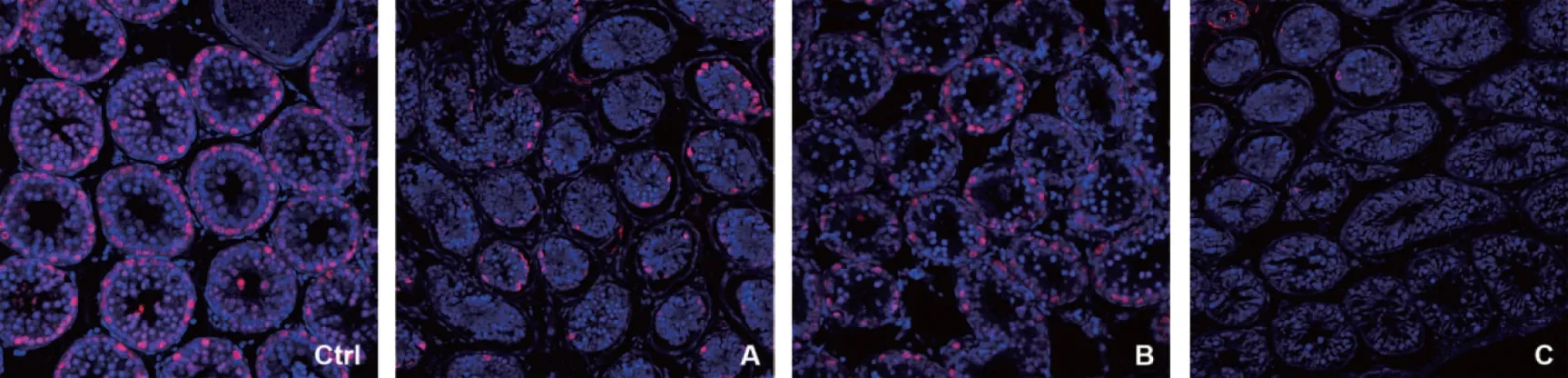
Ctrl:对照组;A:A组(7.5%DMSO+7.5%EG);B:B组(15%DMSO+15%EG);C:C组(25%DMSO+25%EG)图3 各组睾丸组织中UCHL1的表达(免疫荧光,×200)
Ctrl:对照组;A:A组(7.5%DMSO+7.5%EG);B:B组(15%DMSO+15%EG);C:C组(25%DMSO+25%EG)图4 各组睾丸组织中SOX9的表达(免疫荧光,×200)
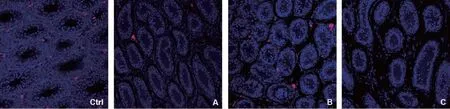
Ctrl:对照组;A:A组(7.5%DMSO+7.5%EG);B:B组(15%DMSO+15%EG);C:C组(25%DMSO+25%EG)图5 各组睾丸组织中StAR的表达(免疫荧光,×200)
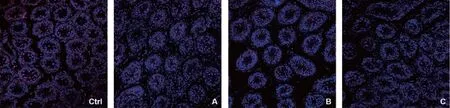
Ctrl:对照组;A:A组(7.5%DMSO+7.5%EG);B:B组(15%DMSO+15%EG);C:C组(25%DMSO+25%EG)图6 各组睾丸组织中PCNA的表达(免疫荧光×200)
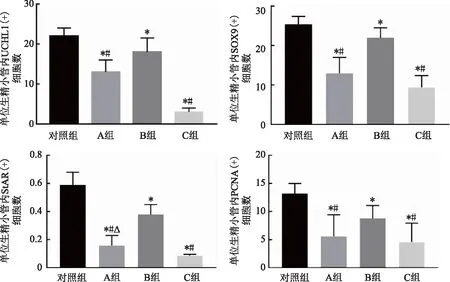
注:与对照组比较,*P<0.05;与B组比较,#P<0.05;与C组比较,△P<0.05图7 各组睾丸组织中细胞标志物免疫荧光显色统计结果
三、睾丸组织细胞凋亡检测结果
未冷冻对照组的凋亡指数为(0.35±0.1)%,冷冻后睾丸组织中凋亡细胞数量明显增加,A、B、C组的凋亡指数分别为(1.9±0.6)%、(1.2±0.2)%、(3.9±1.0)%,显著高于对照组(P<0.05);3个冷冻组之间,B组凋亡指数最低,显著低于A、C组(P<0.05)(图8)。
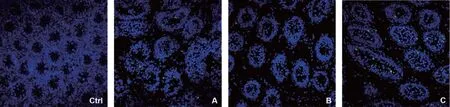
Ctrl:对照组;A:A组(7.5%DMSO+7.5%EG);B:B组(15%DMSO+15%EG);C:C组(25%DMSO+25%EG)图8 各组睾丸组织TUNEL检测结果
讨 论
目前,临床上对于包括睾丸组织冻存在内的新型生育力保存手段的需求越来越大[11]。对于罹患肿瘤、免疫性疾病等需要进行性腺毒性治疗的患者,通过睾丸组织冻存帮助患者保留生育机会对提高患者家庭生活质量具有重要意义。
尽管睾丸组织冻存的相关研究已有一定时间,但无论是实验室还是临床上都尚无公认的标准程序。未成熟大鼠睾丸组织的玻璃化冻存效果在不同的实验室有一定的差异。适宜浓度的冷冻保护剂是溶液玻璃化状态形成的关键因素之一[12],保护剂浓度过低无法提供足够的保护效果,在降温和升温过程中会由于冰晶形成、氧化应激等理化因素造成细胞损伤。而当保护剂浓度过高时,不仅会由于渗透损伤效应破坏细胞质膜和细胞器,其化学毒性作用还会破坏细胞核DNA完整性、干扰生物合成和代谢,导致细胞增殖能力下降甚至凋亡[13]。
为了保证冷冻效率的同时降低单一成分渗透性保护剂浓度过高引起的毒性反应,一般选择两种及以上保护剂成分混合使用。DMSO作为渗透性冷冻保护剂单独使用时,比EG、异丙醇、甘油等其他保护剂在冷冻过程中更能有效地保护组织结构和细胞活力[10],但同时,过高浓度的DMSO会造成细胞内蛋白变性并诱导细胞凋亡[14]。EG分子量小,容易穿透细胞膜。由于其毒性较低,即使在浓度较高时细胞仍然可以耐受,因而在玻璃化冷冻中被广泛应用[15]。已有较多证据支持采用DMSO和EG的组合对睾丸组织进行冷冻可以获得较为满意的冻存效果[16],但该组合在玻璃化冻存中的适宜浓度还缺乏详细的论证。
本研究参考既往人和小鼠未成熟睾丸组织玻璃化冻存的相关研究[17-18],将使用较多的15%(DMSO/EG)作为中间浓度,低浓度组和高浓度组分别设置为7.5%(DMSO/EG)和25%(DMSO/EG),分析不同浓度保护剂处理的组织冻存后在结构和功能表型等方面的差异。形态学结果显示15%(DMSO/EG)组结构保存较好,而7.5%(DMSO/EG)组的生精小管结构有明显损伤。渗透性冷冻保护剂充分置换胞内水分是实现快速降温时玻璃化状态的形成的必要条件,A组溶液中保护剂浓度较低,可能对水分的置换不充分,导致溶液在降温过程中不能完全玻璃化或在复温过程中出现再结晶。胞内产生的冰晶会破坏细胞结构,降低细胞活性和功能;胞外产生的冰晶则会破坏组织层次间的粘附和连接,引起生精细胞脱落、上皮与基底膜间空隙形成[17,19]。
UCHL1是泛素羧基端水解酶家族成员,在发育时期睾丸中的精原细胞内特异性高表达,敲除UCHL1的小鼠精原细胞无法正常发育。SOX9是性别决定相关的重要转录因子,在睾丸中主要在支持细胞中表达,调控支持细胞分化,与垂体-性腺轴的功能维持密切相关。StAR是胆固醇在线粒体中转运的关键因子,在睾丸中主要分布在Leydig细胞中,StAR正常表达对睾丸内分泌功能有重要意义。增殖细胞核抗原PCNA是真核细胞有丝分裂时复制复合体的核心成分,对DNA的复制和损伤修复起关键作用,可作为评价冷冻后细胞增殖潜力的标志物[20]。本研究的结果显示玻璃化冻存组中B组的PCNA表达水平最高,可能意味着该浓度保护剂对冻融睾丸组织中精原及幼稚支持细胞的增殖能力维持较为有利。既往研究表明,较高浓度的冷冻保护剂更容易形成良好的玻璃化状态[21]。本研究中,B组的细胞标志物表达和细胞增殖能力在3组中最高,提示15%(DMSO/ EG)保护剂可以在冻融过程中相对较好地维持细胞的生理功能。高浓度C组的形态结构改变比低浓度A组小,但细胞标志物和功能指标的变化趋势却与之相反,且凋亡比例在3组中最高,我们推测这是由于C组25%(DMSO/EG)冷冻保护剂浓度过高,其化学毒性超出了细胞的承受范围,在平衡过程中造成细胞内蛋白变性失活以及部分细胞凋亡。
本研究的浓度分组数量有限,组间浓度差梯度较大,未来可以尝试进一步缩小组间浓度差,以探索更适合未成熟睾丸组织的冷冻保护剂浓度方案。DMSO对大鼠精原细胞冷冻保存较为有利,而EG对精母细胞保存更为有利,并且未成熟和成熟睾丸组织对保护剂的耐受性可能存在差异[15]。因此,建议根据冻存目的和实验对象的发育阶段对冻存液中各组分的浓度进行调整,以提高对特定组织的保存效率。
综上,我们认为冷冻保护剂的不同浓度对未成熟睾丸组织玻璃化冻存效果有显著影响,15%DMSO+15%EG组合是适宜未成熟大鼠睾丸组织玻璃化冻存的保护剂浓度方案,同时,仍有必要针对特定使用对象进一步探索适宜的玻璃化方案,为临床应用提供实验证据和理论支持。

