Bacillus pumilus HN-10对Trichothecium roseum的拮抗作用及菌体结构的影响
黄玉琴, 贠建民, 张紊玮, 艾对元, 漆倩涯, 姚 博
(甘肃农业大学 食品科学与工程学院,甘肃 兰州 730070)
粉红单端孢(Trichothecium roseum)作为一类弱寄生植物病原真菌,是重要的果蔬采后致病菌。会引起苹果霉心病[1]、甜瓜粉霉病[2]和棉铃红粉病[3]。此外,也会引发芒果[4]、葡萄[5]、番茄[6]和坚果[7]等果蔬采后腐烂,造成极大经济亏损。其还可产生具有生物毒性的次级代谢产物对人畜的健康存在潜在的安全隐患[8-9]。目前由T.roseum引起的病害控制主要依赖人工合成的杀真菌剂[10],长期大量使用会增加病原物的抗药性,还会带来环境污染和农药残留的问题[11]。近年来,开展拮抗微生物分离筛选及其活性物质功能开发已成为研究热点[12],利用自然的生物资源防止病害已成为生物防治的重要趋势,有益的拮抗菌也成为重要生防因子[13]。
芽孢杆菌属(Bacillus)是重要的生防细菌。短小芽孢杆菌(Bacillus pumilus)近年来被陆续报道具有拮抗灰葡萄孢菌(Botrytis cinerea),腐霉菌(Pythiumspp)等病原真菌的能力[14-15]。Akhtar等[16]报道将短小芽孢杆菌作为生物菌肥用于鹰嘴豆根腐病获得了很好的防治效果。崔云龙等[17]报道了短小芽孢杆菌D82对小麦根腐病菌有极强的拮抗作用。游春平等[18]分离的短小芽孢杆菌对稻瘟病菌有显著的抑制作用。李静等[19]报道短小芽孢杆菌对芒果炭疽病的抑制率达到94.28%。然而,有关短小芽孢杆菌对果蔬采后重要病原菌T.roseum的拮抗作用及其机理的研究还鲜见报道。
本实验室从腐败的马铃薯湿粉条中分离获得了一株具有拮抗活性的菌株,经生物学特性测定和16SrDNA序列分析鉴定为短小芽孢杆菌(Bacillus pumilusHN-10)。为此,本试验中以该菌株作为拮抗菌,采用体外拮抗法检测其对T.roseum菌丝体生长和孢子萌发的影响,结合甜瓜(Cucumis melo L)损伤接种试验验证其对病害控制效果,通过测定供试病原菌粉红单端孢的生长曲线、电导率、吸光度(OD260,OD280), 及 扫 描 电 镜 (scanning electron microscope,SEM)观察形态变化等为切入点,研究短小芽孢杆菌(B.pumilusHN-10)发酵液粗提物对T.roseum生长及细胞结构的影响,旨在揭示其拮抗作用机理,以期为新的生防治剂开发及果蔬采后病害控制提供理论依据和参考。
1 材料与方法
1.1 材料与试剂
短小芽孢杆菌(Bacillus pumilusHN-10)从腐败马铃薯湿粉条分离得到,经生物学特性测定和16SrDNA序列分析鉴定;粉红单端孢(Trichothecium roseum)由甘肃农业大学食品科学与工程学院微生物实验室保存;甜瓜(Cucumis melo L)于2016年7月采自甘肃省民勤县农场。
硫酸铵:分析纯
PDA固体培养基:马铃薯200 g,葡萄糖20 g,琼脂 15~20 g,pH 值自然,水 1000 mL,用于T.roseum菌种活化,培养,拮抗试验;PDA液体培养基用于T.roseum液体培养。
LB固体培养基:胰蛋白胨10 g,酵母提取物5 g,氯化钠 10 g,琼脂 15~20 g,pH 值 7.0,蒸馏水 1000 mL,用于B.pumilusHN-10斜面及平板培养;LB液体培养基用于B.pumilusHN-10发酵培养。
1.2 仪器
PHS-3C型酸度计,上海佑科仪器公司产品;SW-CJ-1FD型洁净工作台,苏净安泰公司产品;THZ-98A型电热恒温培养箱,上海一恒科学仪器厂制造;FA1204B型电子分析天平,上海精密科学仪器厂制造;YXJ-2离心机,湘仪离心机仪器有限公司产品;U-3010型紫外-可见分光光度计,Hitachi公司产品;DDS-11A型电导率仪,上海分析仪器厂制造;HITACHI S-4800-I型扫描电镜,日本Hitachi公司产品。
1.3 试验方法
1.3.1 发酵液蛋白粗提物的制备 在无菌条件下将斜面保存的短小芽孢杆菌 (B.pumilusHN-10)转接到平板上,培养24 h后,将其单菌落接种于LB液体培养基,37℃摇床振荡培养,连续培养3代种子液后将其按5%接种体积分数接种到发酵瓶中,置 37℃,180 r/min的振荡器中振荡培养 3 d,10000 r/min离心20 min,上清液加固体硫酸铵至70%饱和度,置4℃下过夜。然后用高速冷冻离心机在10000 r/min、4℃下离心20 min。所得沉淀溶解于 50 mmol/L 的 Tris-Hcl(pH 6.8)缓冲液中,之后利用截留相对分子质量为12000~14000之间的透析袋进行脱盐。透析48 h后,用0.22 μm微孔滤膜过滤,得到的液体为发酵液蛋白质粗提物,置4℃储存,待用。
1.3.2T.roseum孢子悬浮液制备 参照Bi等[20]方法。在28℃培养7 d的T.roseum平皿中,加入含0.05 g/dL Tween80的无菌水,刮下孢子转入三角瓶,双层纱布过滤后旋涡振荡。用血球计数板数出孢子悬液的浓度,稀释至1×108个孢子/mL的孢子悬液,备用。
1.3.3 抑菌效果的测定 采用牛津杯法进行抑菌实验,取已灭菌的牛津杯置于涂有T.roseum孢子悬液的PDA平板上,吸取经0.22 μm微孔滤膜过滤的发酵液0.3 mL滴加于牛津杯中,每个平板放4个牛津杯,加等量无菌蒸馏水(CK1)和无菌LB液体培养基(CK2)做为空白对照,培养7 d,观察抑菌情况。
1.3.4 不同体积稀释度发酵液对T.roseum孢子萌发的影响 参照Li等[21]方法,在1 g/dL的水琼脂平板上,用5 mm的打孔器打孔,然后用无菌的镊子将水琼脂饼夹到灭菌的载玻片上,每个载玻片上放置3个,在每个琼脂饼上滴加用0.22 μm滤膜过滤的10 μL 的不同体积比 (发酵原液按 1∶1,1∶2,1∶3,1∶4(体积比)稀释)的发酵液,以同体积的无菌水做对照,每个琼脂饼分别加入10 μL的孢子悬浮液,28℃培养15 h,观察孢子萌发情况,每个琼脂饼观察200个孢子,芽管长度达到孢子直径的一半时认为萌发。
1.3.5 不同体积稀释度发酵液对T.roseum菌丝生长的影响 参照Liu等[22]方法,将灭菌后的PDA培养基冷却至温度60℃,加入不同体积稀释度用0.22 μm 滤膜过滤(发酵原液按 1∶1,1∶2,1∶3,1∶4(体积比)稀释)的发酵液2 mL,充分溶解,均匀平铺于培养皿,以加入等量无菌水的PDA平板为对照。将培养7 d的T.roseum平板,打孔器打取菌饼接于培养基,28℃培养7 d后,用十字交叉法测定菌落直径,每个浓度重复试验3次。
1.3.6 不同体积分数发酵液对甜瓜损伤接种后对病斑直径的测定 孢子悬浮液创伤接种 参照Bi等[20]方法。选取外观大小均一,无损伤和病虫害的甜瓜,2 g/dL的次氯酸钠浸泡2 min,自来水冲洗室温晾干,用体积分数为75%的酒精对甜瓜表面消毒,用无菌打孔器在果实上刺5 mm×3 mm的伤口4个,接入0.22 μm滤膜过滤的10 μL不同稀释度的发酵液,20 min后,接入10 μL孢子悬液,保鲜袋包装,室温条件下贮藏15 d,十字交叉法测病斑直径。每个处理3个甜瓜,3次重复,加同体积无菌水作为对照。
菌丝块创伤接种。参照章战华[23]的方法,略加修改。用打孔器在甜瓜上刺5 mm×4 mm的伤口3个,接入0.22 μm滤膜过滤的20 μL不同稀释度的发酵液,20 min后,将培养了7 d的T.roseum菌苔用5 mm的打孔器打下菌丝边缘的菌碟,接种到刺伤后的伤口上,以接入同体积的无菌水作为对照。
1.3.7 发酵液蛋白粗提物处理后T.roseum生长曲线的测定 将PDA液体培养基加入发酵瓶中,灭菌冷却后按10%的加液体积分数加入1×108个孢子/mL的菌悬液和0.22 μm滤膜过滤的发酵液蛋白粗提物,对照接等量的无菌蒸馏水,之后在28℃、180 r/min条件下振荡培养。每隔12 h时分别取样50 mL,8000 r/min 离心 30 min,收集菌丝体,105 ℃烘干至恒重,称其质量,每组重复3次,取平均值绘制生长曲线。
1.3.8 发酵液粗提物处理后T.roseum菌液电导率的测定 参照王鑫等[24]的方法,并稍加修改。将1×108个孢子/mL的菌悬液按10%接种体积分数接种于PDA液体培养基,后按10%的加液体积分数加入0.22 μm滤膜过滤的发酵液粗提物,对照加等量的无菌去离子水,在28℃、180 r/min条件下振荡培养,每隔4 h取菌悬液5 mL,8000 r/min离心20 min,将上清液用去离子水稀释20倍,将电导电极浸入到待测溶液中,缓慢搅拌,待测量值稳定后读数,试验重复3次。
1.3.9 发酵液粗提物处理后T.roseum核酸和蛋白质渗出量的测定 参照Paul等[25]的方法稍作修改。将孢子浓度为1×108个孢子/mL的悬液和0.22 μm滤膜过滤的发酵液粗提物分别按10%接入体积分数加入PDA液体培养基,无菌去离子水作为对照。在28℃、180 r/min摇床中震荡培养,每隔4 h取菌液6 mL,6000 r/min离心20 min所得的上清液在260 nm和280 nm处测定吸光值,试验重复3次。
1.3.10 发酵液粗提物处理对T.roseum菌体表面形态的观察 为进一步确定抑菌机理是否为破坏该菌体的细胞结构,采用扫描电子显微镜观察孢子及菌体形态。参照Li等[26]方法,并稍加修改。在PDA液体培养基中,按10%的加液体积分数分别加入0.22 μm滤膜过滤的发酵液粗提物和孢子悬浮液(1×108个孢子/mL),无菌水处理作为对照。在28℃,180 r/min摇床培养 4、12、20 h后,4℃条件下用体积分数为2 g/dL戊二醛固定2 h,PBS溶液洗3次,每次10 min;再浸泡在1 g/dL锇酸溶液中,4℃下2 h左右。用体积分数50%、70%、95%和100%的梯度乙醇各脱水10 min。醋酸异戊酯置换20 min,干燥,真空镀金。在扫描电镜下观察,并采集照片。
1.4 数据分析和统计
采用Excel2007进行统计处理数据,以上测定均为3组平行,结果以平均值±标准差方式表示。SPSS19.0对各测定指标进行方差分析。
2 结果与分析
2.1 B.pumilus HN-10发酵液对T.roseum的抑制效果
由图1看出,无菌蒸馏水(CK1)和无菌的LB液体培养基(CK2)为空白对照的牛津杯周围长满了T.roseum菌丝体,而加注B.pumilusHN-10发酵液的牛津杯周围没有菌丝体生长,说明B.pumilusHN-10发酵液对T.roseum菌体生长具有显著的抑菌效果,且该抗菌活性物质为胞外产物。同时证明发酵液的抑菌活性与LB培养基的成分无关。

图1 B.pumilus HN-10发酵液对T.roseum的抑制效果Fig.1 AntibacterialeffectofB.pumilusHN-10 fermentation fluid on T.roseum
2.2 不同体积稀释度发酵液对T.roseum孢子萌发的影响
由图2可知,不同体积稀释度的发酵液均能有效抑制孢子萌发,但不同的稀释度之间存在着显著效果差异,发酵液稀释倍数越小,抑制效果越好。发酵液处理几乎完全抑制了孢子萌发,且孢子萌发率仅为对照的3.29%。

图2 不同体积稀释度发酵液对T.roseum孢子萌发的影响Fig.2 Effects of the different concentration fermentation fluid on spore germination of T.roseum
2.3 不同浓度发酵液对T.roseum菌丝生长的影响
由图3可知,发酵液处理可显著抑制T.roseum的菌落直径的扩展,并呈现出浓度效应。不同稀释度的发酵液抑制的效果有差异,但值得注意的是,整个培养阶段发酵原液的抑菌效果最好,几乎完全抑制了菌落直径的扩展,其菌落直径仅为对照的49.21%。

图3 不同体积稀释度发酵液对T.roseum菌丝生长的影响Fig.3 Effects of the different concentration fermentation fluid on mycelial growth of T.roseum
2.4 不同体积稀释度发酵液对甜瓜损伤接种后病斑直径的影响
由图4可知,不同稀释度的发酵液对甜瓜的致病效果存在着差异。无论是悬液接种还是菌丝块接种,发酵原液对病原菌的抑制效果最好,病斑几乎没有扩展,其腐烂病斑直径控制率分别为92.74%和89.50%;比较孢子悬浮液创伤接种和菌丝块创伤接种可以发现,菌丝块创伤接种所致甜瓜病斑面积,比孢子悬浮液创伤接种病斑直径要大,由此可以推测发酵液对T.roseum孢子萌发的抑制作用要大于对菌丝生长的影响。

图4 不同体积稀释度发酵液对甜瓜悬液和菌块接种的抑制效果Fig.4 Antibacterial effect of the different concentration fermentation fluid on melon of suspension and mycelia plugs inoculation
2.5B.pumilus HN-10发酵液蛋白粗提物对T.roseum生长曲线的影响
为进一步考察B.pumilusHN-10发酵液的抑菌效果及机理,本试验进行了发酵液中蛋白质的粗提,开展了液体培养条件下发酵液蛋白粗提物对T.roseum生长曲线的影响。结果如下:
典型微生物生长曲线粗分为4个时期:迟缓期、对数生长期、稳定期及衰退期。微生物生长曲线反映了微生物各个生长阶段的群体生长状况及规律,能反映菌体生物量的变化[27]。因此,可以通过测定菌体生物量来判断抑菌效果。由图5可知,对照组的T.roseum生长良好,具有典型的生长曲线特征,在72 h已开始进入稳定期,108 h时达到最大生物量为0.408 g。而处理组生长曲线位于对照组下方,生长曲线呈现为平缓的波浪状,且发酵液粗提物在对数期即表现出显著抑菌作用。处理组,在整个生长周期T.roseum的生长受到抑制,导致对数增长期斜率平缓、稳定期最大生物量明显减小,呈不典型生长特征,且最大生物量仅为0.082 g。结果说明发酵液粗提物能够明显抑制T.roseum的生长繁殖。

图5 发酵液粗提物对T.roseum生长曲线的影响Fig.5 Effect of fermentation fluid crude extract on growth curve of T.roseum
2.6 B.pumilus HN-10发酵液粗提物对T.roseum菌液电导率的影响
电导率是衡量溶液中离子强度高低的一个特征参数,其值与离子组分浓度密切相关[28]。菌体的保护屏障是细胞膜,当遇到强抑菌剂时会使细胞膜遭到破坏,菌体的保护屏障被打破,其内部的电解质外泄至溶液中,从而使电导率上升,因此菌液电导率的变化可以反映细胞膜通透性的变化[29]。由图6可知,处理组的电导率明显高于对照组,且整体上呈上升趋势,可以推测发酵液粗提物中的抗菌活性成分对T.roseum的生长抑制作用可能是通过破坏其细胞膜,使细胞的通透性增加,内容物渗出而达到抗菌的目的,也可能是菌体在生长过程中产生的代谢物质使电导率发生变化。
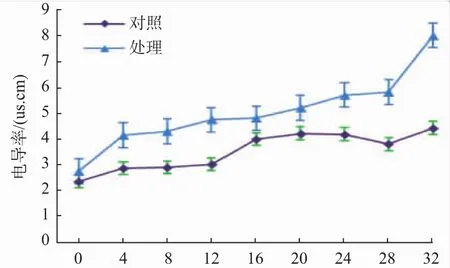
图6 发酵液粗提物对T.roseum电导率的影响Fig.6 Effect of fermentation fluid crude extract on the conductivity of T.roseum
2.7 B.pumilus HN-10发酵液粗提物对T.roseum核酸和蛋白质渗出量的影响
细胞内物质的泄漏是细胞膜破损的重要指标之一。蛋白质,核酸及其衍生物是细胞的重要生命物质,正常细胞的蛋白质及核酸物质不会泄漏到细胞外。了解胞内蛋白质与核酸的泄漏情况,可以间接反映细胞膜的破损程度[30]。由图7可知,随着处理时间的增加,处理和对照组的OD260值、OD280值都不断增大,但处理组的值总是大于对照组,说明细胞内的蛋白质、核酸都有泄漏发生,另外还可以看出处理后0~20 h,吸光值大幅度增加,说明发酵液粗提物处理前期对物质泄漏的影响最大。其变化趋势和电导率的变化趋势相吻合,这也进一步验证了电导率的增加是由于细胞内的蛋白质、核酸泄漏增加。电导率、OD260值和OD280值的变化都不完全呈直线状态,这表明发酵液粗提物对细胞膜通透性的影响是比较复杂的。
2.8 B.pumilus HN-10发酵液粗提物对菌体表面形态变化的影响
为了进一步验证发酵液粗提物对T.roseum孢子及菌丝体结构的破坏作用。本试验采用扫描电镜观察了不同时期孢子萌发的形态变化。由图8可知,处理显著改变了菌体表面形态,处理时间越长,形态的改变也就越明显。无菌蒸馏水对照组在4 h时孢子表面形状完整,体态饱满;在12 h时孢子有萌发迹象,芽管开始凸出,孢子体表完整。在20 h时绝大多数孢子都已长出菌丝,且菌丝分布均匀,形态规则。而粗提物处理组,孢子皱缩,表面粗糙,体表凹陷明显(图 4(d)-(f)),处理 4 h 时孢子形态与对照相比变化不大,随时间的延长,在12 h时,孢子的皱缩程度显著增强,聚集粘连。在20 h时,孢子表面极具褶皱,明显抑制了孢子萌发过程芽管的形成。

图7 发酵液粗提物对T.roseum内核酸、蛋白质泄露的影响Fig.7 Effects of fermentation fluid crude extract on permeation of nucleic acid and protein of T.roseum
本研究在对短小芽孢杆菌 (Bacillus pumilusHN-10)发酵液处理粉红单端孢(Trichothecium roseum)后其生理生化指标,如电导率,胞内蛋白和核酸渗出量等的测定基础上,采用扫描电镜图像分析方法,从T.roseum孢子萌发形态及结构特征方面开展进一步考察,二者间相互映衬,互为补充,可为进一步推测B.pumilusHN-10发酵液对T.roseum的抑菌机理提供证据。扫描电镜观察到B.pumilusHN-10菌株发酵液处理使T.roseum菌体形态发生了明显变化,孢子萌发受到抑制,菌体细胞壁表面出现凹陷变形,细胞膜的平滑形态变得褶皱。据此,我们推测其抑菌机理可能是发酵液粗提物破坏了菌体细胞壁,膜结构,细胞膜的表面积增大并使细胞膜的磷脂双分子层变得更为疏松细胞通透性增大,致使细胞内溶物渗出,细胞代谢发生紊乱,菌体的生长繁殖受到阻碍抑制,进而发挥抑菌作用。这一结果与吴海霞[31]用扫描电镜观察银杏种仁抑菌蛋白作用Klebsiella.peneumoniae菌后使其形态结构变化,以及秦楠[32]通过扫描电镜观察的方法研究解淀粉芽孢杆菌HRH317抗菌蛋白对禾谷镰孢菌(Fusarium graminearum)得出的实验效果相一致,均推测可能是一些抑菌蛋白作用于菌体细胞膜,引起膜的损伤、破坏和通透性改变。当然,关于B.pumilusHN-10菌株对T.roseum抑菌机理的揭示,还有待于通过透射电镜等试验来进一步研究和验证。

图8 发酵液粗提物处理对T.roseum表面形态的影响Fig.8 Effect of fermentation fluid crude extract on spore morphology of T.roseum
3 结语
短小芽孢杆菌(Bacillus.pumilusHN-10)的发酵液能够有效抑制粉红单端孢(Trichothecium.roseum)菌体生物量增加,对其菌丝生长和孢子萌发有明显抑制效果。同时,甜瓜(Cucumis melo L)悬液和菌丝块接种试验验证了发酵液对病原菌粉红单端孢引起的腐烂抑制效果显著,其腐烂病斑直径控制率分别为92.74%和89.50%。
B.pumilusHN-10发酵液蛋白粗提物处理对T.roseum液体培养条件下的电导率,细胞内蛋白质、核酸渗出量均较对照显著提高;扫描电镜观察结果表明,处理组菌体表面出现明显的皱褶,有效抑制了孢子萌发过程芽管的形成。
B.pumilusHN-10发酵液粗提物对T.roseum的抑菌机理可能主要是对细胞膜结构造成破坏作用,细胞内溶物大量流出,使菌体代谢紊乱,菌体的生长繁殖受到阻碍和抑制。

