微生物谷胺酰胺转氨酶在蛋白质修饰中的应用
程孝中, 赵鑫锐, 洪皓飞, 杨 敏, 周志昉, 吴志猛*
(1.江南大学 教育部糖化学与生物技术重点实验室,江苏 无锡 214122;2.亳州学院 生物与食品工程学院,安徽亳州 236800)
蛋白质是生命中最重要的生物大分子,蛋白质通过修饰,形成不同功能的蛋白质,生物体内修饰主要包括泛素化、磷酸化、乙酰化、糖基化、甲基化等[1]。酶参与的蛋白质定点修饰是近年来发展起来的一类新的蛋白质修饰方法。该法具有反应条件温和,通常在水溶液和中性的pH环境下反应;催化的反应具有高度的专一性,能够实现对蛋白质的区域和位点专一性修饰等优点而备受关注。最近研究比较多的酶主要有甲酰甘氨酸生成酶、唾液酸转移酶、磷酸泛酰巯基乙胺基转移酶 (PPTase)、OGlcNAc糖基转移酶、分选酶(Sortase)、谷氨酰胺转移酶(Transglutaminases)、脂肪酸转移酶、生物素连接酶、硫辛酸连接酶、N-肉豆蔻酰基转移酶等[2]。其中的谷氨酰胺转氨酶修饰可形成异肽键(isopeptide bond),修饰后的产物不容易被蛋白酶降解,而且这种修饰反应和分选酶的可逆反应不一样,是一种单向不可逆反应,有利于提高产率[3]。因此,谷氨酰胺转氨酶在蛋白质修饰中被广泛关注。
谷氨酰胺转移酶主要分成两大类。动物来源的谷氨酰胺转氨酶(Transglutaminase 2,TG2)主要参与内吞作用、细胞凋亡、细胞粘附等生命活动,它是一类依赖于钙离子的谷氨酰胺转氨酶[4-6]。微生物谷氨酰胺转移酶(Microbial transglutaminases,MTGase)首次从链霉菌(Streptomyces mobaraensis)中分离得到,在自然界中主要催化蛋白质之间的共价连接,这种特别的功能长期以来主要应用于食品和纺织工业中的蛋白质交联,从而改变肉、羊毛、皮革的特性[7]。作为一种易得、便于使用、不依赖钙离子调节的MTGase,近年来被广泛应用于蛋白质定点修饰。
本文作者综述了微生物来源谷氨酰胺转移酶在蛋白质定点修饰中的最新进展,这些定点修饰包括抗体与小分子之间、蛋白质与蛋白质之间、蛋白质与聚合物之间、蛋白质与糖类物质之间、蛋白质与脂质体之间的定点偶联以及短肽的自身环化。
1MTGase的结构及催化机理
MTGase内部的二级结构是由8个β折叠组成,外部是11个α螺旋,分子呈盘状并带有一个裂缝,2个环组成裂缝左壁,1个环组成裂缝右壁,裂缝深度为 16 Å,催化活性基团 Cys64、Asp255和His274均位于分子裂缝底部[8](图1),催化反应时,底物进入裂缝与催化活性基团结合。MTGase最初以酶原形式存在,N端螺旋结构占据裂缝空间,阻止底物进入裂缝参与反应[9],当N端螺旋结构被内源性的金属蛋白酶和氨肽酶切去后转变为有催化活性的MTGase[10-11]。利用氨基酸突变技术,发现Asp255和His274在催化底物时发挥主要作用[12]。
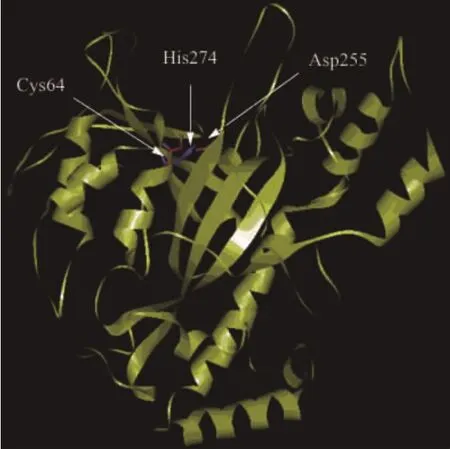
图1MTGase晶体结构Fig.1 Overall sturcture of microbial tranlglutaminase
MTGase催化蛋白质肽链中谷胺酰胺γ-羧酰胺基(酰基供体)与各种酰基受体发生酰胺基转移反应,在蛋白质和多肽当中,谷氨酰胺常作为酰基供体,赖氨酸作为酰基受体发生酰基转移反应。催化反应时,Cys64侧链的S亲核攻击酰基供体谷氨酰胺侧链基团上的C原子(图2中(a));Asp255提供一个质子给氧离子中间体并释放出氨(图2中(b)、(c)、(d)),Asp255 形成带负电的活化基团;然后酰基受体(例如赖氨酸侧链)在空间上接近Asp255活化基团被亲核攻击并释放产物(图 2 中(e)、(f))。 根据酰基受体的不同,催化反应可以分为3类[13]:1)酰基转移反应,伯胺作为酰基受体(图 3(a));2)谷氨酰胺和赖氨酸间的交联反应,此时赖氨酸作为酰基受体,这种反应主要出现在蛋白片段或者多肽间的连接反应(图 3(b));3)脱酰基作用,水作为酰基受体(图 3(c))。

图2MTGase催化机理Fig.2 Catalytic reaction mechanism of MTGase

图3 MTGase催化的化学反应Fig.3 Reactions catalyzed by microbial transglutaminase
MTGase对底物具有一定的特异选择性。对于酰基供体谷氨酰胺来说,其附近的氨基酸对MTGase的活性有较大影响。Sugimura Y等[14]利用肽文库展示技术研究MTGase最适底物肽发现:当谷氨酰胺N端-3位与-2位分别是芳香族氨基酸和亮氨酸,谷氨酰胺C末端+1、+2位和+3位分别是精氨酸、脯氨酸和酪氨酸时,MTGase催化活性最高。在这种规律基础之上,Oteng-Pai等[15]合成了一系列的五肽和七肽,研究与MTGase结合活性时发现:七肽底物 7M42 (Ac-YELQRPY-NH2)和 7M48 (Ac-WALQRPH-NH2)与MTGase亲和力最大。另外,Lee[16]课题组利用mRNA展示技术筛选出了高亲和力的五肽底物(RLQQP和RTQPA),这些Q-Tag常用于MTGase对蛋白质定点修饰当中(表1)。相对酰基供体谷氨酰胺,MTGase的酰基受体底物比较广泛[17-18],对于非天然的酰基受体而言,伯胺类底物要求伯氨基团与临近的功能基团之间必须间隔4个以上无侧链碳原子才能获得较高的反应活性;与伯胺相连的烷基链越长,反应活性越高;因此MTGase可以催化ω-氨基酸、精胺、腐胺、尸胺、羟胺和N,N-二甲基-1,4-苯二胺等非天然的酰基受体[17,19-20]。在天然的酰基受体中,也存在活性比较高的序列,Lee[21]课题组利用荧光共振能量转移技术(Fluorescence resonance energy transfer,FRET)筛选到一个活性比较高的赖氨酸识别序列 (K-Tag)KTKTN,这种五肽底物的活性高于传统的6个赖氨酸标签(K6)。

表1 微生物谷氨酰胺转移酶识别的Q/K-TagTable 1 Examples of Q/K-Tag Recognized by Microbial Transglutaminase
2MTGase在蛋白质定点修饰中的应用
2.1 MTGase在抗体定点修饰中的应用
将小分子药物连接到抗体上形成抗体偶联药物(Antibody Drug Conjugates,ADCs),能够提高药物治疗效果、安全性和靶向性。随着治疗乳腺癌和淋巴瘤的抗体偶联药物Kadcyla和Adcetris的成功上市[28],抗体偶联药物成为一个新的研究热点。和临床上其他的ADCs一样,Kadcyla和Adcetris都是由小分子药物通过化学方法随机偶联至抗体的赖氨酸位点,平均每个抗体可以偶联3-4个小分子药物,形成的药物复合物均一性较差[29]。这种不均一性给ADCs药物的质量控制,药物稳定性以及治疗效果带来不确定性。因此,发展ADCs药物的定点偶联技术十分必要。
利用MTGase连接药物与蛋白质,必须要求目标蛋白质要有活性的谷氨酰胺,对于相对分子质量比较大的蛋白质,此类谷氨酰胺较多,例如IgG1(typical immunoglobulin Gamma1)大约有 60 个谷氨酰胺,Josten[30]将氨基修饰过的生物素衍生物(图4(b)1)作为酰基受体偶联至抗体上的谷氨酰胺,平均每个抗体只能连接一到两个生物素,而且无法确认这些生物素所连接的特定位点,这势必影响连接效率和均一性。 由于抗体上不同位点的偶联会影响ADCs药物在体内分布、降解、药物稳定性和药代动力学[31-32],所以,Josten等人的修饰方式往往导致ADCs药物相对狭窄的治疗指数。Pavel[27]与他们的合作者则利用基因工程手段将单克隆抗体IgG1的重链C端带上Q-Tag(LLQGG),可以将带有氨基标签的荧光素(图 4(b)2)、糖衍生物(图 4(b)3)、螯合剂(图 4(b)4,4(b)5)、微管蛋白抑制剂(图 4(b)6)、热休克蛋白90抑制剂、DNA损伤药物连接到抗体上;另外,这种定点修饰可以发生在抗体的Fab和Fac结构域,其中荧光基团的偶联效率可以达到79%。Q-Tag的定点引入极大地提高了ADCs与小分子药物偶联的均一性。

图4 MTGase在抗体定点修饰中的应用Fig.4 Application of MTG to antibody modification
除了将药物利用MTGase偶联到抗体上外,MTGase还可以将一些放射性核素偶联至抗体,抗体与放射性核素的偶联在放射影像学以及诊断学有重要作用。例如,对chCE7抗体进行Ga标记,可以追踪抗体在生物体内放射性分布;把抗体与Zr偶联标记可进行X断层扫描[33]。在对chCE7抗体进行放射免疫偶联时,研究者发现[27,33-36],chCE7抗体297位的天冬酰胺由于糖基化导致295位的谷氨酰胺无法进行偶联,当297位去糖基化后,295位的谷氨酰胺具有很好的偶联活性;或者将297位突变成谷氨酰胺,297和295两个位点都可以进行偶联。这是因为297位的糖基化使得295位的谷氨酰胺位点由于空间位阻很难被MTGase所识别,如果去糖基化或者突变使得 295 位点暴露来[37](图 4(a)),反应则可进行。
2.2 MTGase在蛋白质与蛋白质定点偶联中的应用
在食品工业中,MTGase可以实现蛋白质间的交联,从而改变食品的风味和蛋白质(酶)的功能,这种蛋白质交联是随机的、非定向的[38]。引入定向修饰可以改善修饰产物的均一性,这对于蛋白质修饰来说至关重要,均一性的修饰产物表现出优越的生物特性。为了克服这一问题,同样利用基因工程手段,将蛋白质或酶的活性中心之外的区域标记上一个MTGase识别的谷氨酰胺或者赖氨酸位点,这样人们可以将任何感兴趣的修饰基团添加到蛋白质上,而且这种修饰是定点和特异性的(图5)[23]。譬如,Nagamune等[39]通过基因工程手段在细胞色素P450中引入带 Q或 K的短肽标签 (tag),利用MTGase成功将另外2个功能性蛋白偶联到P450上,得到P450多功能酶;他们还将没有MTGase识别位点的野生型绿色荧光蛋白通过基因工程引入MTGase识别位点,利用MTGase将绿色荧光蛋白(GFP)与待检测蛋白核糖核酸酶S肽偶联,应用于蛋白质检测[40];利用同样的方法,可以将单结构域抗体片段结合到碱性磷酸酶用于酶联免疫测定[41]。另外,借助基因工程手段,MTGase还可以实现酶固定化,Goto 等[42]在碱性磷酸酶(Alkaline phosphatase AP)的N端利用基因工程手段表达一个可以提供赖氨酸位点的短肽MKHKGS,酪蛋白利用化学方法固定于聚丙烯树脂,然后利用MTGase将碱性磷酸酶与树脂固定化的酪蛋白连接,实现碱性磷酸酶的固定化。最后,利用这种方法还可以实现蛋白质的多聚化,Scheller[43]课题组将单结构域的抗体接入核糖核酸酶S肽标签后可以和肿瘤坏死因子形成二聚体或多聚体,这种多聚体比单聚体活性更高。上述这种利用基因工程手段引入MTGase修饰位点的方法,其优点是扩大了被修饰蛋白质的范围。

图5 MTGase通过基因工程引入识别标签介导蛋白质间的偶联Fig.5 Protein ligation mediated by MTGase through genetically encoded tag
2.3 MTGase介导的蛋白质与聚合物之间的定点偶联
2.3.1 MTGase介导的蛋白质与PEG (polyethyleneglycol)定点偶联 聚乙二醇PEG通常用来修饰药物蛋白质和多肽,可以显著改善这些药物的体内半衰期,提高药物的稳定性和活性。在PEG末端通过化学方法引入氨基,可以模拟赖氨酸侧链氨基功能,然后利用MTGase实现蛋白质的PEG化。Sato[44]于1996年首次利用豚鼠肝来源的谷胺酰转氨酶实现了蛋白质的PEG修饰。之后,他们完善了这种修饰方法[45],改用MTGase将人白介素-2单个活性位点Q74连接上12×103的PEG,同时PEG另一端引入半乳糖残基 (Gal3),Gal3是肝细胞膜上去唾液酸糖蛋白受体 (asialoglycoprotein receptor ASGP-R)的配体,Gal3的引入赋予白介素-2靶向性,修饰后的药物半衰期延长,同时保持原有药物活性不变。
另外,Fontana[46-47]课题组利用MTGase对肌红蛋白和人生长激素PEG修饰进行了初步探索,但修饰后的药物均一性较差,因此,他们试图通过不同的方法改变这一缺陷。例如,人生长激素(hGH)虽然有13个谷氨酰胺,Pasut等[48]研究发现,通过改变MTGase酶与底物的量,将PEG末端带上氨基可以定点连接至蛋白质的Q141位点,能够得到均一性较好的偶联体;另外还可以改变溶剂反应体系,Mero等[49]以鲑降钙素(sCT)和人生长激素作为模式蛋白,在MTGase反应体系中添加不同比例的有机溶剂(DMSO,EtOH,MeOH,MeCN,TFE),在水/有机溶剂共溶剂系统中可以实现鲑降钙素和人生长激素的定点PEG修饰,这可能是因为溶剂改变了目的蛋白和酶的二级结构所导致的(图6)[50]。
上述通过改变反应物的量或者溶剂反应体系策略虽然在一定程度能实现蛋白质的定点PEG化,但仍然无法做到精确控制。蛋白质上能够被修饰的谷氨酰胺或者赖氨酸位点相对于总的谷氨酰胺或者赖氨酸位点是比较少的,在许多蛋白质中这种能够被识别的修饰位点就只有1个或者2个,如果能够确定这些修饰位点就能够实现定点修饰而得到均一性的偶联体。Maullu等[51-52]利用计算机信息学方法,通过理性设计,在人粒细胞集落刺激因子上找到定点修饰位点,实现了定向位点引入PEG。

图6 MTGase介导的蛋白质定点PEG修饰Fig.6 MTGase-mediated site-specific protein PEGlation
2.3.2 MTGase介导的蛋白质与POZ(polyoxazoline)之间的定点偶联 虽然PEG修饰药物已经商品化并成为蛋白质药物修饰的金标准,但PEG具有诸如免疫反应、难清除等缺点,人们试图找到性能更好的多聚体修饰物。恶唑啉多聚体(POZ)是最近几年发现的另外一种水溶性、生物相容性优良的多聚体。在合成恶唑啉多聚体时,通过化学方法在终止末端引入功能性基团氨基,该恶唑啉多聚体能被MTGase识别并与人粒细胞集落刺激因子上的Q残基连接,形成蛋白-恶唑啉多聚体复合物[53]。这些复合物无论在体内还是体外实验中,与修饰前相比较,都表现出较高的生物活性。
2.4 MTGase介导的蛋白质与糖类物质之间的定点偶联
利用MTGase,还可以将寡聚糖偶联至一些食品类蛋白质上,一般是将葡萄糖胺作为酰胺基供体接至酪蛋白[54]、谷蛋白水解物上[55],从而改变这些蛋白质的特性,例如,利用壳寡糖对大豆蛋白进行糖基化,修饰后的大豆蛋白疏水性和乳化作用较低,乳剂稳定性提高,对水和油的结合能力提高[56]。
在修饰工业酶方面,Villalonga等[57-59]利用MTGase对胰蛋白酶进行了环糊精 (CD)、葡聚糖(DEX)、羧甲基纤维素(CMC)、聚蔗糖(FIC)等糖基化修饰,修饰后的胰蛋白酶在热稳定性、酶活性等方面均有改善;将氨基化葡聚糖通过MTGase偶联的方法同样应用于过氧化氢酶的修饰[60],相对于化学修饰,这种酶法修饰能够显著提高酶的活性,但是,由于每个过氧化氢酶偶联的葡聚糖数量较少,导致总体相对分子质量相对于PEG修饰后的相对分子质量较低,与PEG修饰后的过氧化氢酶比较,葡聚糖修饰后的过氧化氢酶的血清半衰期较短。
对药用蛋白质进行糖基化修饰的报道较少,药用蛋白质的糖基化可以提高药用蛋白质的半衰期以及生物利用度,例如,Ramos等[61]首先探索了利用MTGase化学酶法合成神经糖肽的可行性,在此基础上,Sato等[62]利用MTGase在胰岛素上实现了糖基化修饰,发现野生型胰岛素的Q很难进入MTGase活性中心,导致偶联效果不佳,他们将胰岛素B链的N端氨基酸F突变为Q,然后利用MTGase 引入乳糖(图 7),最后利用 α-2,6-siaT(a-2,6-sialyltransferase,唾液酸转移酶)引入唾液酸。由于细菌以及癌细胞表面糖型结构与正常哺乳动物细胞是不一样的,而且大多数细胞表面受体的配体含有糖基化结构[63-65],因此,基于MTGase的酰基转移反应还有望在糖疫苗研发、药用蛋白的靶向性方面发挥重要作用。
羟乙基淀粉(HES)由于具有水溶性较好,易于代谢,较好的生物相容性等优点,逐渐用来替代PEG修饰蛋白质和多肽药物。Besheer[66-67]课题组首次利用MTGase对蛋白质进行HES修饰,HES首先引入cbz-QG和己二胺(HMDA),这样HES既可以作为酰基供体也可以作为酰基受体,再利用MTGase与酪蛋白偶联,形成HES修饰蛋白。

图7 MTGase介导的胰岛素定点糖基化修饰Fig.7 MTGase mediated site-specific insulin modification by oligosaccharides
2.5 其他应用
MTGase可用于环肽的合成,传统环肽的合成是将线性肽首尾(或者侧链基团之间)化学连接,为了避免其他侧链基团的副反应,要求侧链基团全保护,酶法合成环肽避免了这一缺陷。Touati等[68]以MTGase底物WALQRPH为出发点,在C端接入GGG连接臂和酰基受体K(H-WALQRPHGGGKSNH2),实验证明Q的N端-1,-2位的氨基酸对环肽形成至关重要,但是可以任意改变Q的C端序列。另外,他们以血管舒缓素PK15为例,证明了MTGase合成双环肽的可能性。

图8 MTGase介导的蛋白质定点脂质化修饰Fig.8 MTG mediated site-specific protein modification by lipid
最后,MTGase可用于蛋白质的脂质化修饰。Abe等[69]通过基因工程在绿色荧光蛋白(EGFP)的C端接入 K-Tag(MRHKGS)(图 8(b)),通过化学方法合成了不同长度的脂肪酸链修饰的七肽序列GGGSLLQG(图 8(a))提供酰基供体。虽然野生型EGFP有多个赖氨酸和谷氨酰胺残基,但实验证明该蛋白质并不能被MTGase所识别[40];相反,C-端带有K-Tag的EGFP能顺利被MTGase识别,并与带有酰基供体的脂肪链反应,实现绿色荧光蛋白的定点脂质化修饰。
3 结语
自从日本味之素公司首次从链霉菌属中分离到谷胺酰胺转氨酶以来,因其底物的宽泛性,广泛应用于食品类蛋白质的交联。近年来,通过基因工程手段在蛋白质的适当位置引入MTGase能够识别的Q-Tag或K-Tag,利用化学和酶法相结合等手段,MTGase介导的酰基转移反应已经逐渐发展成为蛋白质定点修饰的一个有效手段。特别是在抗体药物制备方面的应用,在提高药用蛋白质的稳定性、活性、半衰期等方面都取得了很好的进展。另外,这种修饰方法还可以用于对蛋白质标记,实现在体内追踪目的蛋白、生物医学造影等。但由于蛋白质上能够被修饰谷氨酰胺或者赖氨酸位点较少,该法不能应用于所有蛋白质,其普适性还有待进一步提高。同时,该法定点修饰蛋白质的效率还需要进一步提高,因此,利用酶工程手段改造MTGase,进一步提高其催化效率也是以后研究的重点。综上所述,基于MTGase的酰基转移反应已经发展为一种高效的、高选择性的蛋白质连接和修饰方法,该方法在蛋白质药物研究中会发挥重要作用。

