固态发酵废菌棒高产哈茨木霉孢子
王巧河 , 朱 莉 , 郑志永 , 高敏杰 , 詹晓北 *
(1.江南大学 生物工程学院,江苏 无锡 214122;2.江南大学 糖化学与生物技术教育部重点实验室,江苏 无锡214122;3.无锡格莱克斯生物科技有限公司,江苏 无锡214125)
化学农药大量使用,导致农药残留、害虫抗药性产生和病虫害再猖獗的“3R”问题以及生态环境恶化[1-2],使人们越来越关注生物防治在农作物病虫害方面的应用。由于木霉菌(Trichodermaspp.)生存能力强、抗病原菌多[3-4],对恶劣环境耐受性强[5],防病机制多,低毒无害,而被用于许多农作物和园林植物土传病害的预防和治疗[6]。迄今为止,全球已有几十种木霉农药在市场上出售[7]。
哈茨木霉是目前使用最多的生防木霉菌,可以防治多种植物性病原菌[8]。但是,在实际农业生产过程中,某些农药的使用及其残留会对生防菌的生长、传代等产生不利作用,导致生防木霉菌防治效果降低,限制了其农田使用的作用和范围[9]。因此,使用一种农药多抗性菌种来生产木霉菌生防制剂显得更有意义。
我国是食用菌生产大国,食用菌产量占全球的75%以上,居世界首位。生产食用菌的菌棒主要用木材、麸皮、豆粕等加工而成,生产后被废弃称为废菌棒,废菌棒的量因食用菌的量大而多。截止2014年,我国木耳和平菇年产量分别为595.7万吨和615.5万吨,并且呈现出逐年递增趋势,因此废菌棒的量也会随之更多。将废菌棒堆放在田间既污染环境又浪费田地,为此废菌棒的再利用成为亟待解决的问题。一些研究者直接把废菌棒作为栽培基质[10],也有用于蛋白质[11]、多糖[12]的提取,还有用于厌氧发酵制沼气[13],而用于发酵生产生防剂的却不多。
本研究中采用农药多抗性菌株哈茨木霉Th-4-B菌株 (该菌株抗性强而且比初始菌株产孢能力提高了39%[9]),以废菌棒为固态发酵的主要基质,探索适合废菌棒固态发酵生产哈茨木霉孢子的方法,为哈茨木霉生防剂的生产与废菌棒的再利用提供经验。
1 材料与方法
1.1 材料
1.1.1 实验材料 菌种:哈茨木霉Th-4-B经诱变筛选而得并保藏于本研究室。
固态发酵培养基主要材料:废菌棒 (纤维素44.37%质量分数、半纤维素14.10%质量分数、木质素26.71%质量分数、灰分1.62%质量分数;有机质87.63%质量分数、碳50.83%质量分数、氮0.83%质量分数),由牡丹江灵泰药业有限公司提供,根据优化需要添加适量的营养成分,发酵使用时121℃灭菌30 min。
1.1.2 培养基 一级种子培养基 (g/L):去皮土豆200,葡萄糖 20,KH2PO43.0,MgSO4·7H2O 1.5,琼脂20;pH 6.0,121 ℃灭菌 20 min。
二级种子培养基(g/L):葡萄糖20,酵母粉15,(NH4)2SO42.5,KH2PO46.0,MgSO4·7H2O 0.8;pH 6.0,115℃灭菌30 min。
1.2 方法
1.2.1 培养方法 一级种子:28℃恒温培养5~6 d;二级种子:250 mL的三角瓶装50 mL培养基,接种量 4 g/dL(下同),120 r/min、28 ℃恒温培养 20 h;固态发酵:500 mL三角瓶恒温静置培养6 d左右。
1.2.2 哈茨木霉孢子数测量方法 称取一定量的固态发酵培养基于三角瓶中,加入一些玻璃珠,再加蒸馏水稀释到适当倍数,用摇床震荡混匀30 min,然后用血球计数板法计数[14]。

式(1)中,R为产孢量(个/g,干质量);c为血球计数板五个中方格孢子数总和;k为稀释倍数;M为取样量;m为含水量。
1.2.3 单因素优化设计 以产孢量为指标,采用单因素法优化对哈茨木霉Th-4-B固态发酵产孢子影响的因素。
1.2.4 响应面分析法实验与验证 根据Box-Behnken(BB)实验设计原理,采用软件Designexpert进行3因素3水平的分析实验,确定各因素对Th-4-B孢子产量影响的显著性和最佳培养基配方。根据BB设计原理[15],响应因子Y为菌株Th-4-B的产孢量,初始含水质量分数(X1)、淀粉质量分数(X2)和 NaNO3质量分数(X3)为 3 个因素,-1、0 和 1为3个水平,如表1。

表1 培养基BB设计表Table 1 Table of BB factors
RSM实验结束之后,根据预测的最佳培养基配方,进行验证实验,测定菌株的产孢量,以验证RSM预测的可行性。
1.2.5 数据分析与作图 实验数据处理分析并作图用Origin软件,差异显著性分析(Duncan,LSD法)用SPSS软件,RSM用Design-expert软件采用BB设计方法对培养基成分进行优化。每个实验重复3次。
2 结果与分析
2.1 固态发酵的单因素优化
2.1.1 培养温度对孢子产量的影响 微生物的生长需要一定的温度,温度过低微生物生长缓慢,菌体量少,过高则会抑制微生物生长,甚至杀死微生物。如图1所示,在22~28℃范围内,孢子产量随温度升高而增加,28℃时达到最大,之后,随温度升高而孢子产量逐渐减少。表明哈茨木霉更适合在25~28℃生长,高于31℃后菌丝生长受到抑制,温度越高抑制越强。所以我们选择28℃作为哈茨木霉发酵的最适温度。

图1 发酵温度对产孢量的影响Fig.1 Effect of temperature on sporulation
2.1.2 最佳发酵时间的选择 0~48 h为哈茨木霉生长适应期,几乎没有孢子产出,48~60 h开始逐渐产生少量孢子,72 h之后菌丝由白逐渐变绿,并迅速进入孢子快速形成期,144~156 h进入稳定期,孢子产量不再增加,达到最大值,如图2所示。因此,选择发酵时间为144 h。
2.1.3 装料量对孢子产量的影响 对于固态发酵而言,装料量的多少直接影响到发酵的散热、水分的散发和氧气的供应。装料量为20 g时孢子产量最大;低于20 g时孢子产量减少,可能是由于装料量过少导致培养过程中水分散发较多,使产量降低;装料量过高孢子产量更低,装料量为30 g时孢子产量还不到20 g的一半,如图3所示。因此选择20 g为最佳装料量。

图2 固态发酵孢子生长曲线Fig.2 Growth curve of spore in solid-state fermentation
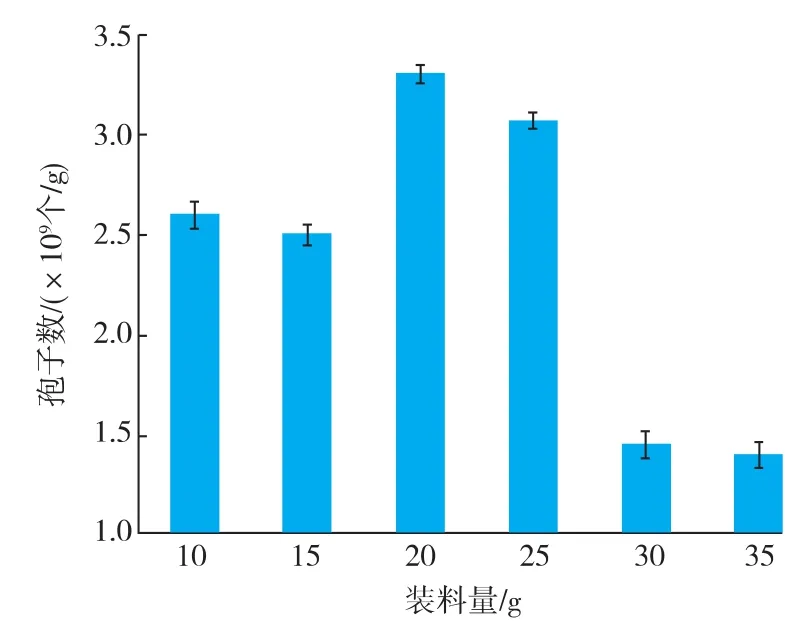
图3 装料量对固态发酵产孢量的影响Fig.3 Influence ofsubstrate loading quantity on sporulation in solid-state fermentation
2.1.4 初始pH对孢子产量的影响 pH对微生物的生命活动影响是多方面的,它可以通过影响细胞膜所带的电荷进而影响细胞对营养物质的吸收,也可以改变环境中有机化合物的离子化程度间接影响微生物。用盐酸或氢氧化钠溶液调节培养基的初始pH,发酵结果如图4所示,pH 6时孢子产量最高,pH 4或2都比pH 8或10的产量低。pH自然(pH 约为 5.19)时孢子产量为 3.31×109个/g,与 pH 6时(3.35×109个/g)孢子产量相当。 因此,可以选择pH自然进行固态发酵。
2.1.5 接种质量浓度对孢子产量的影响 如图5所示,7.5 g/dL接种质量浓度时产孢量最高且与其他差异显著,为3.22×109个/g,当接种质量浓度为2.5、5.0 g/dL时孢子产量较低,原因可能是接种量小,微生物适应新环境比较慢,至使Th-4-B生长量少,后期孢子产量较低;而接种质量浓度大于7.5 g/dL时,产孢量逐渐下降,可能是因为营养物质与空间的限制及代谢毒物的迅速增加,抑制了Th-4-B的生长,也不利于孢子的形成。因此我们选择7.5 g/dL为哈茨木霉固态发酵最佳接种质量浓度。

图4 pH对固态发酵产孢量的影响Fig.4 Influence of pH on sporulation in solid-state fermentation
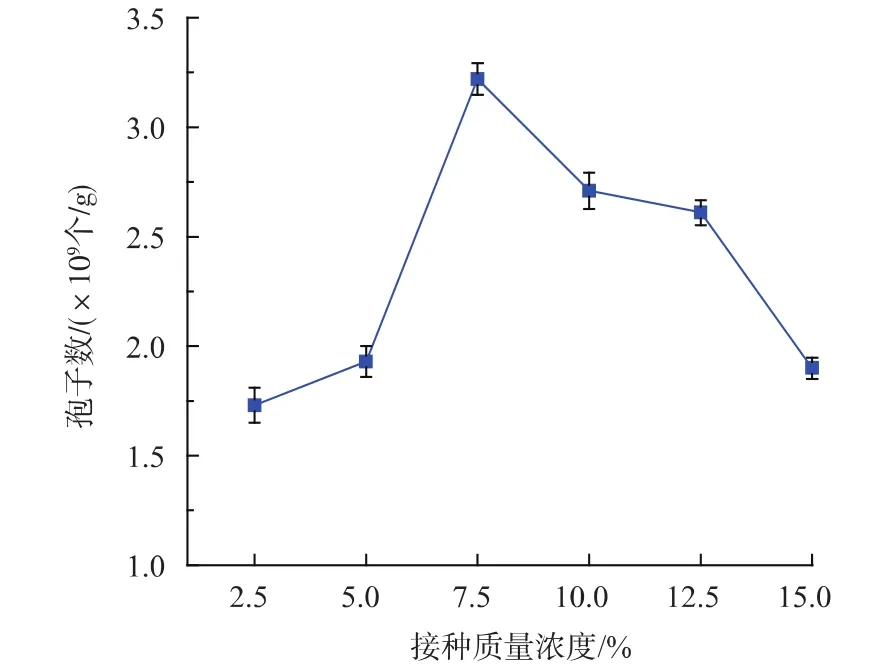
图5 接种质量浓度对孢子产量的影响Fig.5 Influence of inoculation amount on sporulation
2.1.6 初始含水质量分数对孢子产量的影响 固态发酵中培养基含水质量分数过少不利于微生物对营养物质的吸收而限制菌体生长;含水质量分数过多,导致固态培养基不疏松、通风差,影响微生物能量代谢也会抑制微生物生长。如图6所示,初始含水质量分数从35~55%变化时,产孢量随含水质量分数的增加而增加;初始含水质量分数为55%时,产孢量最大,达到3.71×109个/g;含水质量分数高于55%时,产孢量随含水质量分数增加而降低,且75%初始含水质量分数比65%初始含水质量分数的产孢量有大幅的下降。因此,选择55%的初始含水质量分数作为最佳初始含水质量分数。

图6 初始含水质量分数对哈茨木霉固态发酵产孢量的影响Fig.6 Effect of initial moisture on the sporulation of Trichoderma harzianum in solid -state fermentation
2.1.7 碳源种类及其质量分数对孢子产量的影响碳源为微生物生长代谢提供细胞碳架、生命活动所需的能量和代谢产物的碳架,是微生物生长的重要营养之一。由于废菌棒主要成分为纤维素、半纤维素和木质素,碳质量分数较高(50.83%),并且这些成分不易降解,难被微生物利用。因此,本研究采取外加碳源的方法提高孢子产量。本实验对比了葡萄糖、蔗糖、麦芽汁干粉和淀粉对菌株Th-4-B产孢量的影响,结果如图7所示。由图7(a)可知,淀粉做为碳源时最有利于Th-4-B产孢子,但一些研究者认为蔗糖是哈茨木霉的最优碳源[16-17],而本实验中蔗糖作碳源时Th-4-B产孢量并不佳。在实验所选范围内,质量分数3%时产孢量最大,达到4.08×109个/g(图7(b))。因此选择质量分数3%淀粉作为固态发酵的碳源。
2.1.8 氮源种类及其质量分数对孢子产量的影响微生物利用氮源在细胞内合成蛋白质、核酸等细胞成分,以及含氮代谢产物,但废菌棒中氮质量分数(0.83%)无法满足Th-4-B生长需求。所以本实验对比了几种常用氮源对Th-4-B固态发酵产孢量的影响,结果如图8所示。由图8(a)可知,蛋白胨、KNO3、NaNO3做氮源时产孢量最大,达到4.5×109个/g左右。综合考虑氮源价格和产孢量,选择NaNO3作为固态发酵的氮源,且NaNO3质量分数为2%时产孢量最大(图 8(b))。
2.2 固态培养基成分的RSM优化
2.2.1 RSM优化实验 参考单因素实验结果,选择初始含水质量分数、淀粉质量分数和NaNO3质量分数作为RSM的3个因素,其浓度范围如表1,按照表2做实验,结果记录于表2。

图7 不同碳源以及淀粉浓度对哈茨木霉产孢量的影响Fig.7 Effect of different carbon sources and starch concentrations on the sporulation of Trichoderma harzianum

图8 不同氮源和NaNO3浓度对哈茨木霉产孢量的影响Fig.8 Effect of different nitrogen sources and NaNO3concentrations on sporulation of Trichoderma harzianum
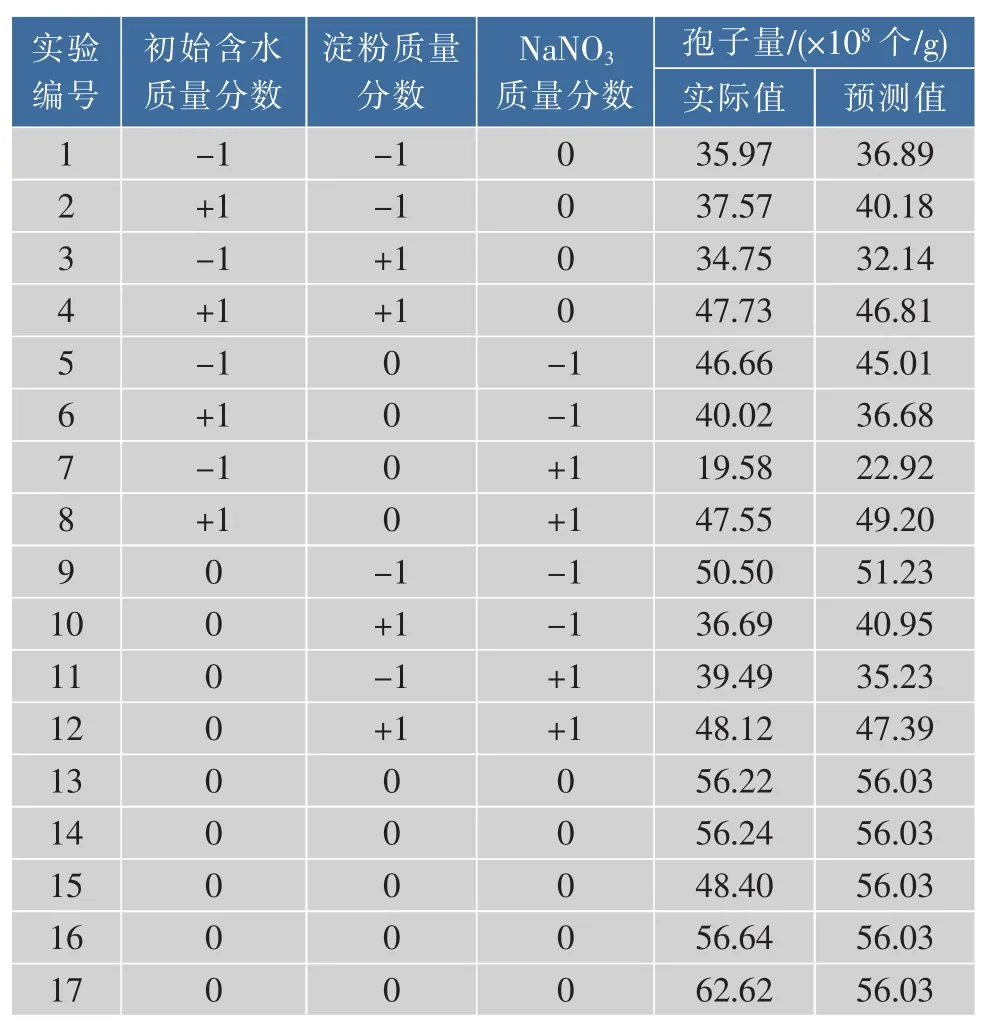
表2 BB实验结果Table 2 Values of BB design
2.2.2 RSM实验结果分析 使用design-expert软件对实验结果进行运算分析,得到Th-4-B孢子产量Y对3个实验因素的二次多项回归方程:Y=-204.99250+10.10991X1+8.91962X2-41.04637X3+0.28453X1X2+0.86525X1X3+5.60875X2X3-0.11132X12-5.88600X22-6.44025X12。回归方差分析结果如表3,模型的p值为0.0096<0.0500,说明该模型显著;失拟性检验p值为0.4620>0.1000说明失拟项不显著,因此,该模型选择正确且可靠,对实验情况拟合较好。A的p值小于0.05,表明初始含水质量分数对孢子产量影响显著,B和C的p值都大于0.05,说明 NaNO3和淀粉影响不显著,它们的影响效果从大到小依次是初始含水质量分数、NaNO3、淀粉。二次项A2、B2、C2的p值皆小于 0.05,达到了显著水平,其中A2达到极显著水平,说明它们的二次相对产孢量影响显著,而初始含水质量分数的二次项对孢子产量的影响达到极显著水平。

表3 回归方程方差分析结果Table 3 ANOVA of the regression equation
2.2.3 响应面及其等高线分析 三维曲面和二维等高线图形象的描述了各种因素的交互影响。等高线图越陡峭交互作用越强,等高线越平滑交互作用越弱。分析发现,初始含水质量分数与NaNO3质量分数交互影响显著,淀粉质量分数和NaNO3质量分数交互作用次之,初始含水质量分数和淀粉质量分数交互作用最弱;抛物面开口向下,二次项系数均为负,因此,方程有最大值(图9)。由响应面图分析可知(图9),在选定的优化质量分数范围内适当提高3个因素水平,可以提高孢子产量。

图9 不同变量对孢子产量相互影响的3D曲面图和二维等高线Fig.9 Response surface and contour showing different variables on the effects of the sporulation
2.2.4 RSM实验的理论值及其验证实验 解二次回归方程,得到最优培养基配方:X1=57.07,X2=3.08,X3=1.99,即初始含水质量分数57.07%,淀粉质量分数3.08%,NaNO3质量分数1.99%,求得最大产孢量为5.65×109个/g。为了验证响应面法优化的最佳培养基配方的可靠性,进行了验证实验,在此条件下,测得固态发酵产孢量为5.91×109个/g,与模拟值相差在5%以内,符合预测,验证了该模型准确性与可行性。
2.3 自制10 L固态发酵罐放大试验
采用实验室自制固态发酵罐进行放大实验,其结构如图10所示。反应器的主体结构为圆柱型封闭结构,容积为10 L。该反应器内部设有温度和湿度传感器,外部配有加热管和空压机,可以对罐体进行加热和降温。

图10 自制固态发酵反应器Fig.10 Self-made bioreactor in the experiments
使用10 L自制固态发酵罐对哈茨木霉发酵废菌棒进行放大实验(装料量1.5 kg),如图11所示,通风条件下发酵144 h孢子产量达8.20×109个/g,比未通风时发酵产量 (5.29×109个/g)提高了55.01%,说明通风可以显著提高哈茨木霉固态发酵的孢子产量,这也能从装料量过多和初始含水质量分数过大孢子产量大幅降低的结果中间接体现出来(图3和图6),并且通风使菌体生长时间缩短了约12 h。同时,这一产量比类似报道高出一倍以上[16],也是类似报道最高产量。这一结果也验证了摇瓶水平进行放大实验的可行性。

图11 固态发酵罐发酵孢子生长曲线Fig.11 Growth curve of sporulation in solid-state bioreactor
3 结 语
本实验研究如何利用废菌棒进行固态发酵,高产哈茨木霉孢子。以产孢量为指标,通过单因素实验和响应面法优化,再通过固态发酵罐的通风发酵进行放大实验,获得废菌棒固态发酵产哈茨木霉孢子最佳培养条件是:接种质量浓度7.5 g/dL,装料量20 g,pH自然,培养温度28℃,发酵周期6 d;最佳培养基组成为:初始含水质量分数57.07%,淀粉3.08%,NaNO31.99%。固态发酵罐放大实验,通风条件下显著提高孢子产量,达到8.20×109个/g。本研究为废菌棒的回收再利用和食用菌的清洁生产提供了一种新方法,也为哈茨木霉生防剂的生产提供了新指导。

