食品及其生产环境和包装材料中分离霉菌的形态与分子鉴定
王双霞, 唐晓阳, 范艳红, 丁艳杰, 谭洋岚,
胡东强3, 田 野3, 赵 勇1, 武爱波*3
(1.上海海洋大学 食品学院,上海 201306;2.康师傅控股中央研究所食品安全研究中心检验科学部,上海201103;3.中国科学院上海生命科学研究院 营养科学研究所,上海200031)
霉菌是各类食品中常见的污染微生物,自然栖息于食品产地环境中的不同土壤、水体、大气和植物基质上,种类繁多,代谢功能各异。真菌毒素(Mycotoxin)是一些丝状真菌在适宜条件下产生的具有生物毒性的次级代谢产物,这些产毒真菌主要是霉菌,如青霉(Penicilliumsp.)、曲霉(Aspergillussp.)、链格胞霉菌(Alternariasp.)等。 霉菌污染食品后,会给企业造成一定的经济损失[1],而且在生长过程中会产生多种霉菌毒素等次级代谢产物,并以毒素原型、衍生型与隐蔽型[2]等不同形式存在于食物链中,带来严重安全隐患[3]。大多数霉菌对人类无危害,但少数霉菌如黄曲霉、寄生曲霉及其产生的黄曲霉毒素、脱氧雪服镰刀菌烯醇、玉米赤霉烯酮、赭曲霉毒素A等对人类健康有较大威胁,已有相应国家食品安全标准(GB)对食品中这些真菌毒素的限量进行了严格规定[4]。因此,将这些污染霉菌菌株鉴定到种对食品中污染霉菌的溯源、预警与安全控制意义重大。
由于霉菌种类多,形态多样,形态学鉴定特征有时较难形成,目前通常采用形态学和分子生物学技术共同鉴定、相互验证的方法对霉菌进行鉴定[5]。目前霉菌形态学鉴定采用的方法为:将分离纯化得到的菌株接种到马铃薯琼脂培养基(Potato Dextrose Agar,PDA)上25℃黑暗培养3—5 d,观察菌落形态、生长速度、颜色、大小等,并结合菌丝的形态和分身孢子的有无及其特点等特征进行属的鉴定[6,7];分子鉴定通常采用真菌的通用型引物Internal Transcribed Spacer(ITS)[8],对其保守区序列进行特异性PCR,并通过对产物的测序精确鉴定出霉菌的种类,部分霉菌采用特异性引物Elongation factor 1-α(EF-1α)[9]对部分霉菌进行水平鉴定、验证。
本研究作者对食品包装材料、食品的生产环境和部分食品中污染的霉菌菌株进行分离纯化,获得单孢菌株后,进行形态与分子鉴定,明确食品中主要污染霉菌种类,对食品中霉菌安全控制和污染源头的确定提供基础数据参考。
1 材料与方法
1.1 菌株来源
本实验的55株菌株由康师傅控股中央研究所食品安全研究中心检验科学部分离提供。其中食品生产环境中分离的菌株32株,编号分别为:A 3、A 15、A 19、A 22、B 5-1、B 5-2、B 13-1、B 13-2、C 21-1、C 21-2、E 4-1、E 4-2、E 7-1、E 7-2、E 8-1、E 8-2、E 9-1、E 9-2、E 10、E 11、E 12-1、E 12-2、E 14-1、E 14-2、F 1-1、F 1-2、F 2、F 16、G 17、G 18、G 20、H 6;包装材料中分离菌株11株,编号分别为:A 25、D 41、G 28、H 27、I 26、I 43、J 29、J 42-1、J 42-2、K 23、K 24;食品中分离菌株 12株,编号分别为:A 30、A 33、A 36、A 38、A 39、B 34、B 35-1、B 35-2、C 37-1、C 37-2、D 31、F 32。
1.2 培养基
马铃薯琼脂培养基(PDA):马铃薯200 g,葡萄糖20 g,琼脂15 g,加去离子水定容至1000 mL,121℃灭菌20 min。
马铃薯培养基(PDB):马铃薯 200 g,葡萄糖20 g,加去离子水定容至1000 mL,121℃灭菌20 min。
水琼脂培养基(WA):琼脂粉20 g,去离子水1000 mL,121℃灭菌 20 min。
1.3 霉菌的形态学鉴定
把实验的霉菌接种到PDA培养基上活化,生化培养箱种25℃黑暗培养4~6 d,观察霉菌菌丝的生长速度,菌落基地的颜色,有无分生孢子的形成。借助显微镜观察霉菌的菌丝及孢子形态。
1.4 霉菌的分子鉴定
在形态学鉴定的基础上,采用真菌rDNA的ITS和EF-1α的通用引物进行PCR扩增。具体步骤如下。
1.4.1 霉菌基因组DNA的提取 霉菌的培养和参照滕巍等[10-11]的方法,收集培养3~5 d的新鲜菌丝在液氮中研磨,参照Kumar等[12]的方法,使用改良的CTAB法提取实验霉菌的基因组,电泳检测合格后置于-20℃保存。
1.4.2 聚合酶链式反应(PCR) 采用真菌ITS通用引物 ITS1和ITS4和 EF-1α(表 1)进行 PCR扩增反应,引物为上海生工合成。
反应体系为:2×TransDirectTMPCR SuperMix(+dye)25 μL, 引物对 3 μL,DNA 模板 5~8 μL 补ddH2O至 50 μL。PCR反应条件:95℃预变性5 min,95℃变性 30 s,55 ℃退火 30 s,72℃延伸45 s,共35个循环,最后72℃延伸7 min。
1.4.3 PCR产物纯化与测序 霉菌PCR扩增产物经1 g/dL琼脂糖凝胶电泳,切取胶块,使用AxyPrep DNA凝胶回收试剂盒纯化回收扩增片段,对回收后的PCR产物重新进行电泳检测后送上海生工测序。
1.4.4 测序结果的比对分析 将菌株的测序结果输入National Center for Biotechnology Information(NCBI http://www.ncbi.nlm.nih.gov/)核酸序列数据库中进行 Basic Local Alignment Search Tool(BLAST)分析,依据比对结果判断菌株所属种,一般认为提交序列与数据库中参照序列的同源性大于或等于99%,则可视二者为同一种[13]。借助Clustx软件对不同菌株的同源序列进行比对,分析其种属差异。

表1 PCR所用的引物Table 1 Primers used in PCR
1.4.5 系统发育树的构建 代表菌种的ITS基因序列,使用MEGA6.0软件构系统发育树。系统发育树采用Neighbor-Joining[14]方法进行构建,运算1000次,利用p-distance模型计算进化距离,通过bootstrap对运算结果进行评价[15],构建霉菌的发育树。
2 结果与讨论
2.1 菌株形态学鉴定结果
用霉菌形态学鉴定的培养方法对菌株进行培养并观察,并按照Deacon[5]中描述的霉菌特征进行鉴定。发现其中大部分菌株为曲霉(Aspergillusp.)、青霉(Penicilliumsp.)、镰刀菌属(Fusariumsp.)、枝孢菌属 (Cladosporiumsp.)、 链格孢属(Alternariasp.)。从分离的菌株中对每一种霉菌分别取出一株典型菌株进行形态学观察,为霉菌的鉴定提供参考。
2.2 主要霉菌的形态特征
黑曲霉在PDA上25℃黑暗培养4 d,菌落直径为21~39 mm;生长速度中等;菌落初生时为白色,后变为黄色最后为黑色,背面无色或为深黄色。菌落厚绒毛状,成熟时黑色;有分生孢子梗;分生孢子顶端不膨大,分生孢子为黑色、球状,孢子直径2.5~4.0 μm。
顶青霉在PDA培养基上25℃黑暗培养4 d,菌落直径为17~23 mm,菌落生长速度中等;菌落凸起,紧实,初为白色,后期为青色或青灰色,背面无色或浅黄色;气生菌丝上产生分生孢子梗,分生孢子梗光滑,帚状枝形状不一,分生孢子椭圆形至球形,分生孢子端膨大,这是微生物形态学上区分青霉和曲霉的重要依据[16]。
串珠镰刀菌在PDA培养基上25℃黑暗培养4 d,菌落直径为40~60 mm,菌落生长速度中等。菌落初为白色,后期紫色或紫红色,背面为红色。分生孢子梗单生或简单分枝。在PDA培养基上可产生大量卵形至棒状的小型分生孢子。小型分生孢子0—1隔,绝大多数为0隔。气生菌丝表面的小型分生孢子串生成较长的分生孢子链或呈假头状生。大型分生孢子镰刀型,壁薄,3—5隔,分隔明显,形态较直,顶细胞为锥形,基细胞为足形。不产生厚垣孢子。
枝孢菌在PDA培养基上25℃黑暗培养4 d,菌落直径为10~13 mm,菌落生长速度缓慢。菌落凸起,紧实,中央为灰绿色,边缘白色,背面为灰褐色。分生孢子梗侧生,平滑无分支,产孢后不膨大;分生孢子顶生或侧生,椭圆形、圆柱形或球形,淡褐色。
链格胞菌在PDA培养基上25℃黑暗培养4 d,菌落直径为19~25 mm,菌落生长速度中等。菌落为黑色或墨绿色,菌丝茂盛,厚绒状,边缘整齐。有分生孢子梗,散生,不分枝,直立或弯曲,分隔,暗色。分生孢子为黑色,单生,近椭圆形,孢子底部钝圆,顶部狭隘。
2.3 菌株的分子鉴定结果
55株霉菌的ITS区PCR产物经凝胶电泳分离,长度都在500~700 bp。如图2所示。将测序结果进行BLAST分析,构建系统发育树,并结合形态学结果鉴定菌株。

图1 菌株在PDA上培养4 d的培养特征和显微的形态Fig.1 Cultural characteristics and microscopic shape of molds cultured post 4 d on PDA media
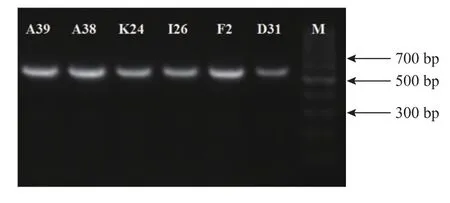
图2 霉菌PCR扩增产物凝胶电泳检测Fig.2 PCR amplification result gel electrophoresis of several typical molds
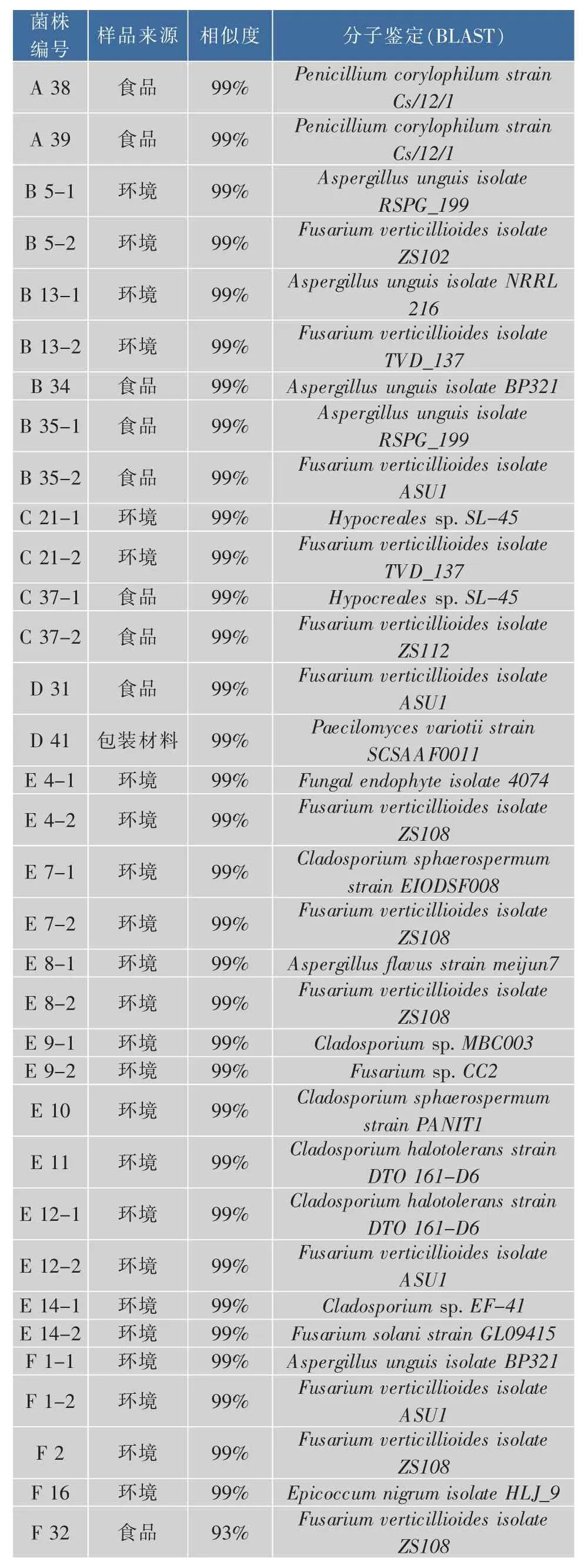
形态学和分子生物学结果表明:食品中分离的菌株 12 株,表明 12 株菌中 A 30、A 33、A 36、A 38、A 39 属于顶青霉(Penicillium corylophilum),B 34、B 35-1 属于爪甲曲霉 (Aspergillus unguis),B 35-2、C 37-2、D 31、F 32 属 于 串 珠 镰 刀 菌 (Fusarium verticillioides),C 37-1 属于肉座菌(Hypocrealessp.)。
具体来讲,从包装材料中分离的菌株种类比食品中复杂,从表2可以看出,11株真菌包括6株曲霉(Aspergillus)、2 株链格胞菌(Alternaria)、1 株青霉(Penicillium)、1 株拟青霉(Paecilomyces)、1 株镰刀菌 (Fusarium)。6株曲霉中有 3株黑曲霉(Aspergillus niger), 分别为 I26、I43、K24,2 株聚多曲霉(Aspergillus sydowii),为 J29、J42-1,1 株溜曲霉 (Aspergillus tamarii)为K23;2株极细链格胞菌(Alternaria tenuissima) 为 G28 和 H27;A25 为绳状青霉 (Penicillium funiculosum);D41为多变拟青霉(Paecilomyces variotii);J42-2 为 串 珠 镰 刀 菌(Fusarium verticillioides)。
由表2可以看出,食品生产环境中分离的菌株种类最为复杂,32株真菌中有12株镰刀菌(Fusariumsp.), 其中 10 株串珠镰刀菌(Fusarium verticillioides),2 株茄腐镰刀菌(Fusarium solani);7株曲霉 (Aspergillussp.),其中 3株爪甲曲霉(Aspergillusunguis),1 株 烟 曲 霉 (Aspergillus fumigatus),2 株黄曲霉 (Aspergillus flavus),1 株杂色曲霉(Aspergillus versicolor);3 株青霉(Penicilliumsp.);7 株枝孢菌(Cladosporiumsp.),其中有 3 株球孢枝孢菌(Cladosporium sphaerospermum),4 株草木枝孢菌 (Cladosporium halotolerans);2株链格胞菌(Alternariasp.);1 株肉座菌(Hypocrealessp.)。

表2 霉菌菌株的16SDNA序列结果分析Table 2 16S rDNA sequences analysis of molds strains
续表2

续表2

图3 ITS区rDNA构建的系统发育树Fig.3 System development tree constituted on the base of rDNA in ITS region
3 结 语
依靠形态学的方法对真菌进行分类,所需时间较长,而且实验结果不稳定,因为实验过程中需要实时对菌落的生长速度、颜色、孢子和菌落的形态特征进行观察,并且真菌的形态特征复杂,随着培养条件改变而变化,一般仅运用形态学很难将真菌鉴定到种[17]。利用分子生物学ITS区rDNA序列分析法具有灵敏度高、快速、简便等优点,但在真菌的鉴定中对于一些近缘的种无法区分[18-19]。因此,本研究采用形态学和分子生物学相结合的的方法鉴定所采集真菌。
为了明确食品生产环境、包装材料、部分食品中污染霉菌的种类,本实验通过霉菌在PDA上25℃黑暗培养4 d菌落形态特征、微观形态学和分子生物学的方法对实验霉菌进行了鉴定,初步得出了食品加工过程中可能感染的霉菌的种类,主要有顶青霉、拟青霉、黑曲霉、爪甲曲霉、串珠镰刀菌、草木枝孢菌等。其中食品中的霉菌菌株种类单一,青霉属均为顶青霉,镰刀菌属都为串珠镰刀菌,曲霉属都是爪甲曲霉;包装材料中的霉菌种类比食品中复杂,菌株以曲霉为主,还包括青霉、拟青霉、串珠镰刀菌等;环境中的菌株种类比较繁多,其中镰刀菌占得比例最大。
本实验55株被分离的菌株中有17株镰刀菌(Fusarium), 占总菌株的 30.91%;15 株曲霉(Aspergillus), 占总菌株的 27.27%;9 株青霉(Penicillium),占总菌株的 16.36%;7株枝孢菌(Cladosporium),占总菌株的12.73%;4株链格胞菌(Alternaria), 占总菌株的 7.27%;2 株肉座菌(Hypocreales), 占总菌株的 3.64%;1株拟青霉(Paecilomyces),占总菌株的1.82%。镰刀菌、青霉、曲霉在食品生产环境、包装材料和食品中都存在,为优势菌株。本实验的结果显示在食品加工过程中,食品的生产环境中霉菌种类多且杂,应当重点预防。
菌株的鉴定为后续霉菌污染的安全控制和菌株溯源提供了有价值的参考信息。霉菌在生长过程中会产生多种霉菌毒素等次级代谢产物,存在一定安全隐患。例如,串珠镰刀菌在一定条件下会产伏马毒素,杂色曲霉在特定情况下会产生杂色曲霉素。后续我们将对这些霉菌在不同生物基质培养条件下产生真菌毒素的类型和水平进行深入研究,以对食品及产地环境中霉菌毒素污染的防控提供更有价值的参考。

