急性颈内动脉系统脑梗死患者颈内动脉角与动脉粥样硬化斑块形态关系的研究
王琳,王晶,申园,龚浠平,刘艳芳
颈动脉粥样硬化是脑梗死的主要病因[1]。研究者认为,颈动脉分叉部动脉粥样硬化斑块高发可能与其位置表浅、特殊的几何学形态及复杂的血流动力学等因素有关[2]。近年来,使用高分辨率磁共振成像(high resolution MRI,HR-MRI)技术分析颈动脉几何学特征逐渐引起人们的关注。HR-MRI技术能够清晰地分辨动脉管腔结构,定量测量动脉管腔、管壁及总血管面积,准确描述动脉粥样硬化斑块的形态学特征[3-4]。3D时间飞跃法(time-of-flight,TOF)MRA能够显示颈动脉立体结构,进而准确地测量颈动脉几何学指标如分叉角、非平面角等信息。本研究利用HR-MRI技术测量急性期颈内动脉(internal carotid artery,ICA)系统脑梗死患者颈内动脉夹角(internal carotid artery angle,ICAA)和颈外动脉夹角(external carotid artery angle,ECAA),探讨颈动脉分叉处几何学指标与动脉粥样硬化斑块的关系。
1 研究对象与方法
入组标准:①年龄18~80岁;②首次脑梗死;③符合ICA系统脑梗死诊断;④卒中发生的时间距就诊在(7±3)d内;⑤颈部血管超声显示颈动脉内膜中层厚度(inteima-media thickness,IMT)≥1.5 mm;⑥可配合完成MRI检查;⑦患者(或监护人、直系亲属)签署知情同意书。
排除标准:①可疑心源性栓塞或病因不明者;②患者有溶栓或其他急诊介入治疗的指征;③无症状性脑梗死,伴有局灶或全脑症状的非脑血管病或脑血管病诊断不明确者;④继发于脑出血、外伤、肿瘤、凝血机制异常、动脉瘤或动静脉畸形的脑梗死;⑤不能进行MRI检查者,如有幽闭恐惧症、心脏瓣膜置换术或者安置金属材质的义齿;⑥不愿签署知情同意或研究者认为不适合该项临床研究者。
本研究经首都医科大学附属北京天坛医院伦理委员会批准。
1.2 磁共振成像检查和图像分析 在患者发病(7±3)d内完成颈动脉HR-MRI扫描,HRMRI检查采用3.0 T SIMENS扫描仪(Trio-Tim,SIEMENS,Erlangen,Germany),最大切换率200 T/(m·ms),最大梯度强度45 mT/m。利用颈动脉专用4通道表面线圈(Machnet BV,Eelde,Netherlands)。扫描中心定于颈动脉分叉,垂直于血管行轴位扫描。扫描序列包括T1WI、T2WI、质子密度加权像(proton density weighted image,PDWI)、3D TOF MRA。影像学资料收集在专门设计的CASCADE软件上由2名有经验的放射科医师(均有3年以上颈动脉图像分析经验)在不知道患者颈动脉病变的情况下对图像共同进行测量、分析,结果不一致时会商确定[5]。
图像评估:根据血管壁信噪比(signal-tonoise ratio,SNR)及其轮廓清晰程度,颈动脉MRI图像质量(image quality,IQ)评分从l分到5分共分为5级(l=差,5=很好)[6]。血管图像质量≤2分,则将该图像从本研究中剔除。
ICAA测量:使用计算机图像后处理方法进行在体三维颈动脉分叉重组和血管各项几何学属性指标测量,并计算ICCA,ECAA,ICA非平面角,颈外动脉(external carotid artery,ECA)非平面角[7-8]。从三维颈动脉分叉正面观看,ICA直线与ECA直线的夹角为分叉角,ICA角为ICA直线与颈总动脉(common carotid artery,CCA)直线的反向延长线的夹角,ECA角为ECA直线与CCA直线的反向延长线的夹角;从颈动脉分叉侧面观看,ICA非平面角为ICA直线与CCA直线的反向延长线的夹角,ECA非平面角为ECA直线与CCA直线的反向延长线的夹角。依据每支血管的ICAA将所有入组的ICA分为ICAA≥35°与ICAA<35°两组进行分析,并对两组血管对应的颈动脉粥样硬化斑块发生率和斑块成分进行比较分析。
动脉粥样硬化斑块成分的分析:首先勾画出管壁和管腔的轮廓,根据既往基于多对比HR-MRI确定动脉粥样硬化斑块成分的标准,确定不同动脉粥样硬化斑块成分:①富含脂质坏死核心(lipid-rich necrotic core,LRNC);②斑块内出血(intraplaque hemorrhage,IPH);③钙化;④疏松间质;⑤致密纤维组织[9-10]。在匹配的4种序列图像上(3D TOF、T1WI、T2WI、PDWI)分别勾画。最后根据AHA分级法,确定易损斑块[10-11]。如一支血管同时有稳定和易损斑块存在,则将该支血管按照有易损斑块纳入统计。
动脉粥样硬化斑块测量指标包括:①最大管壁面积(maximum wall thickness,MaxWT);②每一层面上不同斑块成分(LRNC、钙化、IPH)的面积,并计算在该层面上每一动脉粥样硬化斑块成分占总管壁面积的百分比,最终得出每一个颈动脉各动脉粥样硬化斑块成分占总管壁面积百分比的最大值;③如某一颈动脉有ICA或CCA闭塞的情况,则将该颈动脉排除。将动脉粥样硬化斑块各种成分特征的参数分为定性参数和定量参数,定性成分参数包括是否存在LRNC、纤维帽状态、IPH、血栓或钙化等各个成分;定量成分包括LRNC、钙化、IPH占总管壁面积的最大百分比。
1.4 统计学分析 统计学采用SPSS 23.0(SPSS Inc.,Chicago,USA)统计软件。根据数据特征,符合正态分布的计量资料用表示,不符合正态分布的用中位数及四分位数表示;计数资料用率表示。两组间比较,计数资料用卡方检验或精确概率法,正态分布的计量数据使用t检验,不符合正态分布的采用秩和检验。采用配对t检验比较左右两侧颈动脉的差异。分别以左右侧颈动脉粥样硬化斑块成分总量为因变量,以患者年龄、性别、高血压史、糖尿病史、吸烟、入院时低密度脂蛋白胆固醇水平及各颈动脉角参数等作为因变量,进行多元线性回归分析,判断颈动脉粥样硬化斑块成分的独立影响因素。当进行连续分析时,采用Bonferroni校正。P<0.05为差异具有统计学意义。
先生陶醉其中的状态,甚至让学生产生了“疑心这是极好的文章”的心理,这样的教学就成功了一半了。因为他触发了学生的阅读兴趣,而兴趣则会引领学生自己走进阅读的世界。
2 结果
2.1 一般资料 在86例患者的172支血管图像中,有2支的图像因IQ=2分被排除,另外,有8支血管的图像因存在血管闭塞、分叉处较短、分叉部显示欠清晰等原因,不能准确测量分叉角度而被排除,最终共有162支血管纳入统计分析。
参与分析的162支血管图像中,左侧ICCA平均值为(34.89±12.15)°,右侧ICCA平均值为(33.25±11.19)°,两侧ICCA平均值为(34.07±11.67)°。ICCA≥35°组78支,ICCA<35°组84支。
2.2 颈内动脉夹角与颈动脉粥样硬化斑块的关系 研究所纳入的162支血管共检出119支血管有颈动脉粥样硬化斑块,ICAA≥35°组动脉粥样硬化斑块检出血管数[72支(92.3%)vs47支(56.0%),P<0.01]及易损斑块检出率[34支(43.6%)vs13支(15.5%),P=0.03)]均高于ICAA<35°组。
不同ICA角度组,颈动脉粥样硬化斑块各成分的检出率有统计学差异,ICAA≥35°组LRNC及IPH的检出率高,差异有统计学意义(表1)。
2.3 左右侧颈动脉参数比较结果 对左右两侧(各81支)颈动脉粥样硬化斑块成分及ICAA、ECAA、ICA非平面角和ECA非平面角进行比较,结果显示,仅ECA非平面角右侧大于左侧,差异具有统计学意义(P=0.02),其余各颈动脉角及动脉粥样硬化斑块成分左右两侧差异均无统计学意义(表2)。
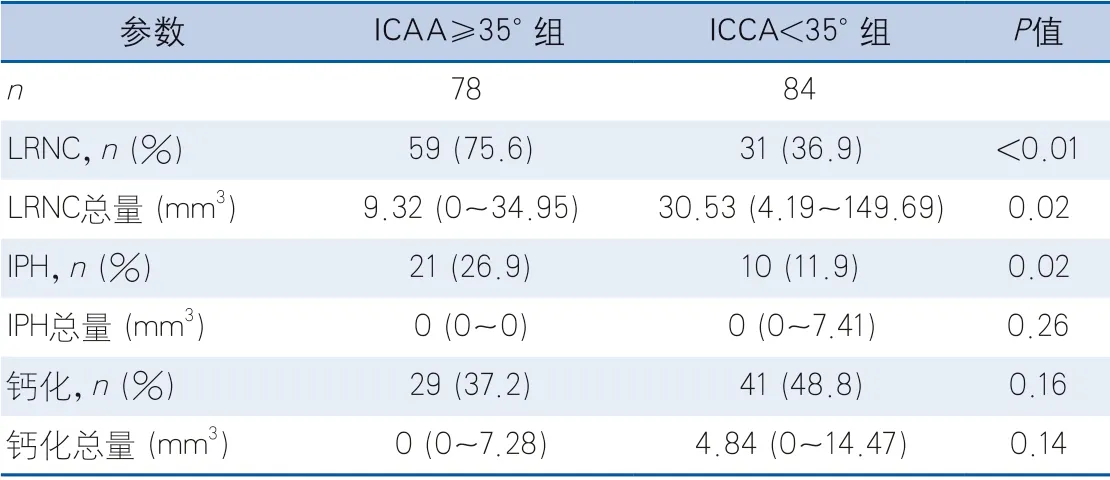
表1 不同颈内动脉角组颈动脉粥样硬化斑块成分的差异
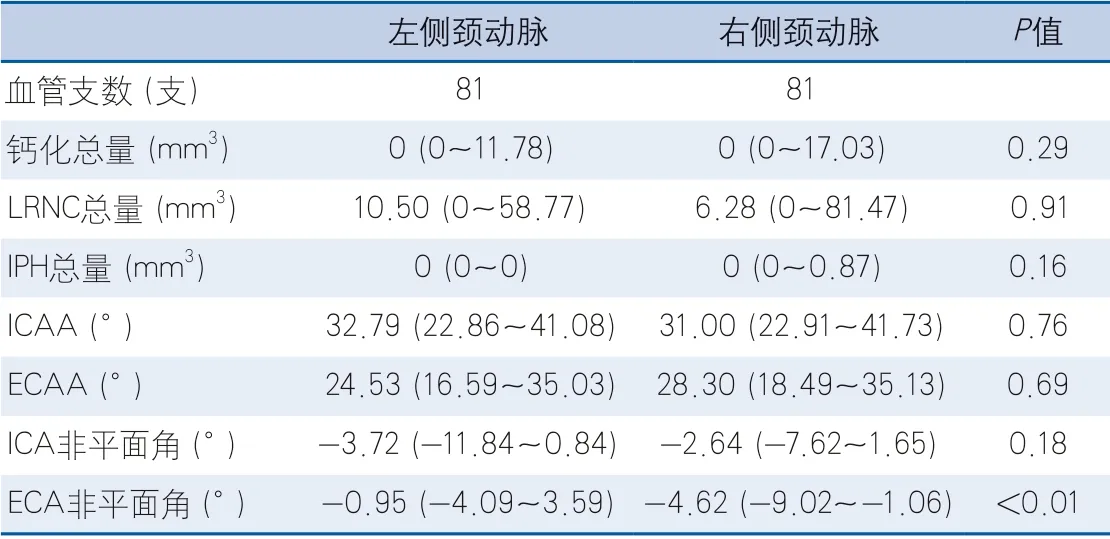
表2 左右两侧颈动脉粥样硬化斑块成分及颈动脉角差异
2.4 多因素分析结果 多元线性回归分析结果显示,年龄是左侧颈动脉粥样硬化斑块钙化成分总量(B0.35,95%CI0.21~1.65,P=0.01)及右侧颈动脉粥样硬化斑块IPH成分总量(B0.34,95%CI0.30~2.32,P=0.01)的危险因素,ICAA非平面角(B0.37,95%CI1.23~7.33,P=0.01)是左侧颈动脉粥样硬化斑块LRNC成分总量的危险因素,ECA非平面角(B0.33,95%CI0.20~2.07,P=0.02)是右侧颈动脉粥样硬化斑块钙化成分总量的危险因素。
3 讨论
本研究结果表明,ICAA≥35°组动脉粥样硬化斑块及易损斑块检出率均较ICAA<35°组患者高,差异均有统计学意义。ICAA≥35°组动脉粥样硬化斑块中LRNC及IPH的检出率高。将颈动脉角与各动脉粥样硬化斑块成分进行回归分析显示,年龄是左侧颈动脉粥样硬化斑块钙化成分总量及右侧颈动脉粥样硬化斑块IPH成分总量的危险因素,ICAA非平面角是左侧颈动脉粥样硬化斑块LRNC成分总量的危险因素,ECA非平面角是右侧颈动脉粥样硬化斑块钙化成分总量的危险因素。
局部血流动力学因素在动脉粥样硬化的发生、发展中扮演着重要的角色,由于颈动脉分叉处的血液分流、停滞等作用,脂质留驻时间的增加和剪切应力改变使该部位易形成粥样硬化斑块[12-14]。另外有研究表明颈动脉分叉的解剖形态与局部剪切应力相关,还与分叉处血流速率和血流的分配有关[15-17]。既往研究表明颈内、外动脉流量的分配比例对局部血流动力学影响较大,颈动脉分叉角度增大时,分叉处血流紊乱更加明显,低血流速度区域和低血管壁剪切应力区域面积增大,动脉粥样硬化形成的风险提高[7,18]。本研究结果显示,随ICAA增大,动脉粥样硬化斑块检出率呈上升趋势。
本研究在86例患者中检出119支有动脉粥样硬化斑块的颈动脉,ICAA≥35°组患者动脉粥样硬化斑块中LRNC的检出率高,ICAA<35°组患者钙化的检出率较高,ICAA<35°组LRNC总量高于ICAA≥35°组。因为血流动力学改变是颈动脉粥样硬化病变的一项关键因素,血管内局部血流动力学状态的异常可以通过各种机制直接或间接引起动脉壁组织结构及成分的变化[5,19-20]。同样可以推断,ICAA大小不同,所导致异常的血流动力学状态也不尽相同,所以才使得动脉粥样硬化斑块各定性成分参数之间有差别。有颈动脉几何学形态与颈动脉管腔狭窄程度关系的研究表明,颈动脉分叉角与管腔狭窄程度并无相关性,间接提示颈动脉分叉角与斑块体积并无明确相关性,与本研究结果一致。本研究结果还表明,ICAA非平面角是左侧颈动脉粥样硬化斑块LRNC成分总量的危险因素,ECA非平面角是右侧颈动脉粥样硬化斑块钙化成分总量的危险因素。目前研究多集中在颈动脉角与动脉硬化的关系,很少有研究关注非平面角,本研究也为今后的颈动脉夹角的几何形态学研究提供了参考。
颈动脉粥样硬化作为全身动脉粥样硬化的一部分,其危险因素与全身动脉粥样硬化的危险因素相同。本研究主要观察ICAA这一因素是否与颈动脉动脉粥样硬化的发生有相关性。结果表明,ICAA并非是颈动脉粥样硬化的独立危险因素,它与其他因素一起共同作用导致了动脉粥样硬化的发生。
本研究入选患者的病情相对稳定,且样本量较小,因此可能存在一定的选择偏倚;另外,本研究是一项横断面的调查,没有对不同颈动脉分叉处的角度与颈动脉粥样硬化斑块的进展、之后卒中复发风险的关系进行探讨,在之后的研究中,课题组将进行更多样本量、更长时间的调查,以期进一步明确颈动脉分叉处几何学形态对动脉管壁的影响及进一步对卒中的发生、预后的影响。
【点睛】本研究通过血管影像学对颈动脉分叉处几何学形态与颈动脉粥样硬化斑块的发生和特点的关系进行了分析,结果显示颈内动脉角大的患者更发生颈动脉粥样硬化斑块,但斑块的不同成分的含量和斑块的易损性不单纯与颈内动脉角有关。

