稀酸提取羊栖菜多糖的结构及其抗氧化特性研究
吴娟 欧志荣 李昭蓉 赵谋明
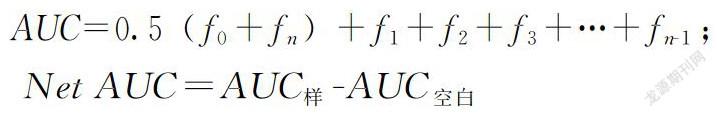


摘 要:【目的】詳细探讨了不同醇沉条件制备的羊栖菜多糖组分的单糖组成、平均分子量、结构及其抗氧化特性。【方法】通过稀酸提取法制备羊栖菜提取液,用不同浓度的乙醇沉淀制备羊栖菜多糖组分。利用柱前衍生-反相高效液相色谱、凝胶渗透色谱与多角度激光光散射联用、傅里叶变换红外光谱、紫外分光光度计、扫描电子显微镜以及哈克MARS III型流变仪等技术手段,分析了多糖组分的基本成分、单糖组成、平均分子量、有机官能团、空间构象、表观形貌及流变学特性。此外,进一步研究了各多糖组分的氧自由基吸收能力以及DPPH·和ABTS·的清除能力。【结果】SFP-50和SFP-70具有高的总糖、硫酸基及糖醛酸含量;5种多糖组分均由甘露糖、葡萄糖、葡萄糖醛酸、半乳糖、阿拉伯糖和岩藻糖组成,但占比均不相同,其中岩藻糖占比都最高,约为50%;SFP-40、SFP-50、SFP-60、SFP-70和SFP-80的平均分子量分别为97.63、90.51、97.19、81.52及90.93 kDa;流变试验表明羊栖菜多糖溶液属于非牛顿流体,表现为固体弹性性质;扫描电镜图像揭示羊栖菜多糖组分表面呈凹凸不平、疏松多孔的褶皱结构;抗氧化特性分析结果表明羊栖菜多糖组分具有一定的氧自由基吸收能力以及DPPH·和ABTS·的清除能力,且不同体积分数乙醇醇沉会影响其抗氧化特性。【结论】不同体积分数乙醇醇沉会影响羊栖菜多糖的理化性质、单糖组成和平均分子量,但不改变其构象、微观结构及流变学性质,对其抗氧化活性也有一定的影响。
关键词:羊栖菜;多糖;结构表征;抗氧化活性
中图分类号:R 284.2 文献标识码:A文章编号:1008-0384(2019)07-842-10
Abstract: 【Objective】The polysaccharides extracted from Sargassum fusiforme with different ethanol volume were studied. 【Method】 Polysaccharides were extracted from S.fusiforme using an acid solution, then precipitated with different volume fractions of ethanol. The resulting extract was analyzed for its physicochemical properties, monosaccharide composition, molecular weight, structural characteristics, functional group identification, spatial conformation, apparent morphology, and rheological properties using ultraviolet spectrophotometer, precolumn derivatization-reverse-phase high performance liquid chromatography, GPC-MALLs, FT-IR, SEM, and Huck MARS III rheometer. The antioxidant activity of the extracts, including the oxygen radical absorption capacity and DPPH· and ABTS· scavenging ability, were determined. 【Result】Extracts, SFP-50 and SFP-70, were found to contain higher contents of sugar, sulfate and uronic acid than the other samples. All 5 extracts contained mannose, glucose, glucuronic acid, galactose, arabinose, and fucose but differed in ratio, with fucose being the highest at about 50% of them combined. The molecular weights of SFP-40, SFP-50, SFP-60, SFP-70, and SFP-80 were estimated to be 97.63, 90.51, 97.19, 81.52, and 90.93 kDa, respectively. The Congo red assay showed that the polysaccharides had a triple helical structure. The solution of the extracts was non-Newtonian fluid with elasticity. The scanning electron microscopy images showed an uneven, loose and porous surface. All samples had varying degrees of oxygen radical absorption capacity and DPPH· and ABTS· scavenging ability. 【Conclusion】The volume fraction employed for the ethanol precipitation affected the physicochemical properties, monosaccharide composition, and molecular weight as well as the antioxidant activity, but not the conformation, microstructure or rheological properties, of the polysaccharides obtained.
Key words: Sargassum fusiforme; polysaccharides; structural characterization; antioxidant activity
0 引言
【研究意义】羊栖菜Sargassum fusiforme,别名鹿角尖、海菜牙、羊奶子、海大麦等,主要分布于我国浙江、福建、广东浅海,在山东、辽宁等地也有分布,并在浙江及福建沿海等地大规模栽培,资源丰富,价格低廉,是一种具有广阔开发前景的海洋生物资源[1],其食疗保健功效在《神农本草经》及《本草纲目》中均有记载。羊栖菜的总糖含量大约占羊栖菜干重的40%,其中以褐藻胶(一般指褐藻酸)和褐藻糖胶(又称褐藻多糖硫酸酯、岩藻聚糖硫酸酯或岩藻糖胶)为主的多糖占羊栖菜干重的16%~25%。多糖是羊栖菜的主要化学成分之一,也是羊栖菜药理及保健功效发挥的主要原因。【前人研究进展】研究表明,羊栖菜多糖具有抗炎、抗肿瘤、免疫调节、抗高脂血症和抗氧化活性等多种功能活性[2-6]。季宇彬等[7]研究发现羊栖菜多糖能够显著降低小鼠脂质过氧化物水平以及提高过氧化氢酶及超氧化物歧化酶的酶活。陈金星等[8]利用大肠癌lovo细胞及RKO细胞模型研究了羊栖菜多糖的抗肿瘤活性,结果表明羊栖菜多糖能够显著抑制肿瘤细胞增殖,并有一定的剂量依赖性。王扬等[9]发现羊栖菜多糖对小鼠胸腺T淋巴细胞的增殖具有剂量依赖效应。于竹芹等[10]利用高血糖模型小鼠研究了羊栖菜多糖的降血糖活性,发现羊栖菜可能通过提高小鼠体内抗氧化酶活,降低小鼠体内丙二醛和NO的含量,从而发挥良好的降血糖功效。近年来,国内外对羊栖菜多糖的研究主要集中在提取方法对其结构与生物功能的影响,提取工艺参数(温度、料液比、时间等)的优化,生物活性中心的分离以及利用体外或体内评价方法研究其生物活性。【本研究切入点】已有文献报道了稀酸提取的羊栖菜多糖具有更好的抗氧化特性,但不同体积分数乙醇醇沉的羊栖菜多糖的结构及其抗氧化活性的比较研究未有文献报道。【拟解决的关键问题】探讨不同体积分数的乙醇醇沉制备的羊栖菜多糖的理化性质、分子量分布、单糖组成、结构及其抗氧化活性。为进一步高效开发利用羊栖菜这一海洋生物资源提供理论依据。
1 材料与方法
1.1 材料与试剂
羊栖菜,购于山东青岛。
水溶性VE(Trolox)、1, 1′-二苯基-2-三硝基苯肼(DPPH)、2, 2′-联氮-二(3-乙基-苯并噻唑-6-磺酸)二铵盐(ABTS),购于美国Sigma公司;其他化学试剂均为国产分析纯,购于广州精科化玻仪器公司。
1.2 儀器与设备
微型旋涡混合仪,沪西分析仪器公司;Sorvall ST16R高速冷冻离心机、全波长扫描多功能读数仪,美国Thermo Fisher Scientific公司;752N紫外-可见分光光度计,上海精密科学仪器有限公司;哈克MARS III流变仪,德国Thermo-Scientific公司;冷冻干燥机,美国LABCONCO公司。
1.3 试验方法
1.3.1 羊栖菜多糖的提取
采用稀酸提取法提取羊栖菜多糖,参考Gao等[11]方法,并做了一些修改。将羊栖菜冲洗干净,用无水乙醇浸泡24 h,晾干、粉碎。称取一定量羊栖菜干粉按1∶20的料液比加入去离子水,用1 mol·L-1的盐酸溶液将pH调为2.5,在60℃下提取2 h,期间用搅拌器不断搅拌,过滤取其滤液,滤渣再次提取,过滤,合并两次滤液,离心(10 000 r·min-1,20 min)取上清液,真空旋转蒸发浓缩,浓缩物分别加无水乙醇至乙醇终体积分数为40%、50%、60%、70%及80%,4℃醇沉24 h,离心(10 000 r·min-1,20 min)取沉淀,加水复溶,旋转蒸发除去乙醇,冷冻干燥获得羊栖菜多糖,分别标记为SFP-40、SFP-50、SFP-60、SFP-70和SFP-80。
1.3.2 羊栖菜多糖的理化性质测定
通过苯酚-硫酸法测总糖含量,以岩藻糖为标准[12];通过考马斯亮蓝法测总蛋白含量,以牛血清白蛋白为标准[13];通过咔唑-比色法测糖醛酸含量,以半乳糖醛酸为标准[14];通过硫酸钡比浊法测硫酸基含量,以硫酸钾为标准[15]。
1.3.3 羊栖菜多糖的分子量及单糖组成测定
羊栖菜多糖分子量的测定参考Liu等[16]的方法,并做一些修改。羊栖菜多糖样品配制成1 mg·mL-1溶液,过0.45 μm滤膜后测定。在测量之前,用1 mg·mL-1的牛血清白蛋白溶液对仪器进行校准。色谱柱:Ultrahydragel Guard(40 mm×6 mm)、Ultrahydrogel 2000(300 mm×7.5 mm)和Ultrahydrogel1000(300 mm×7.5 mm)串联;流动相:100 mmol·L-1 NaNO3(含0.05%的Na3N);流速:0.5 mL·min-1;检测器:示差折光检测器、多角度光散射检测器和紫外检测器,柱温:30℃;进样量:50 μL。使用ASTRA软件计算MW。
羊栖菜多糖单糖组成分析方法参考戴军等[17]的方法,并作出一些修改。分别配制1 mg·mL-1的各单糖标品(D-葡萄糖、D-阿拉伯糖、D-葡萄糖醛酸、D-半乳糖、甘露糖、L-岩藻糖和L-鼠李糖),取50 μL标准单糖,加入50 μL 0.6 mol·L-1 NaOH溶液和100 μL 0.5 mol·L-1的PMP甲醇溶液后于70℃衍生化反应100 min;冷却后加100 μL 0.3 mol·L-1的盐酸,加水1.7 mL;再加入2 mL氯仿萃取、离心(2 000 r·min-1,5 min)、去除有机相,反复萃取5次;取水相过0.22 μm微孔滤膜,待HPLC进样分析。配制各单糖浓度均为1 mg·mL-1的混合标品,与标准单糖进行相同的处理,待HPLC进样分析。取1 mL 10 mg·mL-1的羊栖菜多糖溶液,加入1 mL 4 mol·L-1三氟乙酸(TFA),封口,110℃下水解8 h;冷却后加入400 μL甲醇溶解,减压旋蒸至干,重复6次;然后和标准单糖进行同样的处理,待HPLC进样分析。
色谱条件:色谱柱为:AgilentEclipse XDB-C18,4.6×250 mm,5 μm;流动相:0.02 mol·L-1磷酸盐缓冲液(pH 6.7)-乙腈(85∶15,v/v);柱温:30℃;检测波长:250 nm;流速:1 mL·min-1;进样体积:10 μL。
1.3.4 傅里叶变换红外光谱分析(FT-IR)
将多糖样品与KBr粉末研磨均匀,压成1 mm的薄片,用Bruker VERTEX 33光谱仪记录样品的红外吸收值,扫描范围为400~4 000 cm-1。
1.3.5 刚果红试验
参考Chen等[18]方法,并作出一些修改。取1 mg·mL-1的羊栖菜多糖溶液2.0 mL与100 μmol·L-1的刚果红溶液2.0 mL混合,分别加入1 mol·L-1 NaOH溶液使体系中NaOH的最终浓度分别为0、0.05、0.1、0.2、0.3、0.4、0.5 mol·L-1。以1 mg·mL-1的凝胶多糖溶液为阳性对照,室温下放置10 min后,在220~600 nm波长范围内进行全波长扫描,记录不同浓度NaOH条件下的最大吸收波长。以NaOH浓度为横坐标,最大吸收波长为纵坐标作图。
1.3.6 扫描电镜分析
将冷冻干燥后的羊栖菜多糖用离子溅射镀膜法制备电镜样品,置于扫描电镜的样品室中扫描分析,调节加速电压5.0 kV,放大倍数500倍,用随机工作站进行拍摄,观察多糖表面的形态。
1.3.7 流变特性分析
配制10 mg·mL-1的羊栖菜多糖水溶液,采用哈克MARS III型流变仪测定羊栖菜多糖溶液的剪切流变曲线和频率扫描下的振荡流变特性;其中,剪切流变所用转子为C60/1° Ti,振荡流变的转子为P60 Ti L,板间距设定为0.052 mm。剪切流变测定条件为:剪切速率范围为0.1~150 s-1,测定温度25℃。振荡流变条件为:应力 0.01 Pa,测定温度25℃,振荡频率范围为0.01~1.00 Hz。每个样品重复测定3次,结果取平均值。
1.3.8 氧自由基吸收能力(ORAC)测定
ORAC的测定参考林恋竹等[19]的方法,并进行一些修改。用75 mmol·L-1磷酸盐缓冲液(pH 7.4)配制1 mg·mL-1的羊栖菜多糖溶液。将20 μL样品溶液或20 μL Trolox标准品加入96孔板的孔中,空白组加入20 μL PBS,然后加入120 μL 70 nmol·L-1荧光素钠。将混合物混匀并在37℃下预孵育15 min后,迅速向每个孔中加入60 μL 40 mmol·L-1 AAPH。在激发波长485 nm,发射波长520 nm下进行连续测定,每2 min测定1次荧光强度,共读61次。每个样品设置3个复孔。将所测的点连成一条曲线并计算曲线下面积,AUC表示曲线下的面积。公式如下:
AUC=0.5(f0+fn)+f1+f2+f3+…+fn-1;
Net AUC=AUC样-AUC空白
以Trolox浓度为横坐标,Net AUC为纵坐标绘制标准曲线。ORAC值表示为每克样品的平均μmol Trolox当量(TE)。
1.3.9 DPPH·清除率
DPPH·的测定参考Li等[20]的方法,并进行了一些修改。配制浓度分别为0.125、0.25、0.5、1.0、2.0 mg·mL-1的羊栖菜多糖溶液。取2 mL样品溶液(空白组用2 mL无水乙醇)加入到2 mL 0.2 mol·L-1 DPPH·溶液中(溶液用无水乙醇配制)。其中对照组加入2 mL的样品溶液和2 mL的无水乙醇。将混合物在室温下避光保存30 min。无水乙醇为空白,使用可见分光光度计在517 nm下测量其吸光度。DPPH·的清除率表示为:
DPPH·清除率(%)=[1-(A样品-A对照)/A空白]×100
其中A空白指空白组的吸光度;A样品指样品组的吸光度;A对照指样品空白组的吸光度。
1.3.10 ABTS·清除率
ABTS·清除率试验参考赵谋明等[21]的方法,经过一些修改。用5 mL ABTS(7 mmol·L-1)和5 mL过硫酸钾(2.45 mmol·L-1)反应来制备ABTS·溶液。将混合物在室温下避光保存16 h。在测定之前,用50 mmol·L-1磷酸盐缓冲液(pH 7.4)稀释ABTS·溶液,使其在734 nm处的吸光度为0.70±0.02。取50 μL的样品液至酶标板中(空白组取等量的PBS),30℃保温3 min,再迅速加入150 μL ABTS·,摇匀,30℃反应6 min,于734 nm处测量其吸光度。ABTS·清除率的计算公式如下:
ABTS·清除率(%)=[(1-A样品)/A空白]×100
其中A空白指空白組的吸光度,A样品指样品组的吸光度。
1.4 数据统计与分析
试验重复3次,所有数据均用平均值±SD表示。使用SPSS 24.0软件的方差分析方法进行数据显著性分析,P<0.05表示差异显著。
2 结果与分析
2.1 羊栖菜多糖的理化性质分析
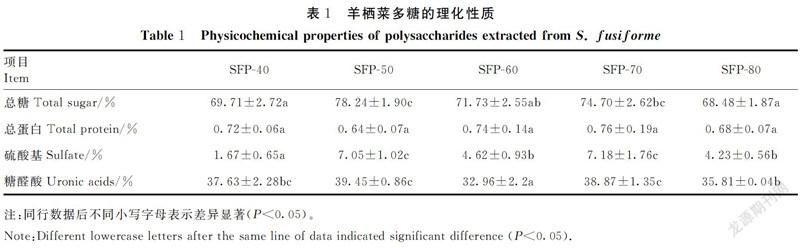
羊栖菜多糖的理化性质测定结果如表1所示,总糖含量分别为SPF-40(69.71±2.72)%、SFP-50(78.24±1.90)%、SFP-60(71.73±2.55)%、SFP-70(74.70±2.62)%和SFP-80(68.48±1.87)%。稀酸提取的羊栖菜多糖的蛋白含量较低,各多糖组分间总蛋白含量无显著性差异(P>0.05)。大量研究报道表明,藻类多糖大多含有硫酸基团,且硫酸基团的含量与其功能活性密切相关[22],5种羊栖菜多糖的硫酸基含量依次为(1.67±0.65)%、(7.05±1.02)%、(4.62±0.93)%、(7.18±1.76)%和(4.23±0.56)%,其中SFP-50及SFP-70的硫酸基团含量显著高于其他3种多糖组分。糖醛酸的测定结果显示,SFP-50及SFP-70的糖醛酸含量显著高于SPF-60和SPF-80。说明醇沉条件对羊栖菜多糖的总糖、硫酸基团及糖醛酸含量影响显著。
2.2 羊栖菜多糖的分子量及单糖组成分析
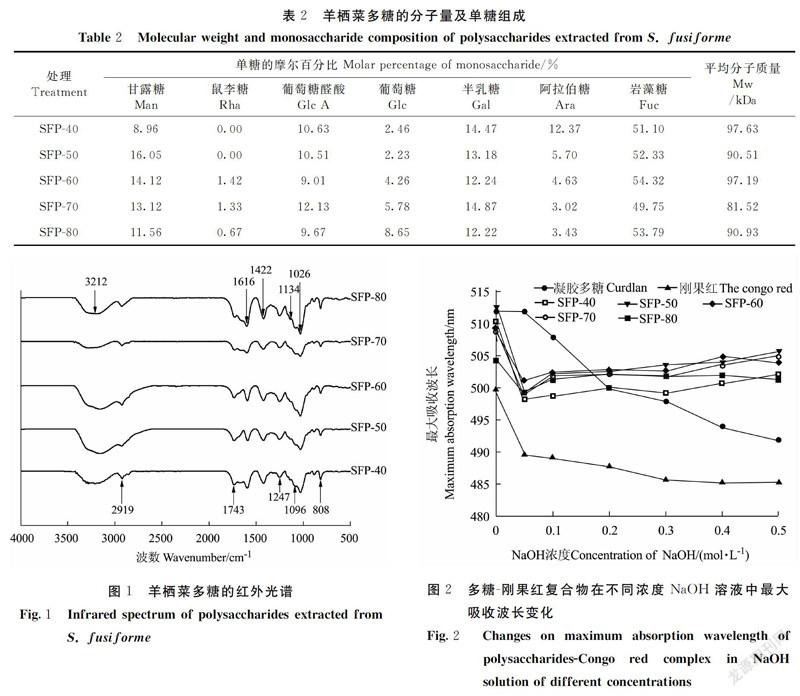
不同体积分数乙醇醇沉得到的羊栖菜多糖的分子量和单糖组成如表2所示,各羊栖菜多糖组分的单糖组成比较丰富,都含有甘露糖、葡萄糖、葡萄糖醛酸、半乳糖、阿拉伯糖及岩藻糖,但各单糖所占比例不同。其中,岩藻糖所占比例最高,约为50%;甘露糖、葡萄糖醛酸、半乳糖的含量也比较高,约为10%;此外,SFP-60、SFP-70、SFP-80含有少量的鼠李糖。SFP-40、SFP-50、SFP-60、SFP-70和SFP-80的平均分子量分别是97.63、90.51、97.19、81.52及90.93 kDa。
2.3 红外光谱分析
SFP-40、SFP-50、SFP-60、SFP-70及SFP-80的红外光谱图如图1所示,主要吸收谱带基本相同,说明其主要有机官能团相似。3 212 cm-1处的宽峰是由于多糖中羟基的伸缩振动引起的。2 919 cm-1处的吸收是由于C-H 键的伸缩振动。1 743 cm-1和 1 616 cm-1的吸收峰为酯化羰基(C=O)和羧基(COO-)的特征峰,说明SFP中存在乙酰基或糖醛酸[23]。1 422 cm-1为C-H的弯曲振动。1 026、1 096、1 134 cm-13个位置出现的吸收峰表示SFP的糖环构型为吡喃型[23],是糖苷键C-O-C的非对称的振动峰。1 247和808 cm-1处的吸收归因于S=O和C-O-S的伸缩振动[24]。
2.4 构象分析
刚果红是一种可与具有三股螺旋链构象的多糖形成络合物的酸性染料。与刚果红相比,络合物的最大吸收波长发生红移,当NaOH浓度大于某个浓度时,其最大吸收波长会急剧下降。本研究利用刚果红试验对羊栖菜多糖的构象进行分析,用具有典型三螺旋结构的凝胶多糖作对照。刚果红试验结果如图2所示,当NaOH浓度为0时,与刚果红相比,样品的最大吸收波长红移,表明样品与刚果红络合,当NaOH浓度为0.05 mol·L-1时,SFP-40、SFP-50、SFP-60、SFP-70及SFP-80的最大吸收波长突然降低,表明稀酸提取的羊栖菜多糖均具有三螺旋结构,但不同体积分数乙醇醇沉不会改变其三螺旋构象。研究发现, 与多糖的初级结构相比,多糖特定的空间构象对其生物活性的影响更大, 如具有抗肿瘤活性的香菇多糖呈三股螺旋结构[25]。
2.5 扫描电镜(SEM)分析
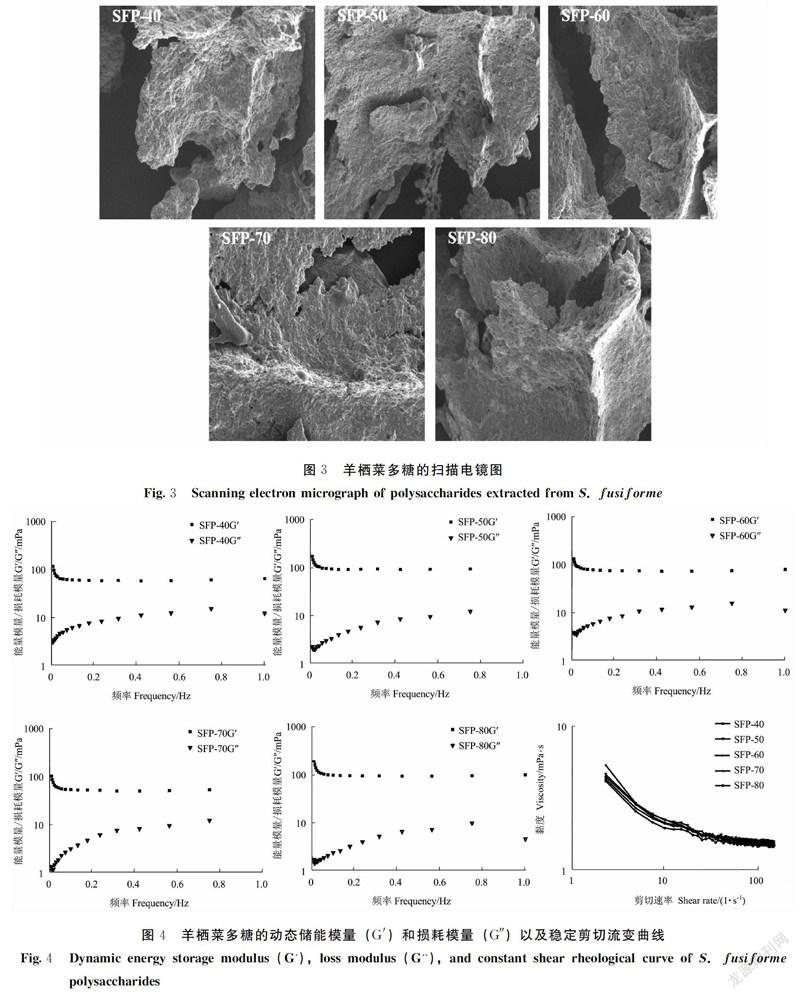
扫描电镜可用于观察多糖等生物大分子的微观形貌。不同体积分数乙醇沉淀制备的羊栖菜多糖的扫描电镜图如图3所示,试验结果表明:酸提取的羊栖菜多糖表面均呈现不规则的几何外形,表面呈凹凸不平、疏松多孔的褶皱结构,说明多糖分子间相互存在排斥力, 分子间吸引力较为弱小。
2.6 流变学特性分析
在25℃的条件下测试羊栖菜多糖溶液的剪切流变和振荡流变曲线,结果如图4所示。在剪切速率范围0.1~150 s-1内,羊栖菜多糖的表观黏度随着剪切速率的升高而逐渐降低,最后趋于稳定,呈现典型的假塑性流体剪切变稀的特性,属于非牛顿流体。溶液的黏度随着剪切速率的增加而降低的现象称为“剪切稀化”,这主要是因为剪切速率的增加会改变分子间的交互作用,使分子间的阻力变小,从而使黏度降低[26]。不同体积分数的乙醇醇沉得到的羊栖菜多糖的表观黏度随剪切速率的变化一致,说明不同体积分数乙醇醇沉得到的羊栖菜多糖溶液的流变学性质类似,即醇沉时乙醇的体积分数不会改变羊栖菜多糖的流变学性质。动态黏弹性行为测定结果表明,SFP-40、SFP-50、SFP-60、SFP-70及SFP-80的储能模量G′和损耗模量G″与频率之间的关系呈现相同的规律,G′>G″,表明不同体积分数乙醇醇沉的羊栖菜多糖均表现固体弹性行为,乙醇沉淀的体积分数不影响羊栖菜多糖的黏弹性行为。
2.7 抗氧化活性分析
2.7.1 ORAC分析
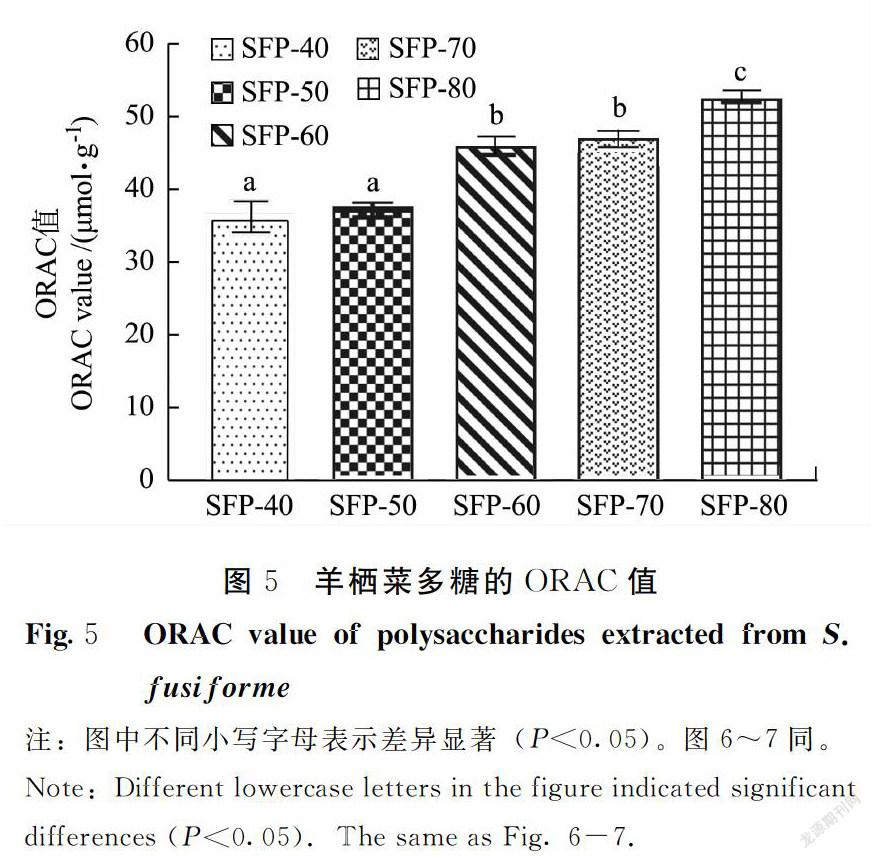
氧自由基吸收能力(ORAC)基于氢原子转移(HAT)机制,广泛应用于评价各种物质的抗氧化活性[27]。在偶氮类化合物偶氮二异丁脒盐酸盐(AAPH)的过氧自由基攻击下,荧光素钠的荧光特性逐渐消失。抗氧化性的物质对过氧自由基的清除能力通常与氧自由基作用下荧光衰减曲线的延迟曲线面积(荧光自然衰减曲线下面积减去荧光衰减曲线下面积)直接相关,结果以Trolox当量来表示。不同体积分数乙醇制备得到的羊栖菜多糖的氧自由基吸收能力结果如图5所示,SFP-40和SFP-50的ORAC值分别为(33.73±2.13)、(38.39±1.11) μmol Trolox·g-1,SFP-60、SFP-70、SFP-80显著高于SFP-40和SFP-50,其中SFP-80的ORAC值最大,为(52.57±0.06) μmol Trolox·g-1,显著高于其他4种醇沉组分(P<0.05)。结果表明不同体积分数醇沉会影响羊栖菜多糖的ORAC值,且随着乙醇体积分数的增加,ORAC值也增大。
2.7.2 DPPH·清除率
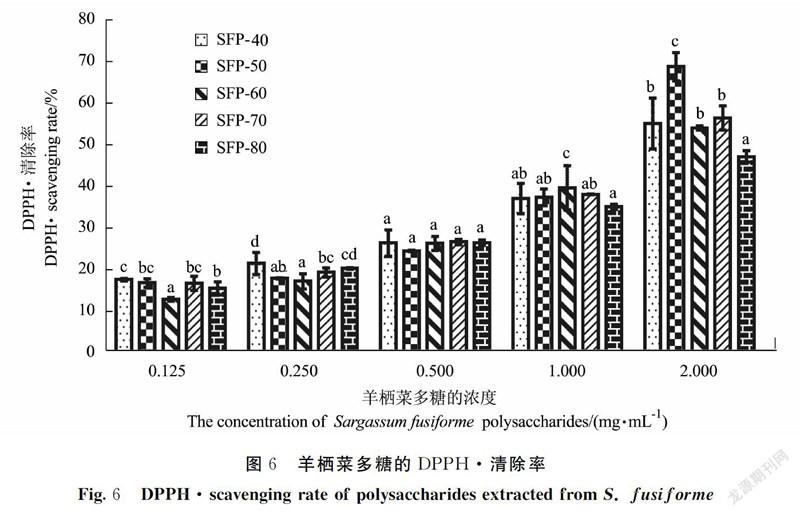
DPPH·在醇溶液中显稳定的紫色,在517 nm处有强吸收,抗氧化剂存在时,其单电子与之配对而使溶液颜色变浅,吸光度降低,被广泛用于评价抗氧剂清除自由基的能力[28]。不同体积分数乙醇沉淀的羊栖菜多糖的DPPH·清除能力如图6所示,DPPH·清除率随着SFP浓度的增加而增加,当羊栖菜多糖浓度较低时(<0.25 mg·mL-1),SFP-40表现出较强的DPPH·清除率,而SFP-60表现出较弱的DPPH·清除率。当羊栖菜多糖质量浓度为2.0 mg·mL-1时,不同体积分数乙醇醇沉对羊栖菜多糖的DPPH·的清除率影响较大,其中,SFP-50的自由基清除能力顯著高于其他体积分数醇沉的羊栖菜多糖,达到了(68.70±3.37)%。
2.7.3 ABTS·的清除率
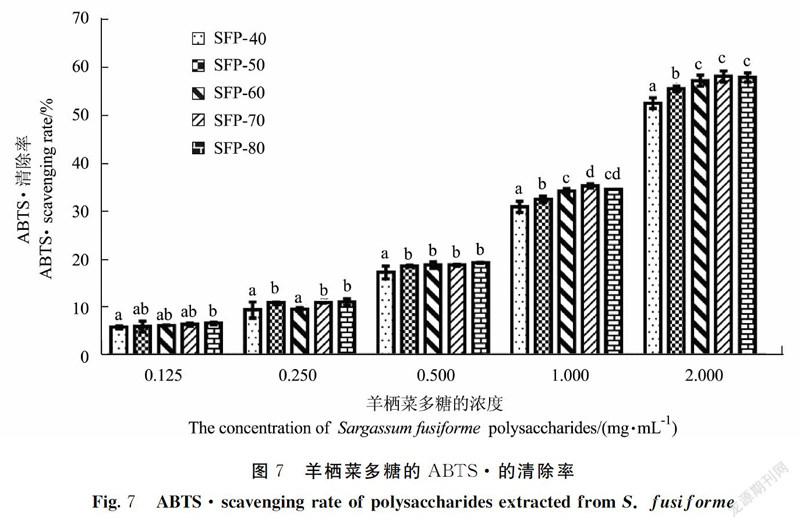
由图7可以看出,羊栖菜多糖对ABTS·均具有一定的清除能力,且随着多糖溶液浓度的增加而增加。在所测浓度范围内,SFP-80的ABTS·的清除率显著高于SFP-40的ABTS·清除率(P<0.05)。当羊栖菜多糖质量浓度为2.0 mg·mL-1时,SFP-40、SFP-50、SFP-60、SFP-70及SFP-80的ABTS·的清除率分别为52.60%、55.56%、57.27%、58.12%和57.93%。
3 讨论与结论
现代研究表明:羊栖菜中富含微量元素及氨基酸,同时还含有丰富的多糖、甾醇、萜类物质等,是天然的保健食品。新鲜的羊栖菜肥厚多汁,营养成分丰富,采集后可直接食用,具有非常高的食疗价值[6]。研究表明其具有抗氧化、抗肿瘤、调节免疫力以及降血糖血脂等多重保健功效[29],极具开发应用前景。本研究采用酸提醇沉法制备羊栖菜多糖,提取过程中未用Sevage法除蛋白,避免了有機试剂在此过程中对羊栖菜多糖结构及功能活性的影响。
分别用体积分数为40%、50%、60%、70%和80%的乙醇醇沉得到SFP-40、SFP-50、SFP-60、SFP-70和SFP-80等5种羊栖菜多糖,其中,SFP-50的总糖和糖醛酸含量最高,且总糖含量显著高于其他体积分数醇沉的羊栖菜多糖;酸提取的羊栖菜多糖中总蛋白含量均较低,且各多糖组分间无显著性差异。羊栖菜多糖均由甘露糖、葡萄糖、葡萄糖醛酸、半乳糖、阿拉伯糖及岩藻糖组成,但各单糖所占比例不同。其中,岩藻糖所占比例最高,约为50%;甘露糖、葡萄糖醛酸、半乳糖的含量也比较高,约为10%;且SFP-60、SFP-70、SFP-80含有少量的鼠李糖,其单糖组成与Wu等[30]研究报道的结果大致相同,但其所占比例有所不同的原因可能是提取方法不同。SFP-40、SFP-50、SFP-60、SFP-70和SFP-80的平均分子量分别是97.63、90.51、97.19、81.52及90.93 kDa,分子量小于Sun等[31]水提法制备的羊栖菜多糖的分子量,可能是因为稀酸提取会使多糖降解。
刚果红试验显示了羊栖菜多糖具有三螺旋结构。流变测试表明羊栖菜多糖是一种非牛顿流体,表现为固态弹性行为,不同体积分数醇沉不改变其流变学性质。抗氧化活性研究表明ORAC值大小依次为SFP-80>SFP-60(SFP-70)>SFP-50(SFP-40),其中SFP-80的ORAC值最大,为(52.57±0.06)μmol Trolox·g-1;随着多糖浓度的增大,多糖的DPPH·和ABTS·的清除率不断增大。多糖质量浓度为2.0 mg·mL-1时,SFP-40、SFP-50、SFP-60、SFP-70和SFP-80的DPPH·清除率分别为55.02%、68.70%、53.93%、56.34%及47.06%,ABTS·的清除率分别为52.60%、55.56%、57.27%、58.12 %和57.93%,说明不同体积分数乙醇醇沉会影响羊栖菜多糖的抗氧化特性。
参考文献:
[1]刘洪超, 应苗苗, 周雨暪, 等. 羊栖菜多糖提取条件优化及其抗氧化活性的研究[J]. 食品工业科技, 2017, 38(6):245-249. LIU H C, YING M M, ZHOU Y M, et al. Optimization of Extraction Conditions and Antioxidant Activity of Polysaccharide from Sargassum fusiformis[J]. Food Science and Technology, 2017, 38(6):245-249.(in Chinese)
[2]SUN Y, CHEN X, ZHANG L, et al. The antiviral property of Sargassum fusiforme polysaccharide for avian leukosis virus subgroup J in vitro and in vivo[J]. International Journal of Biological Macromolecules, 2019,138:70-78.
[3]LI Y, CHEN B, WU W, et al. Antioxidant and antimicrobial evaluation of carboxymethylated and hydroxamated degraded polysaccharides from Sargassum fusiforme[J]. International Journal of Biological Macromolecules, 2018, 118:1550-1557.
[4]FAN S, YU G, NIE W, et al. Antitumor activity and underlying mechanism of Sargassum fusiforme polysaccharides in CNE-bearing mice[J]. International Journal of Biological Macromolecules, 2018, 112:516-522.
[5]CHEN L, CHEN P, LIU J, et al. Sargassum Fusiforme Polysaccharide SFP-F2 Activates the NF-κB Signaling Pathway via CD14/IKK and P38 Axes in RAW264.7 Cells[J]. Marine Drugs, 2018, 16(8):264.
[6]张胜帮, 麻卫锋, 于萍. 羊栖菜多糖提取分离及其清除自由基的活性研究[J]. 食品科学, 2009, 30(18):192-195.
ZHANG S B, MA W F, YU P. Extraction and Separation of Polysaccharide from Sargassum fusiformis and Its Activity of Free Radical Scavenging[J]. Food Science, 2009, 30(18):192-195.(in Chinese)
[7]季宇彬,杨书良,谷春山.羊栖菜多糖对L(615)小鼠LPO含量及GR、GSH-PX、CAT和SOD活性的影响[J]. 中国海洋药物. 1994(2):20-23.
JI Y B, YANG S L, GU C S. Effect of sargassum polysaccharide on LPO Content and Activity of GR, GSH-PX, CAT and SOD in L(615) Mice[J]. Chinese marine medicine,1994(2):20-23.(in Chinese)
[8]陈金星, 胡昔城, 杨维, 等. 羊栖菜多糖体外诱导人大肠癌细胞凋亡[J]. 基础医学与临床, 2008(2):153-159.
CHEN J X, HU X C, YANG W, et al. Sargassum polysaccharide induces apoptosis of human colorectal cancer cells in vitro[J]. Basic medicine and clinical, 2008(2):153-159.(in Chinese)
[9]王扬, 何良强, 王海洪, 等. 羊栖菜多糖对小鼠免疫功能的影响[J]. 宁波大学学报(理工版). 2003(3):245-247.
WANG Y, HE L Q, WANG H H, et al. Effect of sargassum polysaccharide on immune function in mice[J]. Journal of Ningbo University (Technology Edition), 2003(3):245-247.(in Chinese)
[10]于竹芹, 于雪莲, 李生尧, 等. 羊栖菜对四氧嘧啶糖尿病模型小鼠血糖水平影响[J]. 青岛大学医学院学报, 2011(1):28-30.YU Z Q, YU X L, LI S Y, et al. Effect of sargassum on blood glucose level in alloxan diabetic model mice[J]. Journal of Qingdao University Medical College, 2011(1):28-30.
[11]GAO J, LIN L L, ZHAO M M, et al. A comparison study on polysaccharides extracted from Laminaria japonica using different methods structural characterization and bile acid-binding capacity[J]. Food & Function, 2017(8):3043–3052.
[12]DUBOIS M, GILLES K A, HAMILTON J K, et al. Colorimetric Method for Determination of Sugars and Related Substances[J]. Analytical Chemistry, 1956, 28(3):350-356.
[13]王新宇, 刘振华, 李影丹, 等. 猴头菌浸膏多糖及蛋白质含量测定方法的比较[J]. 黑龙江畜牧兽医, 2018(21):219-223.WANG X Y, LIU Z H, LI Y D, et al. Comparison of methods for determination of polysaccharides and protein content in Hericium erinaceus extracts[J]. Heilongjiang Animal Husbandry and Veterinary Medicine, 2018(21):219-223.(in Chinese)
[14]KPODO F M, AGBENORHEVI J K, ALBA K, et al. Structure and physicochemical properties of Ghanaian grewia gum[J]. International Journal of Biological Macromolecules, 2019, 122:866-872.
[15]叢建波, 王长振, 李妍, 等. 褐藻硫酸多糖硫酸基含量测定——硫酸钡比浊法研究[J]. 解放军药学学报, 2003(3):181-183.CONG J B, WANG C Z, LI Y, et al. Determination of Sulfate Content in Brown Algae Sulfated Polysaccharide —Study on Turbidimetry of Barium Sulfate[J]. Chinese Journal of Pharmaceutical Sciences, 2003(3):181-183.(in Chinese)
[16]LIU Z, PI F, GUO X, et al. Characterization of the structural and emulsifying properties of sugar beet pectins obtained by sequential extraction[J]. Food Hydrocolloids, 2019, 88:31-42.
[17]戴军, 朱松, 汤坚, 等. PMP柱前衍生高效液相色譜法分析杜氏盐藻多糖的单糖组成[J]. 分析测试学报, 2007(2):206-210.DAI J, ZHU S, TANG J, et al. Analysis of Monosaccharide Composition of Dunaliella Salina Polysaccharide by PMP Pre-column Derivatization High Performance Liquid Chromatography[J]. Journal of Instrumental Analysis, 2007(2):206-210.(in Chinese)
[18]CHEN C, ZHANG B, HUANG Q, et al. Microwave-assisted extraction of polysaccharides from Moringa oleifera Lam. leaves:Characterization and hypoglycemic activity[J]. Industrial Crops and Products, 2017, 100:1-11.
[19]林恋竹, 朱启源, 赵谋明. 辣木籽抗氧化肽的制备及其对氧化损伤红细胞的保护作用[J]. 食品科学, 2019, 40(7):40-46.LIN L Z, ZHU Q Y, ZHAO M M. Preparation of Moringa Seed Antioxidant Peptide and Its Protective Effect on Oxidative Damaged Red Blood Cells[J]. Food Science, 2019, 40(7):40-46.(in Chinese)
[20]LI C, HUANG Q, FU X, et al. Characterization, antioxidant and immunomodulatory activities of polysaccharides from Prunella vulgaris Linn[J]. Int J Biol Macromol, 2015, 75:298-305.
[21]赵谋明, 董红竹, 林恋竹. 八种水果多酚的定量分析与抗氧化活性研究[J]. 现代食品科技, 2017, 33(10):225-236.ZHAO M M, DONG H Z, LIN L Z. Quantitative Analysis and Antioxidant Activity of Eight Kinds of Fruit Polyphenols[J]. Journal of Modern Food Science, 2017, 33(10):225-236.(in Chinese)
[22]田鑫, 李秀霞, 吴科阳, 等. 海藻多糖提取纯化及生物活性的研究进展[J]. 食品与发酵科技, 2015, 51(6):81-85.TIAN X, LI X X, WU K Y, et al. Research progress in extraction, purification and biological activity of seaweed polysaccharides[J]. Food Science ang Technology, 2015, 51(6):81-85.(in Chinese)
[23]卫阳飞, 宋海, 宗盈晓, 等. 分级醇沉柳茶多糖的含量与单糖组成及抗氧化性研究[J]. 华西药学杂志, 2018, 33(6):489-493.WEI Y F, SONG H, ZONG Y X, et al. Study on the content of polysaccharides, monosaccharide composition and antioxidant activity of fractionated alcoholic willow tea[J]. West China Journal of Pharmaceutical Sciences, 2018, 33(6):489-493.(in Chinese)
[24]YE H, WANG K, ZHOU C, et al. Purification, antitumor and antioxidant activities in vitro of polysaccharides from the brown seaweed Sargassum pallidum[J]. Food Chem, 2008, 111(2):428-432.
[25]戴伟, 刘新义, 胡雄彬, 等. 香菇多糖的分子量和结构与生物活性之间的关系[J]. 中南药学, 2012, 10(6):453-456.DAI W, LIU X Y, HU X B, et al. Relationship between molecular weight and structure and bioactivity of Lentinus edodes polysaccharides[J]. Zhongnan Pharmaceutical, 2012, 10(6):453-456.(in Chinese)
[26]田瑞, 程超, 冯佳, 等. 三百棒多糖的流变学特性及抗氧化活性研究[J]. 中国现代应用药学, 2018, 35(11):1656-1659.TIAN R, CHENG C, FENG J, et al. Study on Rheological Properties and Antioxidant Activity of Polysaccharides from Three Bars[J]. Contemporary Chinese application, 2018, 35(11):1656-1659.(in Chinese)
[27]扶雄, 李湘師, 游丽君, 等. 不同提取方法对海蒿子多糖性质的影响研究[J]. 食品工业科技, 2015, 36(9):101-106.FU X, LI X S, YOU L J, et al. Effects of different extraction methods on the polysaccharide properties of Artemisia scoparia[J]. Food Science and Technology, 2015, 36(9):101-106.(in Chinese)
[28]吴慧, 卢虹玉, 李梅婷, 等. 亨氏马尾藻醇提取物及其不同溶剂萃取物的抗氧化活性研究[J]. 食品工业科技, 2016, 37(10):171-174.WU H, LU H Y, LI M T, et al. Antioxidant Activity of Extracts from Hem′s Algae and Its Different Solvent Extracts[J]. Food Science and Technology, 2016, 37(10):171-174.(in Chinese)
[29]李杰女, 汲晨锋, 季宇彬. 羊栖菜多糖药用活性的研究进展[J]. 亚太传统医药, 2009, 5(7):148-150.LI J N, QI C F, JI Y B. Research progress on the medicinal activity of polysaccharides from Sargassum fusiformis[J]. Asia-Pacific Traditional Medicine, 2009, 5(7):148-150.(in Chinese)
[30]WU S, ZHANG X, LIU J, et al. Physicochemical characterization of Sargassum fusiforme fucoidan fractions and their antagonistic effect against P-selectin-mediated cell adhesion[J]. International Journal of Biological Macromolecules, 2019,133:656-662.
[31]SUN Y, CHEN X, LIU S, et al. Preparation of low molecular weight Sargassum fusiforme polysaccharide and its anticoagulant activity[J]. Journal of Oceanology and Limnology, 2018,36(3):882-891.
(责任编辑:黄爱萍)

