高产木质素降解酶菌株的筛选及其生物学特性研究
袁海华 张保 张颖 敖新宇

摘 要:【目的】获得高产木质素降解酶(LMLs,包括漆酶Lac、锰过氧化物酶MnP、木质素过氧化物酶LiP)的菌株,为木腐菌菌种资源的合理开发和应用提供一定理论依据。【方法】对9株具有产LMLs能力的木腐菌进行产酶筛选,并对筛选出的菌株的生物学特性进行研究。【结果】结果表明:在9株木腐菌中,产LMLs能力較高的菌株分别为LS136(Lac:0.18 U·L-1、LiP:109.68 U·L-1、MnP:140.38 U·L-1)、LJ485(Lac:136.99 U·L-1、LiP:9.53 U·L-1、MnP:72.05 U·L-1)和LJ496(Lac:163.39 U·L-1、LiP:9.50 U·L-1、MnP:74.36 U·L-1)。生物学特性研究结果显示3种菌株最适生长温度均为25℃左右,适宜的生长pH值在4~8。此外,3种菌株对0~8 mmol·L-1的重金属Cr3+、Pb2+以及0~4 mmol·L-1的Cu2+均有较强的耐受性。当Cr3+为1~4 mmol·L-1时,对LJ485和LJ496的生长具有一定的促进作用。【结论】菌株LS136 、LJ485和LJ496分别属于韧革菌属Stereum sp.彩绒革盖菌Trametes versicolor和小薄孔菌Antrodiella sp.,具有较强的产LMLs能力和一定的重金属耐受性,为降解木质素的菌株开发提供了菌种资源参考。
关键词:木腐菌;木质素降解酶;生物学特性
中图分类号:Q 93文献标识码:A文章编号:1008-0384(2019)07-829-08
Abstract: 【Objective】To search for wood-rotting fungi that are highly effective in producing ligninolytic enzymes( LMLs), such asLac, MnP, and LiP. 【Methods】Nine strains of wood-rotting fungi with known ability to produce LMLs were screened and their biological characteristics studied. 【Results】The strains with high capacity of generating LMLs and their yields on each of the LMLs were found to be: LS136 (yielding Lac at 0.18 U·L-1, LiP at 109.68 U·L-1, and MnP at 140.38 U·L-1), LJ485 (yielding Lac at 136.99 U·L-1, LiP at 9.53 U·L-1, and MnP at 72.05 U·L-1), and LJ496 (yielding Lac at 163.39 U·L-1, LiP at 9.50 U·L-1, and MnP at 74.36 U·L-1). The optimum growth temperature for the 3 fungal strains was approximately 25℃, and pH ranged 4 to 8. The strains were all highly tolerant to Cr3+ or Pb2+ at concentrations of 0-8 mmoL·L-1 and Cu2+ at 0-4 mmoL·L-1. At the concentrations between 1-4 mmoL·L-1, Cr3+ promoted the growth of LJ485 and LJ496. 【Conclusion】 The identified LS136 was thought to be a Stereum sp., LJ485 identified as Trametes versicolor, and LJ496 considered an Antrodiella sp.. They all demonstrated varying capacities of producing LMLs with a tolerance to heavy metals. The information would be useful for further investigation on the utilization of these lignin degrading fungi.
Key words:wood-rotting fungus; ligninolytic enzymes; biological characteristics
0 引言
【研究意义】在自然界中,参与木质素降解的微生物包括细菌、真菌等,在这些微生物中,只有被称为“白腐”的担子菌类能够有效解聚和矿化木质素[1-2]。参与木质素解聚的酶主要为催化非特异性反应的氧化酶类,大多数的白腐菌都能分泌胞外木质素降解酶类,以及辅助降解酶类(如胶原氧化酶、过氧化氢产生酶)。在木质素降解酶系中,主要的酶类有漆酶(Laccase, Lac)、木质素过氧化物酶(Lignin peroxidase, LiP)、锰过氧化物酶(Manganese peroxidase, MnP)以及多功能过氧化物酶(Versatile peroxidase, VP)[3]。目前已经报道并鉴定出数千种白腐菌,但其中只有十多种可以用来降解木质素,这些真菌主要属于栓菌属Trametes、烟管菌属Bjerkandera、平革菌属Phanerochaete、侧耳属Pleurotus、香菇属Lentinus和灵芝属Ganoderm[4-5]。【前人研究进展】对白腐菌的产酶特性研究已有很多,如Wang等[6]研究发现,低聚糖(二糖)和单糖(葡萄糖)分别有助于菌株Phanerochaete chrysosporium 产生MnP和LiP,而多糖(纤维素)在整个研究结果中发现会抑制Phanerochaete chrysosporium LiP酶的产生。Janusz等[7]发现在营养物质碳源和氮源缺乏的条件下,白腐菌产木质素降解酶的次生代谢途径就会被激活。Galhaup等[8]向培养基中添加一定的Cu2+会促进Lac酶活提高。此外,由于白腐菌对木质素的独特降解效果,在农业和部分工业的废弃物处理中已有白腐菌的应用,如农业废弃物、制浆造纸工业、纺织工业等[9-11]。【本研究切入点】虽然白腐菌降解木质素效果明显,但能在农业和工业上应用的白腐菌资源还较少,其原因除了与菌株产酶种类和酶活力强弱有关外,还与菌株生长环境条件有关。【拟解决的关键问题】因此,本研究在前期3种初筛结果(RB-亮蓝染料培养基脱色法、鞣酸培养基显色法和α-萘酚培养基显色法)的基础上,从云南省丽江市老君山自然保护区采集的82株木腐菌中初步筛选出了9株具有产木质素降解酶(LMLs)能力的菌株,通过对该9株木腐菌进行LMLs酶活的测定,用以筛选获得高产LMLs的菌株。再设置不同的培养温度、不同培养基pH值以及添加不同的重金属等条件,研究高产LMLs的菌株在不同环境条件下的菌落生长情况,筛选具有高产木质素降解酶(LMLs)能力的菌株,为高产木质素降解酶菌株的进一步开发和利用提供参考。
1 材料与方法
1.1 试验材料
1.1.1 供试菌株
菌株LS77多孔菌属Polyporus sp.于2016年4月采自云南省丽江市老君山石头乡;LS136韧革菌Stereum sp.、LS180灵芝属Ganoderma sp.于2016年7月采自云南省丽江市老君山石头乡;LJ367胶质刺银耳Pseudohydnum gelatinosum、LJ417(未鉴定出)、LJ460(未鉴定出)、LJ483褐褶孔菌属Gloeophyllum sp.、LJ485彩绒革盖菌Trametes versicolor、LJ496小薄孔菌Antrodiella sp.,均于2016年7月采自云南省丽江市老君山九河乡。通过初筛以上供试菌株在RB-亮蓝培养基、鞣酸培养基、α-萘酚培养基上均能产生变色圈。
1.1.2 试验试剂
无水葡萄糖、磷酸二氢钾、硫酸镁、维生素B1、琼脂、冰醋酸、醋酸钠、乳酸、乳酸钠、酒石酸钠、酒石酸、硫酸锰、30%双氧水、(CH3COO)2Cu·H2O、CrK(SO4)2·12H2O、Pb(CH3COO)2·3H2O、浓盐酸、NaOH,以上试剂均为国产分析纯。
1.1.3 培养基
综合PDA培养基(zPDA):200 g土豆、20 g葡萄糖、3 g磷酸二氢钾、1.5 g硫酸镁、18 g琼脂、0.05 g维生素B1、1 L蒸馏水,灭菌后取出并在无菌条件下用0.5 mol·L-1 HCl或0.5 mol·L-1 NaOH调节pH至7。
PD培养基:不添加琼脂的zPDA培养基。
Cu2+培养基:称取一定质量的(CH3COO)2Cu·H2O分别置于5个装有200 mL zPDA培养基的锥形瓶内,分别配制成含有不同浓度(1、2、4、8、16 mmol·L-1)Cu2+的培养基,灭菌待用。
Cr3+培养基:称取一定质量的CrK(SO4)2·12H2O分别置于7个装有200 mL zPDA培养基的锥形瓶内,分别配制成含有不同浓度(0.25、0.5、1、2、4、8、16 mmol·L-1)Cr3+的培养基,灭菌待用。
Pb2+培养基:称取一定质量的Pb(CH3COO)2·3H2O分别置于6个装有200 mL zPDA培养基的锥形瓶内,分别配制成含有不同浓度(0.5、1、2、4、8、16 mmol·L-1)Pb2+的培养基,灭菌待用。
1.2 试验方法
1.2.1 供试菌株的活化
将试管中的供试菌株接种于zPDA 培养基,25℃条件下培养至菌落长至2/3培养皿,备用。
1.2.2 菌株的酶活测定
(1)粗酶液的制备:
采用直径为5 mm的打孔器取供试菌株的菌落外缘菌丝,接种于PD培养基,接种量为每个菌饼30 mL培养基,于25℃的恒温摇床中培养21 d。每隔2 d取样1次(10 mL)。发酵液在4℃条件下,4 000 r·min-1离心10 min,所得上清液即为待测粗酶液。
(2)酶活测定:
漆酶Lac活性[12-15]:在25℃条件下,移取0.5 mmol·L-1 ABTS测吸光度值的变化。以每分钟1 μmol ABTS被转化所需的酶量来表示1个Lac酶活力单位,消光系数为3.6×104 mol·L-1·cm-1。
锰过氧化物酶MnP活性[14]:在37℃条件下,分别加入1.8 mL 0.24 mol·L-1酒石酸缓冲液(pH 3.0)、24 mmol·L-1藜芦醇0.1 mL、粗酶液1.0 mL,加入6 mmol·L-1过氧化氢0.1 mL后启动反应,在310 nm处记录吸光度值的变化。以每分钟内氧化1.0 μmol藜芦醇所需酶量为一个LiP酶活力单位,消光系数为9.3×103 mol·L-1·cm-1。
木质素过氧化物酶LiP活性[12]:向反应体系中加入0.11 mol·L-1乳酸钠缓冲液(pH 4.5)1.8 mL、40 mmol·L-1硫酸锰溶液0.1 mL、粗酶液1.0 mL,预热至37℃后加入1.6 mmol·L-1双氧水0.1 mL启动反应,在室温条件下测定240 nm处吸光度值的改变。以每分钟内氧化1.0 μmol的Mn2+转化成Mn3+所需酶量为一个MnP酶活力单位,消光系数为6.5×103 mol·L-1·cm-1。
1.2.3 生物学特性研究
(1)不同温度、pH值对供试菌株生长的影响:
将筛选出的各菌株的菌饼分别接种于zPDA培养基上,于不同温度(5、15、25、35、45、55℃)和不同pH值(3、4、5、6、7、8、9)条件下恒温培养,采用十字交叉法,每隔1 d测量1次菌落直径并记录,直至其中一组长满培养皿为止。
(2)不同重金属离子对供试菌株的生长影响:
将筛选出的各菌株的菌饼分别接种于不同重金属离子(Cu2+:1、2、4、8、16 mmol·L-1;Cr3+:0.25、0.5、1、2、4、8、16 mmol·L-1;Pb2+:0.5、1、2、4、8、16 mmol·L-1)的培养基上,于25℃条件下恒温培养,采用十字交叉法,每隔1 d测量1次菌落直径并记录,直至其中一组长满培养皿为止。
2 结果与分析
2.1 降解木质素菌株的复筛结果
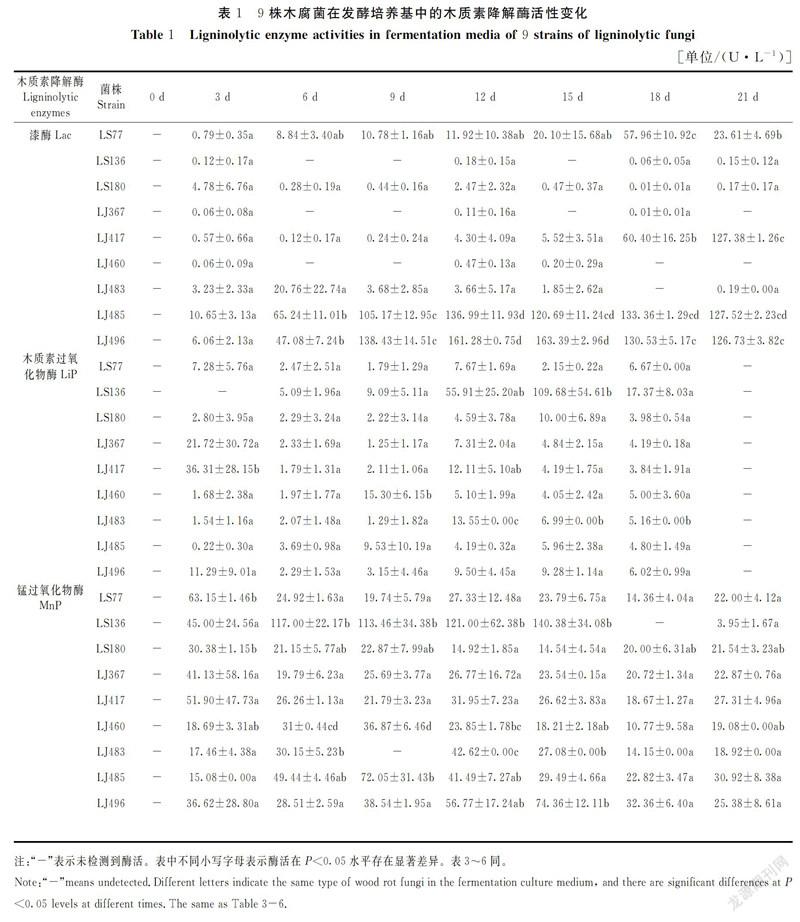
9株木腐菌在21 d内的LMLs酶活变化结果如表1~3所示。
表1显示:不同菌株在发酵培养基中产生的Lac活力存在很大的差异。菌株LS136、LS180、LJ367以及LJ460在21 d内都未检测到Lac酶活或与其余5个菌株相比,Lac酶活力很低。在其余5株菌中,LS77与LJ483的酶活相对较低,分别在第18 d、6 d时达到最大酶活57.96 U·L-1、20.76 U·L-1;菌株LJ417在0~15 d内,Lac酶活很低,其差异均不显著(P>0.05),在15~21 d内,随着时间的增加,Lac的酶活迅速升高,在第21 d時,Lac酶活达到127.38 U·L-1与第18 d的Lac酶活值存在显著差异(P<0.05);菌株LJ485在0~12 d内,随着时间的增加,Lac酶活迅速升高,并在第12 d时达到最大值,最大酶活为136.99 U·L-1,在12~21 d内,菌株LJ485的Lac酶活趋于稳定,无显著差异;菌株LJ496在0~9 d内,随着时间的增加,Lac酶活迅速升高,在9~15 d内,随着时间的增加,Lac酶活缓慢升高,并于15 d达到最大酶活163.39 U·L-1,但与第12 d的Lac酶活值(161.28 U·L-1)相比,其差异不显著,因此,可认为在第12 d时达到最大酶活,随着时间的继续延长,菌株LJ496的Lac酶活开始缓慢下降。
菌株LS136在0~9 d内,随着时间的增加,其LiP酶活缓慢增加,在9~15 d内,LiP酶活随着时间的延长,出现迅速升高的现象,并于15 d达到最大酶活109.68 U·L-1,随着时间的继续增加,菌株LS136的LiP酶活迅速下降。与菌株LS136相比,其余8株菌的LiP酶活相对较低,其中LS77、LS180、LJ367、LJ485、LJ496在3~21 d内均没有显著差异(P>0.05)。菌株LS136、LJ485、LJ496的MnP酶活均高于其余6株菌。其中菌株LS136的MnP酶活是最强的,其MnP酶活在前15 d内酶活迅速升高,6~15 d内无显著差异,在第15 d时达最大值140.38 U·L-1,随后MnP酶活开始下降;菌株LJ485的MnP酶活在前9 d内迅速升高,在第9 d时达到最大值72.05 U·L-1,随后MnP酶活开始缓慢下降;菌株LJ496在0~15 d内,随着时间的增加,MnP酶活不断升高,并在15 d时达到最大酶活74.36 U·L-1,继续增加培养时间,其MnP酶活开始降低。
通过对9株木腐菌的LMLs活力测定结果表明:不同菌株所产生的LMLs活力具有较大差异;综合3种酶活研究,从9个菌株中复筛选出产酶能力较好的菌株有LS136、LJ485和LJ496。
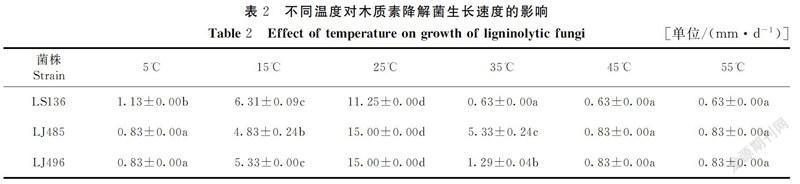
2.2 温度对供试菌株生长的影响
在不同温度条件下,将复筛的供试菌株分别接种于pH值7的zPDA培养基中进行培养,记录不同供试菌株在不同时间下的生长情况,分别采用每种菌生长满培养皿时所处时间点的数据制表,其结果见表2。由表2可知,菌株LS136、LJ485、LJ496在15~25℃条件下均能生长,此外,菌株LJ485在35℃条件下仍能缓慢生长,表明该菌株对环境温度有一定的耐受性;在培养温度为5~25℃,3株供试菌株的生长速度随着培养温度的升高而显著加快(P<0.05),均在25℃达到最大。表明3种供试菌株对温度较为敏感,且最适生长温度均为25℃。此时的菌落生长速度依次为LJ485(15.00 mm·d-1)=LJ496(15.00 mm·d-1)>LS136(11.25 mm·d-1),在25~35℃内,随着环境温度的增大,菌落生长速度显著下降(P<0.05),且在该段温度内,菌落生长速度依次为LJ485>LJ496>LS136。
2.3 pH值对供试菌株生长的影响
在25℃条件下,将3种供试菌株分别接种于不同pH值的zPDA培养基中进行培养,记录不同供试菌株在不同时间下的详细生长情况,分别采用每种菌生长满培养皿时所处时间点的数据制表,其结果见表3。
由表3可知,3个菌株表现出一定的广谱性,在pH4~8的范围内均能生长,但不同菌株具有一定的差异性。在试验pH值范围内,菌株LJ496是3种供试菌株里生长速度最快的,且在pH值为5~8时,始终保持稳定的生长速度,无显著性差异(P>0.05) ;菌株LJ485在pH值为3~6时,随着pH值的增大,菌落生长速度显著加快(P<0.05),于pH值为6时,达到最大值(13.8 mm·d-1),继续增大pH值,菌落生长速度显著下降(P<0.05);菌株LS136在pH值为3~6时,随着pH值的增大,菌落生长速度显著加快(P<0.05),于pH值6~7内趋于稳定并无显著差异(P>0.05),继续增大pH值时,LS136菌落生长速度显著下降(P<0.05)。结果表明,3种供试菌株具有较广的pH适应范围。
2.4 重金属离子对供试菌株生长的影响
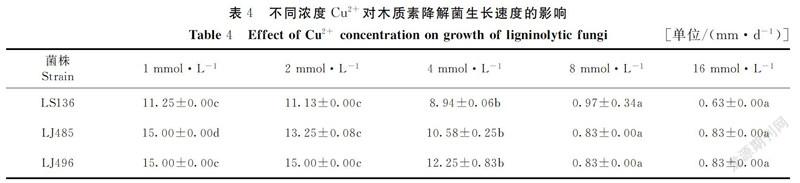
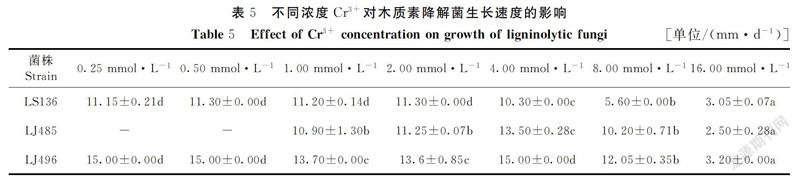
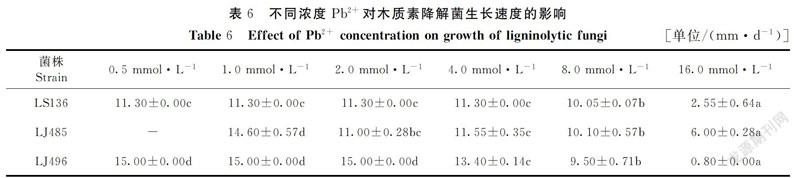
在pH值为7、温度为25℃的培养条件下,将3种供试菌株分别接种于不同浓度的Cu2+、Cr3+、Pb2+培养基中进行培养,记录不同供试菌株在不同时间的详细生长情况,分别采用每种菌长满培养皿时所处时间点的数据制表,其结果见表4~6。
由表4可知,在1~4 mmol·L-1的Cu2+浓度范围内,3种供试菌株均能生长,与8~16 mmol·L-1的浓度范围内的菌株生长速度有显著差异(P<0.05);在8~16 mmol·L-1的浓度范围内,3种供试菌株均不能生长,无显著差异(P>0.05);在Cu2+浓度为1~8 mmol·L-1范围内,随着浓度持续增高,3种供试菌株的生长速度都急速下降,且在该浓度范围内,菌落生长速度大小依次为:LJ496>LJ485>LS136;继续增大Cu2+浓度,菌落生长速度不再变化。结果表明,3种供试菌株对Cu2+浓度较为敏感,耐受性较弱。
由表5可知,在0.25~16 mmol·L-1的Cr3+浓度范围内,供试菌株LS136和LJ496均能生长;在1~16 mmol·L-1的浓度范围内,供试菌株LJ485也能生长;菌株LS136在0.25~2.00 mmol·L-1 的Cr3+浓度范围内,其生长速度较快并无显著差异(P>0.05),随着浓度增高,生长速度显著降低(P<0.05)。在0.25~4.00 mmol·L-1的Cr3+浓度范围内,随着浓度的增加,菌株LJ485、LJ496的生长速度缓慢提高,在4 mmol·L-1的Cr3+浓度下,其生长速度增加达到最大值(分别为13.5、15.0 mm·d-1),浓度继续增加浓度,其生长速度均显著下降(P<0.05);结果表明,一定浓度下的Cr3+能够促进菌株LJ485和菌株LJ496的生长,3种供试菌株对Cr3+浓度均不敏感,耐受性较强。
由表6可知,菌株LS136和菌株LJ485在所选的Pb2+试验浓度范围内均能生长,其中菌株LS136在0.5~4 mmol·L-1 Pb2+浓度范围内的生长速度显著较高(P<0.05),菌株LJ485在1 mmol·L-1 Pb2+条件下的生长速度显著比其余浓度条件下的生长速度大(P<0.05);菌株LJ496在0.5~8.0 mmol·L-1 的Pb2+浓度范围内能夠持续生长,但在16 mmol·L-1的Pb2+上无法生长。此外菌株LJ496在0.5~2.0 mmol·L-1 Pb2+浓度范围内的生长速度显著高于4~16 mmol·L-1 Pb2+浓度范围内的生长速度(P<0.05)。在Pb2+的试验浓度范围内,随着浓度的增加,3种供试菌株的生长速度均出现显著下降趋势(P<0.05);在Pb2+浓度为0.5~8.0 mmol·L-1时,菌落生长速度大小依次为:LJ496>LJ485>LS136,继续增大浓度时,菌落生长速度大小变为:LJ485>LS136>LJ496。研究结果表明,3种供试菌株对Pb2+的耐受性均较强,且菌株LJ496对Pb2+的抗性比另外2株较弱。
3 討 论
菌株LS136属于韧革菌属Stereum sp.,其产Lac能力很弱,但具有较强的产LiP和MnP能力。菌株LJ485和LJ496分别属于彩绒革盖菌Trametes versicolor和小薄孔菌Antrodiella sp.,但是具有相似的产酶能力,均能产Lac和MnP,且酶活大小相近。这些结果表明,不同的菌株产LMLs的种类可能存在差异,产LMLs能力相似的菌株也可能来源于不同属。其原因除了可能与菌株携带的遗传信息相关外,还可能与环境中的诱导因子相关。此外,Lac、LiP和MnP分别属于不同系列的同工酶,故LJ485和LJ496所产的LMLs是否相同还有待进一步研究。由于木质素的天然降解过程是由多种菌参与完成,因此,在后续研究中可以尝试将3种菌株进行组合,弥补不同菌株产不同LMLs能力的差异,研究组合后的复合菌系的产酶能力强弱及其对木质素的降解效果。此外,在已报道的国内外高效木质素降解菌中,关于小薄孔菌属的报道非常稀少,而本研究中筛选出的小薄孔菌属具有较强的产LMLs能力,为降解木质素的菌株开发提供了菌种资源。
目前,通过利用白腐菌对多环芳烃(PAHs)类污染物的降解研究已有很多,但是很少有研究关注环境中的影响因素对菌株生长的影响。当环境中同时存在多种的污染物时,如:工业设施和公路附近的污染土壤中常伴有高浓度的重金属离子存在[16],这在利用白腐菌进行环境生物修复时是不可忽视的影响因素。相关研究发现,重金属镉Cd、铜Cu、汞Hg不仅对土壤微生物群落有影响,同时对白腐菌也具有一定的毒性,会影响白腐菌的生长[17-18]。因此,在对白腐菌进行生物降解研究的同时,探索环境因子对白腐菌的生长影响具有重要意义。本研究通过对高产LMLs的3种菌株进行生物学特性研究,发现温度对3种菌株的生长影响较大,酸碱度次之,不同的重金属离子对3种菌的影响也不同,其中,一定浓度条件下的Cr3+对菌株LJ485和LJ496具有促进生长速度的作用,其原因有待进一步研究。
4 结 论
通过对9株木腐菌的3种LMLs酶活测定,结果显示产酶能力较强的菌株有LS136、LJ485和LJ496。通过设置不同培养温度、培养基pH值和不同浓度的重金属(Cu2+、Cr3+、Pb2+)培养基,记录3种高产LMLs菌株(LS136、LJ485和LJ496)的菌落生长速度影响,结果显示3种供试菌株最适生长温度均为25℃左右,最适生长pH值为4~8;在试验浓度范围内,3种菌株对Cr3+、Cu2+、Pb2+均有较强的耐受性,其中对Cu2+的耐受性较弱;此外,Cr3+在1~4 mmol·L-1一定浓度范围内,对LJ485和LJ496的生长具有一定的促进作用。
参考文献:
[1]MILLATI R, SYAMSIAH S, NIKLASSON C, et al. Biological pretreatment of lignocelluloses with white-rot fungi and its applications:a review[J]. BioResources, 2011, 6(4):5224-5259.
[2]GUILLN F, MARTNEZ M J, GUTIRREZ A, et al. Biodegradation of lignocellu-losics:microbial, chemical, and enzymatic aspects of the fungal attack of lignin[J]. International Microbiology, 2005, 8:195-204.
[3]WONG D W S. Structure and action mechanism of ligninolytic enzymes[J]. Applied Biochemistry and Biotechnology, 2009, 157(2):174-209.
[4]D′SOUZA T M, MERRITT C S, REDDY C A. Lignin-modifying enzymes of the white rot basidiomycete Ganoderma lucidum[J]. Applied and Environmental Microbiology, 1999, 65(12):5307-5313.
[5]ADASKAVEG J E, GILBERTSON R L, BLANCHETTE R A. Comparative studies of delignification caused by Ganoderma species[J]. Applied and Environmental Microbiology, 1990, 56(6):1932-1943.
[6]WANG F, AI M, YANG G, et al. Influence of Carbon Source on the Production of Extracellular Ligninolytic Enzymes by Phanerochaete chrysosporium[J]. BioResources, 2016, 11(3):5676-5686.
[7]JANUSZ G, KUCHARZYK K H, PAWLIK A, et al. Fungal laccase, manganese peroxidase and lignin peroxidase:gene expression and regulation[J]. Enzyme and Microbial Technology, 2013, 52(1):1-12.
[8]GALHAUP C, HALTRICH D. Enhanced formation of laccase activity by the white-rot fungus Trametes pubescens in the presence of copper[J]. Applied Microbiology and Biotechnology, 2001, 56(1-2):225-232.
[9]SELINHEIMO E, KRUUS K, BUCHERT J, et al. Effects of laccase, xylanase and their combination on the rheological properties of wheat doughs[J]. Journal of Cereal Science, 2006, 43(2):152-159.
[10]BAJPAI P. Application of enzymes in the pulp and paper industry[J]. Biotechnology Progress, 1999, 15(2):147-157.
[11]JEBAPRIYA G R, GNANADOSS J J. Bioremediation of textile dye using white rot fungi:A review[J].International Journal of Current Research and Review, 2013, 5(3):1-13.
[12]GAI Y P, ZHANG W T, MU Z M, et al. Involvement of ligninolytic enzymes in degradation of wheat straw by Trametes trogii[J]. Journal of Applied Microbiology, 2014, 117(1):85-95.
[13]ZOUARI-MECHICHI H, MECHICHI T, DHOUIB A, et al. Laccase purification and characterization from Trametes trogii isolated in Tunisia:decolorization of textile dyes by the purified enzyme[J]. Enzyme and Microbial Technology, 2006, 39(1):141-148.
[14]TIEN M, KIRK T K. Lignin Peroxidase of Phanerochaete Chrysosporium[M]. Methods in enzymology. Academic Press, 1988, 161:238-249.
[15]MURUGESAN K, NAM I H, KIM Y M, et al. Decolorization of reactive dyes by a thermostable laccase produced by Ganoderma lucidum in solid state culture[J]. Enzyme and Microbial Technology, 2007, 40(7):1662-1672.
[16]MARCEL KOELEMAN,WILLEM JANSSEN vd LAAK,HANNAH IETSWAART. Dispersion of PAH and heavy metals along motorways in the Netherlands-an overview[J]. Science of the Total Environment,1999,235(1):347-349.
[17]BALDRIAN P, GABRIEL J. Effect of heavy metals on the growth of selected wood-rotting basidiomycetes[J]. Folia Microbiologica, 1997, 42(5):521-523.
[18]MANDAL T K, BALDRIAN P, GABRIEL J, et al. Effect of mercury on the growth of wood-rotting basidiomycetes Pleurotus ostreatus, Pycnoporus cinnabarinus and Serpula lacrymans[J]. Chemosphere, 1998, 36(3):435-440.
(責任编辑:张 梅)

