桦褐孔菌诱导肺癌细胞周期阻滞和凋亡的研究
陈晨 李岩 卓勤 霍军生 万丽葵
摘 要:目的:研究桦褐孔菌诱导肺癌细胞周期阻滞和凋亡的作用,为桦褐孔菌在抗肿瘤方面的应用提供科学依据。方法:将不同浓度的桦褐孔菌与人肺癌A549细胞共同培养后,采用CCK-8法检测细胞存活率,使用流式细胞技术检测细胞周期分布和细胞凋亡率的变化。结果:桦褐孔菌能够抑制A549细胞的生长,并诱导其凋亡。浓度为2、4mg/mL的桦褐孔菌液作用于A549细胞48h后,与对照组相比,细胞存活率分别显著下降至83.32%和69.27%(P<0.05,对照组为92.11%),早期凋亡率分别显著增至6.47%和8.07%(P<0.01,对照组为1.98%),总凋亡率显著增至14.27%和27.54%(P<0.05,对照组为5.91%),晚期凋亡率增至7.8%(P>0.05)和19.48%(P<0.01,对照组为3.94%)。细胞周期检测结果显示,与对照组相比,4mg/mL桦褐孔菌与A549细胞孵育24h后,G2/M期细胞显著增加至22.12%(P<0.01,对照组为12.5%);孵育48h后,G0/G1期显著增加至68.87%(P<0.01,对照组为59.87%)。结论:桦褐孔菌能够诱导A549细胞凋亡,使细胞周期阻滞于G0/G1期以及G2/M期。
关键词: 桦褐孔菌;A549细胞;凋亡;细胞周期
桦褐孔菌是药用真菌,俗称白桦茸。国内外学者发现,桦褐孔菌具有抗肿瘤、抗炎、抗病毒、降血糖、抗氧化、降血压等多种生物活性[1-7],但是具体的作用机制并不清楚。本研究以人肺癌A549细胞为研究对象,探索桦褐孔菌对人肺癌A549细胞的细胞周期与凋亡的影响,为进一步探讨作用机制提供科学依据。
1 材料与方法
1.1 材料和仪器
1.1.1 细胞 桦褐孔菌样品来源地为俄罗斯,粉末状。
1.1.2 试剂 A549人非小细胞肺癌细胞,中国科学院典型培养物保藏委员会细胞库;F-12K培养液,Invitrogen公司;胎牛血清,Gibco公司;AnnexinV/PI细胞凋亡检测试剂盒,BD公司;碘化丙啶,PI,Biolegend公司;CCK-8试剂盒,日本同仁公司;0.25%胰酶,Gibco公司;青链霉素,Gibco公司。
1.1.3 仪器 倒置显微镜,Nikon公司;酶标仪,Molecular Devices公司;流式细胞仪,BD公司;低温冷冻离心机,贝克曼公司;CO2培养箱,Heal Force公司。
1.2 方法
1.2.1 细胞培养 A549细胞培养在10%胎牛血清、100U/L青霉素、100μg/mL链霉素的F-12K完全培养液,于37℃恒温、5%CO2细胞培养箱中培养,2~3d消化传代1次,取对数生长期细胞用于实验。
1.2.2 桦褐孔菌溶液的配制 用100℃热水配制浓度为100mg/mL桦褐孔菌溶液,放置2h冷却后,用F-12K完全培养液稀释成浓度为80、40、20、10、5mg/mL的溶液。
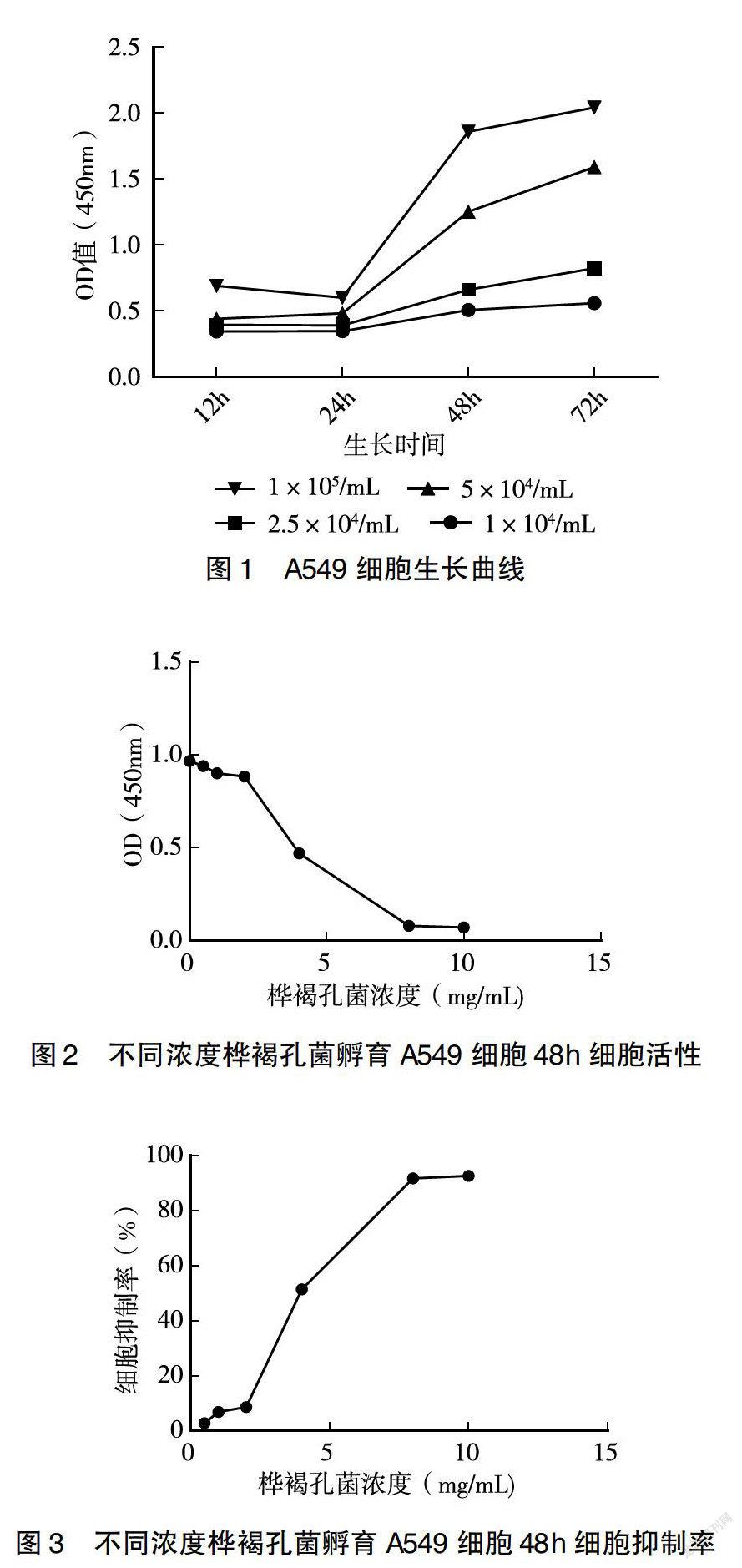
1.2.3 A549细胞生长曲线绘制 取对数生长期的人肺癌A549细胞,用F-12K完全培养液将细胞调整为1×105/mL、5×104/mL、2.5×104/mL、1×104/mL浓度的细胞悬液。将细胞悬液加入96孔板中,每孔100μL,同时设置空白对照组(100μL F-12K完全培养液),于12、24、48、72h使用CCK-8试剂盒检测细胞活性。
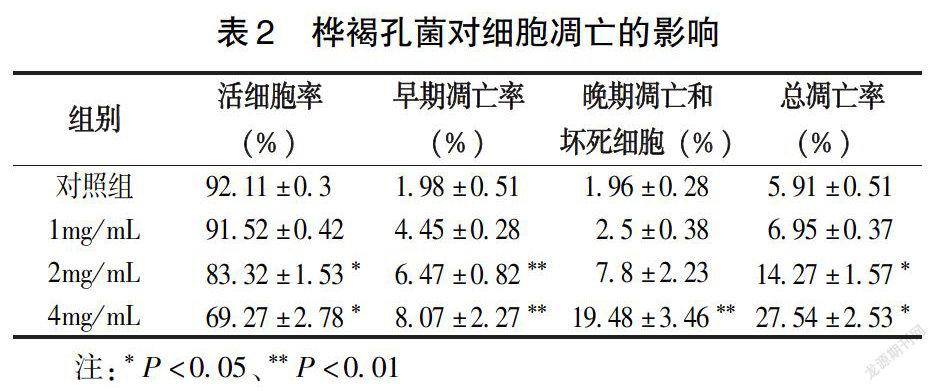
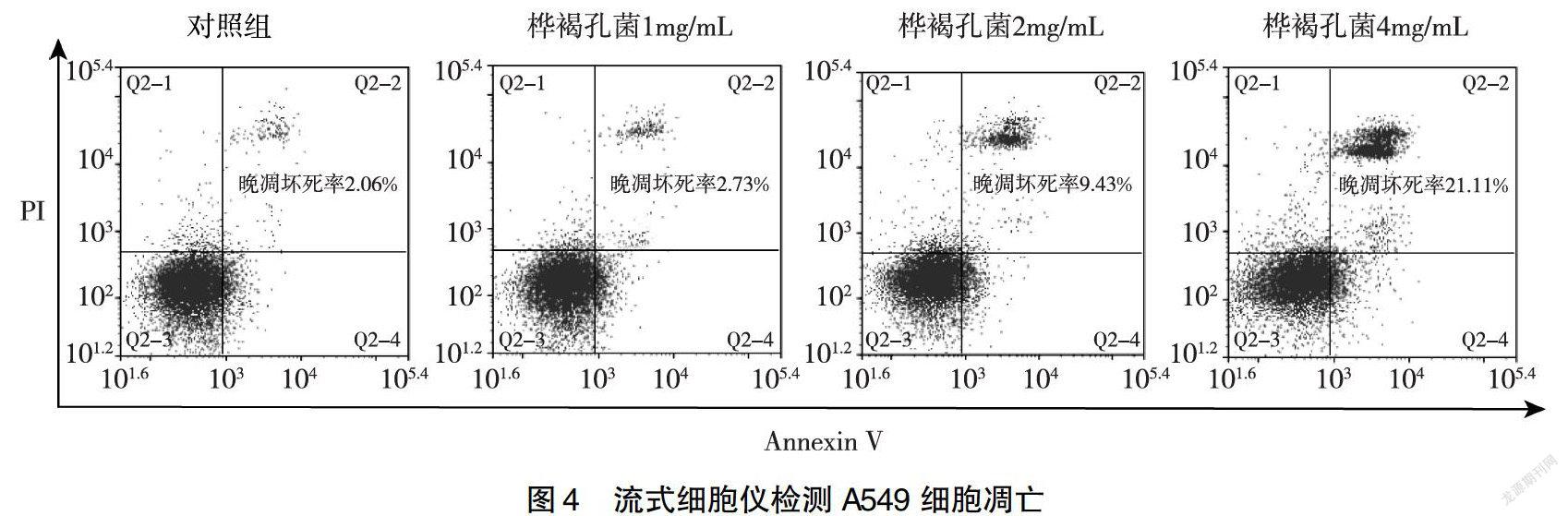
1.2.4 CCK-8法检测桦褐孔菌对人肺癌A549细胞生长的影响 取对数生长期的人肺癌A549细胞,用F-12K完全培养液将细胞调整为5×104/mL细胞悬液,加入96孔培养板内,每孔加入90μL,然后置于细胞培养箱内培养12h,待A549细胞贴壁生长后,分别加入不同浓度桦褐孔菌溶液10μL,使受试物最终浓度为10、8、4、2、1、0.5mg/mL,同时设置阴性对照组(加入10μL F-12K完全培养液)和空白对照组(90μL F-12K完全培養液+10uL F-12K完全培养基),每组设6个平行孔,细胞培养箱中培养48h后,每孔加入10μL CCK-8试剂,放入培养箱继续培养1~4h,酶标仪490nm测定各孔光密度值(OD)。按式(1)计算细胞抑制率,并计算半数抑制浓度(IC50)。
细胞抑制率(%)=(阴性对照组OD值-实验组OD值)/(阴性对照组OD值-空白组OD值)×100%(1)
1.2.5 流式细胞仪分析细胞周期及凋亡 用F-12K完全培养液将细胞调整为5×104/mL细胞悬液,取2mL接种于6孔板,实验分为4、2、1mg/mL剂量组和阴性对照组4个组,孵育过夜。桦褐孔菌用完全培养基稀释成40、20、10mg/mL,吸去上层培养基,每孔加入1.8mL完全培养基,另加0.2mL相应剂量的桦褐孔菌溶液,阴性对照组加入0.2mL F-12K完全培养基。
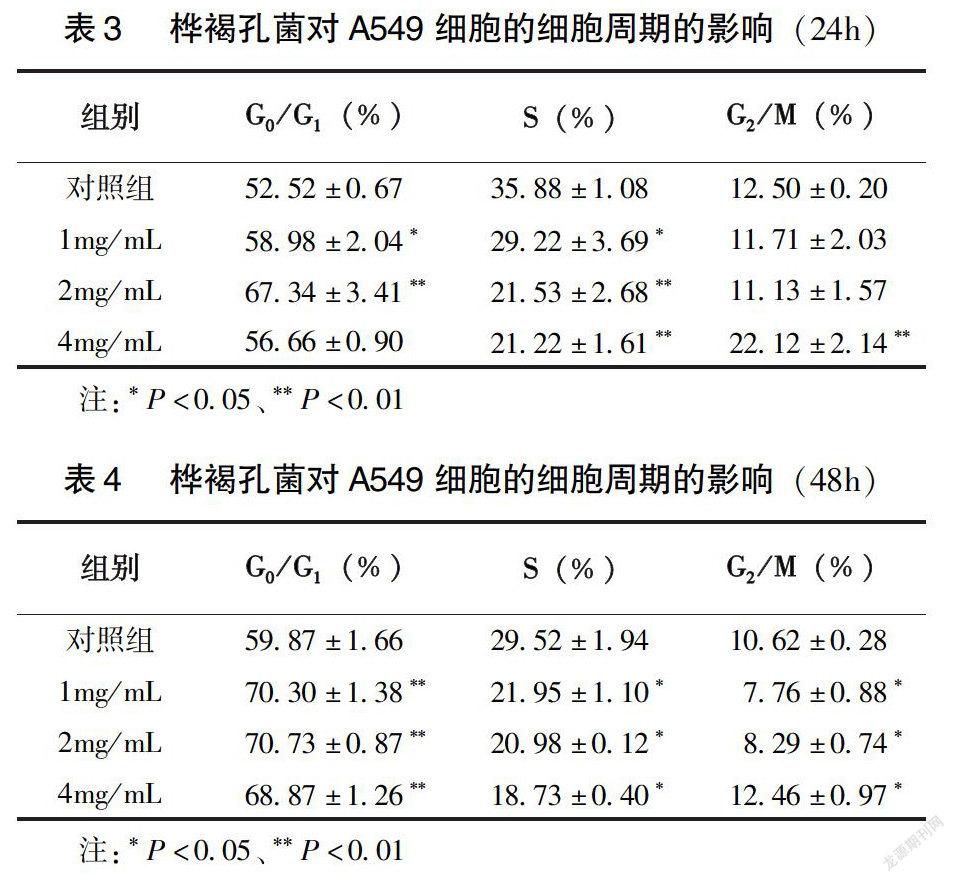
(1)细胞周期检测:桦褐孔菌处理细胞24h和48h后,收集细胞,调整为106/mL,PBS洗2次,250r/min离心5min,尽可能去除上清,-20℃预冷的70%乙醇1mL固定细胞,逐滴加入,边加边振荡,确保充分的固定又防止细胞成团,4℃固定30min以上。用PBS洗2次,2 000/min离心5min,小心地弃上清,防止细胞损失。加入50μL 100μg/mL的RNase,37℃孵育30min,加入200μL 50μg/mL碘化丙啶(PI),充分振荡,孵育15min后,使用流式细胞仪检测分析细胞周期。实验重复3次。(2)细胞凋亡检测:桦褐孔菌处理细胞48h后,收集上清液和底层全部细胞。加入5μL FITC Annexin V和5μL PI,轻微振荡,室温下孵育15min,加入400μL Binding Buffer,使用流式细胞仪检测活细胞、坏死细胞、早期凋亡、晚期凋亡细胞百分比,计算细胞凋亡率。实验重复3次。
1.3 统计学方法
数据以均数±标准差的形式表示,使用SPSS软件进行统计分析。3组以上数据的比较,若方差齐,则进行方差分析,有显著性差异时,使用Dunnet t检验进行各剂量组与对照组的比较;若方差不齐,使用秩和检验进行多组比较。
2 结果与分析
2.1 细胞生长曲线
如图1所示,5×104/mL浓度细胞接种于96孔板后孵育48h即达到对数生长期,可用于下一步实验。
2.2 桦褐孔菌对细胞生长状况的影响
如图2~3所示,桦褐孔菌孵育A549细胞48h,随着桦褐孔菌浓度增加,450nm OD值下降,细胞抑制率升高,IC50为4.73mg/mL。
2.3 流式细胞仪检测细胞凋亡率
如表2所示,2mg/mL和4mg/mL桦褐孔菌孵育A549细胞48h后,A549细胞的活细胞率显著下降(P<0.05),早期凋亡率和总凋亡率显著升高(P<0.01、P<0.05)。4mg/mL剂量组晚期凋亡和坏死细胞率显著升高(P<0.01)。如图4所示,随着桦褐孔菌浓度升高,晚期凋亡和坏死细胞率亦升高。
2.4 流式细胞仪检测细胞周期分布
如表3所示,桦褐孔菌孵育A549细胞处理24h后4mg/mL剂量组A549细胞G2/M期细胞显著升高(P<0.01),12mg/mL剂量组A549细胞G0/G1期细胞显著升高(P<0.05、P<0.01),1、2、4mg/mL剂量组S期细胞显著降低(P<0.05、P<0.01、P<0.01)。如表4所示,处理48h后各剂量组A549细胞G0/G1期细胞显著升高(P<0.01),S期细胞显著降低(P<0.05),4mg/mL剂量组G2/M期细胞显著升高(P<0.05)。
3 讨论
研究表明,桦褐孔菌对乳腺癌、胃癌、皮肤癌、肺癌、卵巢癌等多种恶性肿瘤细胞有抑制作用,其抗肿瘤机制主要可能是通过影响肿瘤细胞周期、抑制其增殖、诱导肿瘤细胞凋亡等途径发挥作用[8-11]。目前肺癌缺乏有效的治疗手段,在中药中找到能够抑制肿瘤的高效低毒性的药物成为研究的热点之一。CCK-8法是一种操作简便、灵敏度高、步骤少、结果准确可靠、重复性好的细胞活性检测方法,对实验者和环境危害低[12-13]。本研究使用人肺癌A549细胞,运用CCK-8试剂盒检测细胞增殖活性,使用流式细胞仪检测细胞凋亡和细胞周期,评价桦褐孔菌诱导人肺癌A549细胞凋亡和周期阻滞的作用。本研究发现,桦褐孔菌可降低A549细胞活力,进而由流式细胞仪检测结果发现桦褐孔菌可以诱导A549细胞凋亡。肺腺癌主要与肿瘤细胞周期紊乱进而引起细胞过度生长、增殖有关。细胞周期依赖性激酶(CDK)和细胞周期蛋白(Cyclin)调节细胞周期的进展,在细胞有丝分裂周期不同时段起重要作用,可引起细胞周期失衡,导致细胞生长、分化障碍,后导致细胞的恶性增殖,肿瘤随之发生[14]。Youn等[15]研究發现,桦褐孔菌提取物使肝癌HepG2细胞阻滞于G0 /G1期,并通过抑制CDK6、CDK4、CDK2、CyclinE、CyclinD1、CyclinD2抑制肿瘤细胞生长。王文娟[16]等研究发现,桦褐孔菌提取物能够显著抑制肝癌HepG2细胞的增殖,桦褐孔菌提取物使肿瘤细胞阻滞在G2期,使细胞增殖受到抑制。本研究发现,4mg/mL桦褐孔菌与A549细胞孵育24h后,G2/M期细胞显著增加至22.12%(P<0.01,对照组为12.5%);孵育48h后,G0/G1期显著增加至68.87%(P<0.01,对照组为59.87%),使细胞周期阻滞于G2/M和G0/G1期。
本研究发现,桦褐孔菌对人肺癌细胞有诱导凋亡和周期阻滞作用,使A549细胞产生G2/M期和G0/G1期阻滞,为桦褐孔菌成为抗肺癌的物质提供了科学依据,为下一步作用机制研究打下实验基础。
参考文献
[1]王李俊,杨琴,王飞,等.桦褐孔菌醇诱导人乳腺癌MCF-7细胞凋亡的分子机制研究[J].中草药,2016,47(6):970-973.
[2]刘婷婷,邢青斌,程家丽,等.桦褐孔菌氨基酸含量测定方法的建立[J].营养学报,2017,39(5):504-506.
[3]吴昆,程文明,李春如,等.桦褐孔菌抗肿瘤活性部位的筛选及化学成分研究[J].安徽医科大学学报,2016,51(10):1468-1472.
[4]Staniszewska Justyna,Szymański Marcin,Ignatowicz Ewa.Antitumor and immunomodulatory activity of Inonotus obliquus[J].Herba Polonica,2017,63(2):48-58.
[5]Konrad A.Szychowski,Kamila Rybczyńska-Tkaczyk,Jakub Tobiasz,et al.Biological and anticancer properties of Inonotus obliquus extracts[J].Process Biochemistry,2018(73):180-187.
[6]Satoru Arataa,b,Jun Watanabea,et al.Continuous intake of the Chaga mushroom (Inonotus obliquus)aqueous extract suppresses cancer progression and maintains body temperature in mice[J].Heliyon,2016,2(5):e00111.
[7]Lee,Seulki,Cho,Hyosun.Anti-tumor effect of Inonotus obliquus in xenograft animals with EBV+human gastric carcinoma[J].The Korean Journal of Microbiology,2016,52(4):482-486.
[8]马伟平,侯睿,陈正爱.桦褐孔菌抗肿瘤作用的研究进展[J].医学研究生学报,2017,30(4):440-443.
[9]于婧璐,冯晓玲.桦褐孔菌抗肿瘤机制的研究进展[J].实用肿瘤学杂志,2017,31(1):69-72.
[10]Chung MJ,Chung CK,Jeong Y,et al.Anticancer activity of subfractions containing pure compounds of Chaga mushroom (Inonotus obliquus)extract in human cancer cells and in Balb/c mice bearing Sarcoma-180 cells[J].Nutr Res Pract,2010,4(3):177-182.
[11]Zhong XH,Ken K,Lvs J,et al.Progress of research on inonotus obliquus[J].Chin J Integr Med,2009,15(2):156-160.
[12]Tominaga H,Ishiyamam,Ohsetof,et al.A water-soluble tetrazolium salt useful for colorimetric cell viability assay[J].Analytical Communications,1999(36):47-50.
[13]熊建文,肖化,张镇西.MTT法和CCK-8法检测细胞活性之测试条件比较[J].激光生物学报,2007,16(5):559-562.
[14]黎美琳,顾鹏.基质交联分子1表达下调对人胰腺癌SW1990细胞周期及细胞凋亡的影响[J].中华细胞与干细胞杂志(电子版),2017(5):265-270.
[15]Youn MJ,Kim JK,Park SY,et al.Chaga mushroom(Inonotus obliquus)induces G0 /G1 arrest and apoptosis in human hepatoma HepG2 cells[J].World J Gastroenterol,2008,14(4):511-517.
[16]王文娟,雒向宁,晁旭,等.桦褐孔菌提取物对人肝癌HePG2细胞增殖及凋亡的影响[J].陕西医学杂志,2013,42(7):783-785.
Abstract:Objective To study apoptosis and cycle arrest of lung cancer cells induced by Inonotus obliquus,and provide new evidence for anti-tumor therapy of Inonotus obliquus.MethodHuman lung cancer cell line A549 was incubated with different concentrations of Inonotus obliquus.Cell viability was measured by CCK-8 method.Apoptosis and cell cycle were detected by flow cytometry.Result Inonotus obliquus inhibitted the growth and induced apoptosis of A549 cells.The results of the Inonotus obliquus groups on the concentrations of 2 mg/mL and 4 mg/mL were compared with control group.Viable cell percentages were significantly decreased to 83.32% and 69.27%,respectively (P<0.05,92.11% in the control group),the early apoptotic rate significantly increased to 6.47% and 8.07% (P<0.01,1.98% in control group),the total apoptotic rate significantly increased to 14.27% and 27.54% (P<0.05,5.91% in control group),the late apoptosis rate significantly increased to 7.8% (P>0.05)and 19.48% (P<0.01,3.94% in control group).Compared with the control group,the cells in G2/M phase increased significantly to 22.12% after incubating A549 cells with 4mg/mL Inonotus obliquus for 24h (P<0.01,12.5% in control group),the cells in G0/G1 phase increased significantly to 68.87% after incubating A549 cells for 48h (P<0.01,59.87% in control group).Conclusion Inonotus obliquus can induce the apoptosis of A549 cells,and arrest cells in G0/G1 phase and G2/M phase.
Keywords:Inonotus obliquus;A549 cells;apoptosis;cell cycle
(責任编辑 唐建敏)

