牛乳中沙门氏菌的荧光定量PCR检测方法的建立
姚笛,徐磊,佐兆杭,侯婷婷,郭瑜
(黑龙江八一农垦大学食品学院,黑龙江大庆163319)
0 引言
牛乳营养价值较高,同时易遭受致病菌污染[1]。沙门氏菌属(Salmonella)[2]可污染食品,引发食物中毒。据统计,沙门氏菌引起的食物中毒在细菌性食物中毒中位列榜首[3-6]。因此,建立一种快速的沙门氏菌检测方法尤为重要。目前,沙门氏菌检测方法有培养法、免疫法和PCR方法等[7,8],国家标准规定的沙门氏菌检测方法为微生物培养法,该方法存在操作时间长、特异性和灵敏度低等缺点[9-11],免疫学方法由于非特异性吸附易出现假阳性,而PCR方法不能对样品进行定量分析[12-13]。invA是沙门氏菌的保守基因,有研究利用PCR方法对动物性食品的invA基因进行了特异性扩增[14-17]。因此,本研究建立一种牛乳中沙门氏菌invA基因的荧光定量PCR快速检测方法,为牛乳中致病菌的快速检测提供方法学参考。
1 实验
1.1 材料
1.1.1 菌株
沙门氏菌、志贺氏菌、蜡样芽孢杆菌等菌种为黑龙江八一农垦大学食品生物技术实验室保存;载体PMD-18 T载体。
1.1.2 试剂
LB培养基,TaKaRa ExTaqTM(5 U/μL),rTaq(5 U/μL),MgCl2(25 mmol/L),dNTPs(10 mmol/L),DL2000DNAMarker,6×Loading Buffer,SYBR Premix Ex TaqTM(Tli RNaseH Plus)等;细菌基因组DNA和质粒抽提等试剂盒。
1.1.3 主要仪器
PCR基因扩增仪(9700型),凝胶成像系统(YJ600+型),Real-Time PCR仪(Line-Gene K型),台式离心机(TGL-16B)。
1.2 方法
1.2.1 菌株培养和DNA模板的制备
将沙门氏菌菌种接种于LB固体培养基中进行活化,37℃培养24 h,挑单菌落接种LB液体培养基,转速为180 r/min,37℃培养12 h。离心获得菌体后提取菌体DNA,具体操作按照细菌基因组DNA提取试剂盒操作说明书进行。
1.2.2 引物的合成
根据GenBank中的沙门氏菌的invA基因序列,利用Primer 5软件设计符合荧光定量PCR扩增要求的特异性引物,引物由上海生工生物工程有限公司合成,预期扩增片段大小约为190 bp。引物序列如下:
上游引物为5'-CGCTCTTTCGTCTGGCATT-3';
下游引物为5'-GACCACGGTGACAATAGAG-3'。
1.2.3 目的基因的扩增和克隆
利用沙门氏菌的invA基因特异性引物,以提取的菌体DNA为模板进行目的基因的PCR扩增,扩增条件为:95℃预变性3 min,95℃变性30 s,55℃退火30 s,72℃延伸30 s,经30个循环;72℃10 min。扩增后的目的片段利用胶回收试剂盒进行纯化,具体操作见说明书。扩增和纯化后的目的片段经1.5%琼脂糖凝胶电泳进行验证。然后将纯化后的目的基因与p MD-18 T载体连接,转化E.coli DH 5α感受态细胞,具体操作按照说明书进行,获得目标基因的克隆载体pMD-18 T-invA,提取重组质粒并进行PCR鉴定,将鉴定正确的质粒进行测序。
1.2.4 重组质粒标准曲线的绘制
测定重组质粒浓度并计算拷贝数,然后对重组质粒进行10倍系列稀释,以不同稀释倍数的质粒为模板进行定量PCR扩增[18]。定量PCR的反应体系为:SYBR Premix Ex Tap(2X)(Tli RNaseH Plus)12.5μL,上、下游引物(10μmol/L)各0.5μL,DNA模板1.0 μL,ddH2O 10.5μL。反应条件为94℃(30 s)灭活酶,95℃(5 s)变性,60℃(20 s)退火、延伸,扩增45个循环。反应结束后,系统自动形成标准曲线。
1.2.5 特异性检测
利用建立的荧光定量PCR检测方法,以invA基因的上、下游引物分别对沙门氏菌及其他3种牛乳中常见致病菌(大肠杆菌、志贺氏菌、蜡样芽孢杆菌)同时进行扩增,进一步确定建立的沙门氏菌荧光定量PCR检测方法的特异性。
1.2.6 灵敏性检测
对确定浓度的沙门氏菌DNA进行10倍系列稀释,以不同浓度的DNA为模板进行扩增,测定其灵敏性。
1.2.7 模拟标本的检测
对沙门氏菌菌液进行10倍系列稀释,测定菌落总数,牛乳灭菌后掺入一定数量的沙门氏菌,分别为4.42×104,4.42×103,4.42×102,44.2 mL-1;混匀后提取牛乳的基因组DNA,然后相同条件下以DNA为模板进行扩增。
2 结果与分析
2.1 沙门氏菌invA基因片段的PCR扩增结果与序列分析
沙门氏菌invA基因片段的PCR扩增结果如图1所示,重组质粒的鉴定结果如图2所示。由图1和图2可以看出,片段大小对应Marker 200 bp处,与预期扩增片段大小相符合。重组质粒的测序结果经BLAST比对后发现与沙门氏菌invA基因的同源性为100%。图中,M为DL2000 DNA Marker;1为沙门氏菌invA基因重组质粒的PCR扩增产物。
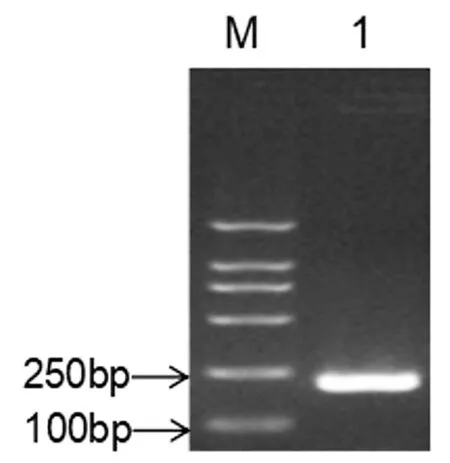
图1 invA基因的PCR扩增
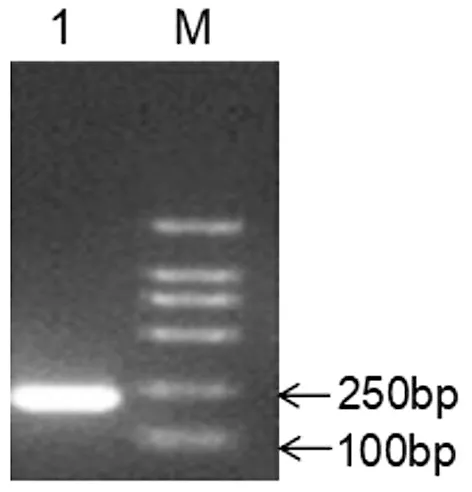
图2 invA基因重组质粒的PCR鉴定结果
2.2 荧光定量PCR扩增结果
测定沙门氏菌invA基因重组质粒的质量浓度为56.9 ng/uL,对重组质粒进行系列稀释,浓度分别为1×105,1×106,1×107,1×108,1×109拷贝数/μL,以稀释的不同浓度质粒为模板进行荧光定量PCR扩增,获得扩增曲线,如图3所示。
依据上述质粒模板的扩增曲线,以不同拷贝的质粒模板的对数为横坐标,以扩增的循环数为纵坐标绘制标准曲线,结果如图4所示,获得的标准曲线方程为y=-3.334x+38.15,R2为0.9883,当质粒浓度在105~109拷贝数/μL时,质粒浓度与扩增循环数的线性关系较好。
不同浓度质粒模板的扩增熔解曲线如图5所示。由图5可以看出,不同浓度质粒模板的扩增产物的溶解温度均为84.7℃。

图4 标准模板的标准曲线
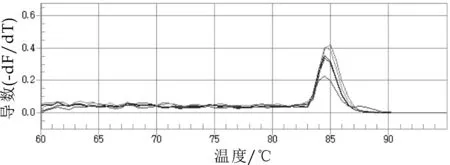
图5 标准模板的qRT-PCR熔解曲线
2.3 荧光定量PCR的特异性检测
以invA基因的上下游引物对沙门氏菌等4种牛乳中常见致病菌模板进行荧光定量PCR扩增,结果如图6所示。由图6可以看出,只获得一条沙门氏菌的扩增曲线,其他3种致病菌未见特异性扩增,即无交叉反应现象,因此,建立的沙门氏菌的荧光定量PCR方法的特异性较好。
图6 qRT-PCR特异性检测
2.4 荧光定量PCR的灵敏性检测
将沙门氏菌DNA分别稀释成质量浓度为1×10-3,1×10-4,1×10-5,1×10-6,1×10-7ng/μL;以不同质量浓度的DNA为模板进行扩增,扩增曲线如图7所示。由图7可以看出:其最低检出限为1×10-7ng/μL,即当DNA质量浓度只有1×10-7ng/μL时,根据公式拷贝数/μL=(6.02×1023)×(ng/μL×10-9)/(DNA length×660)计算出拷贝数为32.44拷贝数/μL时仍然能够检测到,说明建立的沙门氏菌qRT-PCR检测方法的灵敏性较好。
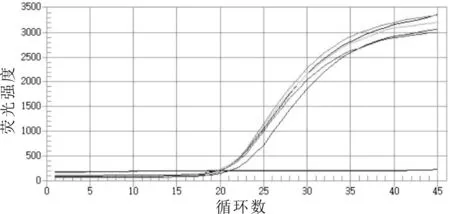
图7 沙门氏菌的qRT-PCR灵敏性检测
2.5 掺菌乳样的检测
在灭菌的牛乳中掺入不同菌落总数的沙门氏菌,使牛乳中菌的含量分别为4.42×104,4.42×103,4.42×102,44.2 mL-1;利用建立的方法进行检测,结果如图8所示。
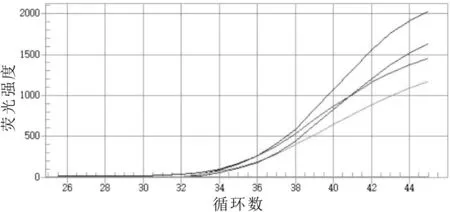
图8 模拟标本的荧光定量PCR扩增曲线
由图8可以看出:当乳中沙门氏菌的含量只有44.2 mL-1时,仍可获得扩增曲线,同时根据国标方法(GB 4789.4-2016)检测掺有相同菌落数的沙门氏菌,仅能够检测到4.42×102mL-1,说明建立的检测方法的灵敏性好于国家标准。
3 讨论
有关牛乳的细菌污染一直是重点检测项目,特别是对肠道致病菌沙门氏菌的检测[19]。沙门氏菌是一种常见的重要人畜共患病原菌,它不仅能导致鸡白痢、仔猪副伤寒、流产等动物疾病,还能使人类发生伤寒、败血症、食物中毒和胃肠炎。在世界各地的食物中毒中,沙门氏菌引起的中毒病多例占首位[20]。沙门氏菌作为致病菌检测的一项重要指标,在公共卫生、食品卫生、畜牧兽医和出入境检验检疫中均有重要意义。但沙门氏菌有3 000个以上的血清型及复杂的各类生化反应型,使常规检验程序复杂繁琐、耗时费力,不仅给检验部门带来沉重的负担,而且还使生产部门产品运输和仓储的时间延长,费用增加[21-22]。因此灵敏度高、特异性强、重复性好、简易、经济的检测方法是发展的方向。
以沙门氏菌侵袭蛋白基因invA作为扩增目标,该基因在几乎所有血清型沙门氏菌中高度保守,Upadhyay利用PCR方法扩增了19种不同沙门氏菌血清型的invA基因中284bp片段,均获得特异性扩增[23]。因此,本研究选择特异性序列进行引物合成,结合荧光定量PCR的引物设计要求,选择了扩增片段大小为149 bp的invA引物,结果表明该引物具有良好的特异性。通过试验不断筛选合适的引物浓度、PCR反应体系、退火温度等条件,可以保证PCR的稳定性和可重复性。荧光定量PCR检测沙门氏菌的全部操作过程需要4 h左右,不仅大大提高了工作效率,并且除去需加样的步骤外,其他的全部过程都在密闭的PCR管中完成,可以有效的避免由外界环境带来的误差。具有的快速、准确、灵敏度高、操作简便、特异性好等特点。可同步完成许多个样品的同时扩增及定量,适宜于大批样品的检测处理,极大地提高了检测时限,为食品污染的监测和食物中毒事件的快速反应提供了技术支持。尽管实时定量PCR检测设备较昂贵,但由于其能对样品中细菌污染进行定量,且灵敏度高于传统PCR,更易于自动化,必然会成为细菌检测的常规手段。

