产B族维生素植物乳杆菌的来源及其在发酵食品中的应用
郝一江,杨贞耐,张健
(北京工商大学北京食品营养与人类健康高精尖创新中心,北京100048)
B族维生素是维持人体正常机能与代谢活动不可或缺的维生素,但由于饮食结构和烹饪方法等原因,B族维生素缺乏现象仍较为普遍,美国维生素B12严重缺乏发生率9%[1],欧洲地区B12缺乏发生率20%左右[2]。我国的维生素缺乏存在人口和地域差异[3]、孕妇叶酸缺乏情况较更为普遍[4]。我国的“国民营养计划(2017-2030年)”明确提出2030年将孕妇叶酸缺乏率控制在5%以下[5]。
植物乳杆菌是乳酸菌中是少有的能同时合成叶酸和核黄素的乳酸菌[6]。植物乳杆菌核黄素的产量是其它乳酸菌的2-3倍[7],叶酸产量是其它乳酸菌的3-4倍,维生素B12的产量是其它菌株的3~5倍[8]。此外,植物乳杆菌在人体肠道中广泛存在[9],能够直接通过调节肠道菌群为宿主提供维生素[10]。
0 引言
1 产核黄素植物乳杆菌及应用
1.1 产核黄素菌株的筛选
核黄素是辅酶黄素单核苷酸(FMN)和黄素腺嘌呤二核苷酸(FAD)的前体,在涉及酶如烟酰胺腺嘌呤二核苷酸(NADH)等生物氧化还原反应中起氢载体的作用[15],对铁元素的吸收与代谢、高血压[16],免疫调节,DNA损伤修复等具有重要作用[17]。核黄素在乳制品、肉类和谷物中含量较高[18],但超过90%的核黄素以易分解的黄素辅酶形式存在(US,1998)。世界范围内,亚临床核黄素缺乏较为普遍,不仅在发展中国家,美国和英国等富裕国家也是如此[19],美国和加拿大等国家因此出台了一些提高食品核黄素含量加工规范,缓解消费者核黄素缺乏[20]。
近年来随着人们对乳酸菌安全性认识的不断提高,寻找高产核黄素乳酸菌,通过发酵直接提高食品中的核黄素含量成为研究的热点[21],植物乳杆菌表现出了较强的核黄素合成能力。Juarez等比较了179株不同来源乳酸菌的核黄素产量,植物乳杆菌CRL 725的核黄素合成能力最强(700±20)μg/L,玫瑰黄诱变后,在酸豆乳中产量提高到了(1860±20)μg/L[35]。从牛乳中分离的植物乳杆菌LZ227,含有完整的核黄素合成基因,合成量显著高于干酪乳杆菌[22],婴儿粪便中分离的植物乳杆菌LZ 95也具有较高的核黄素合成能力[23],面粉中分离的植物乳杆菌在液体培养基中的核黄素产量为488~642μg/L[24]。与商业化核黄素生产微生物相比,这些来源的菌株安全性更高,适于开发不同种类的发酵和功能性食品。
体内应用结果显示,产核黄素植物乳杆菌CRL 2130发酵制备的酸豆乳能有效治疗小鼠的核黄素缺乏症状,疗效与药物相似,能有效防治低核黄素饮食诱发的核黄素缺乏症[25]。产核黄素植物乳杆菌发酵的酸豆乳对肠炎模型小鼠的炎症具有明显的缓解作用,血清中的细胞因子水平显著降低[26],直接灌喂菌株也有效缓解了小鼠肠炎,表现为肠绒毛变长,腹泻减轻,炎症因子和细胞因子(IL-10)水平降低[27],另外对斑马鱼B族维生素缺乏导致的焦虑行为也有明显的治疗作用[28]。用产核黄素植物乳杆菌发酵面团制作的面包,面包的核黄素质量分数从2.41μg/g增加到6.81μg/g,该质量分数达到欧盟建议摄入量(EU RDA)的42.5%,用其制作的意大利面煮熟后的核黄素质量分数为2.89μg/g,是商品面条的近6倍[24],这表明即使经过高温烘烤和蒸煮,发酵食品的核黄素含量保持较高的水平。
1.2 植物乳杆菌合成核黄素菌株的关键基因及合成调控
明确参与植物乳杆菌核黄素合成的基因,是调控和提高核黄素产量的前提。目前已发现的参与核黄素表达的rib关键操纵子包括ribH,ribA,ribB和ribG,其功能如图1所示。菌株基因组中缺少这些rib操纵子或操纵子构成不完整的一般不能合成核黄素[22]。分析rib操纵子基因已成为快速筛选产核黄素乳酸菌的有效方法。另外,ribC具有双重功能,同时负责编码黄素激酶和FAD合成酶,催化核黄素转化成两种活性形式FMN和FAD。位于操纵子上游的调控区域(RFN元件)含有用于调节核黄素生物合成和运输的遗传信息,许多微生物中不含有RFN元件[29]。过表达rib(A,B,G,H)合成相关基因,突变RFN元件或ribC基因,或下调和阻断细胞内嘌呤代谢通路、增加胞内GTP(见图1)的含量可以提高核黄素表达量[30],其中下调AMP代谢通路可将核黄素表达量提高5.4倍[31]。
但基因工程手段的应用受到政策法规和消费者偏好等因素的限制,目前植物乳杆菌的核黄素合成优化方法仅限于用嘌呤[32]、核黄素类似物(玫瑰黄素)筛选自然突变体[33]或培养基优化。玫瑰黄素法最早报道于芽孢杆菌,将菌株暴露于含有玫瑰黄素的培养基中(100 mg/L),能够获得高产核黄素的突变株[34]。培养基优化主要以化学培养基(CDM)为基础考察碳源、氮源、无机盐、微量元素等对核黄素产量的影响,蔗糖培养产量高于葡萄糖,30℃培养产量高于37℃,培养时间24 h,酸水解酪素10 g/L,鸟嘌呤核苷0.04 g/L核黄素产量最高,另外醋酸钠(30 g/L)和天冬氨酸(0.01~0.04 g/L)对核黄素的表达无显著影响[35]。总的来讲,目前植物乳杆菌产核黄素优化手段较少,提升效果不高,仍需要进一步研究。

图1 植物乳杆菌核黄素合成途径[36]
图1 中,ribG为核黄素脱氨酶和还原酶;ribB为核黄素合酶α亚基;ribA为催化合成酶,将核酮糖-5-磷酸形成3,4-二羟基-2-丁酮4-磷酸盐;ribH为核黄素合酶β亚基;RFN为调节核黄素生物合成和运输的保守区域。
2 产叶酸植物乳杆菌
2.1 产叶酸植物乳杆菌的筛选及应用
叶酸是由嘌呤、对氨基苯甲酸及多聚谷氨酸等组成的水溶性B族维生素,在酸性及光照环境易分解。叶酸具有抗肿瘤[37],缓解金属中毒[38],防治心脑血管疾病[39]及消化道疾病的功能,叶酸缺乏会导致胎儿及婴幼儿神经系统发育缺陷。人体自身无法合成叶酸,只能通过肠道微生物和食物供给。化学合成的产品补充叶酸,容易因为剂量控制不当,从而导致B12缺乏[40]、破坏肝脏二氢叶酸脱氢还原酶活性[41]、甚至致癌的风险[42]。研究显示植物乳杆菌产生的四氢叶酸在过量服用情况下未观察到这类副作用[43]。何树芬等综述了近年乳酸菌产叶酸的情况[44],发现乳酸菌中植物乳杆菌的产量最高(见图2),菌株SM 39叶酸产量达(397±60)ng/mL[45],是人体推荐日摄入量的24.01%,远高于其它乳酸菌。而近期报道的植物乳杆菌ATCC 14917发酵牛乳的叶酸产量更是高达63.23μg/mL[46],是目前已报道最高产量的150倍,同时检测的干酪乳杆菌和嗜酸乳杆菌的叶酸产量也高达45.41μg/mL和42.78μg/mL。另外,分离于谷物的植物乳杆菌叶酸产量93 ng/mL,分离于日本泡菜的植物乳杆菌叶酸产量为100 ng/mL,产量也高于同一来源的其它乳酸菌[47]。产叶酸植物乳杆菌发酵后酸乳能够显著增加小鼠血清叶酸质量浓度,降低同型半胱氨酸水平,缓解和防治叶酸缺乏症[48]。
2.2 植物乳杆菌合成叶酸的关键基因
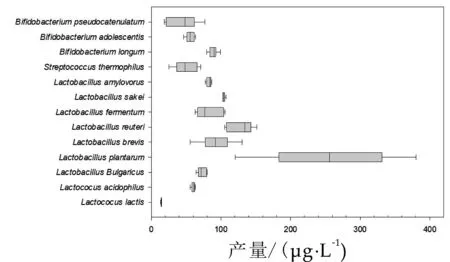
图2 不同种属乳酸菌的叶酸产量[44]
植物乳杆菌的叶酸合成主要通过喋呤代谢途径,代谢过程中GTP经过环化水解酶(E.C.3.5.4.16)催化生成7,8-二氢新喋呤三磷酸,经焦磷酸酶催化生成一磷酸,经非特异性磷酸酶催化生成7,8-二氢新喋呤,后经新喋呤醛缩酶(E.C.4.1.2.25)催化生成6-羟甲基-7,8-二氢喋呤,产物经磷焦磷酸转移酶(E.C.2.7.6.3)催化生成重要中间产物6-羟甲基-7,8-二氢喋呤焦磷酸(DHPPP),DHPPP在二氢喋酸合酶作用下与对氨基苯甲酸(pABA)结合生成叶酸前体二氢喋酸,最后经叶酰谷氨酸合酶及二氢叶酸还原酶(E.C.1.5.1.3)催化合成具有生物活性的四氢叶酸并分泌到细胞外[49]。上述关键酶分别由folE,folK,folB,folQ,folP,folC,folA等7个基因编码,这些基因的表达决定着菌株产叶酸的能力。植物乳杆菌是少有的能够高效表达这些基因的乳酸菌[49]。另外一条pABA代谢支路较为简单,分支酸在4-氨基-4-及裂解酶的作用下形成pABA,与DHPPP结合形成二氢喋酸并最终合成叶酸,对于其它无法通过喋呤代谢合成叶酸的乳杆菌,可通过添加pABA弥补合成路径缺失(见图3)。
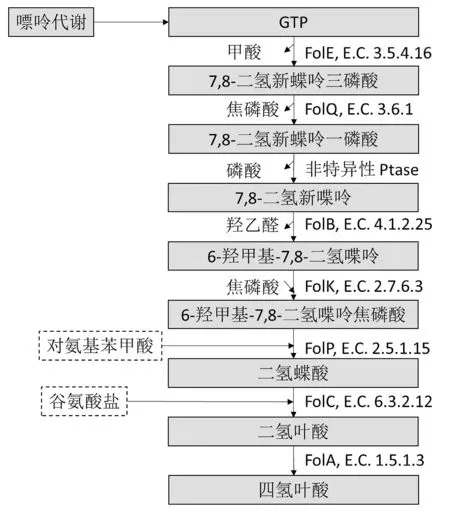
图3 植物乳杆菌WCFS1叶酸代谢通路(虚线框中为外源添加物)[45]
植物乳杆菌WCFS1是目前唯一报道的采用基因工程技术系统优化产叶酸的植物乳杆菌,改造后的菌株叶酸产量从29μg/L增加到3.28 mg/L,但改造后的菌株生长速度下降20%~25%,连续传代后(56代)产量会骤降为初始的1/40,仅有0.083 mg/L[50]。筛选自然高产突变株,目前看来也有一定困难,研究人员筛选了2万株植物乳杆菌WCFS1自然突变株,未发现叶酸表达上调菌株,但发现产叶酸菌株对甲氨蝶呤具有抗性,且呈现出量效关系,可用于诱导和筛选高产叶酸菌株[51]。目前对植物乳杆菌合成叶酸的分子机制并不完全清楚,例如很多菌株基因组中不含有folQ基因,但依然能够合成叶酸[44],这表明菌株体内可能存在替代性的通路,未来借助组学和系统生物学等手段,针对叶酸合成中的特定路径、关键基因、酶进行分析,解析植物乳杆菌生物合成叶酸的过程。
培养基和培养条件等外界因素对植物乳杆菌生成叶酸有较大影响。从合成通路看,在培养基中添加p ABA是促进植物乳杆菌产生叶酸的有效途径。添加酪氨酸会降低叶酸产量[52],酪氨酸、色氨酸和苯丙氨酸等[53]的前体是分支酸,推测酪氨酸含量增高时,会抑制上游分支酸合成通路,影响了pABA→分支酸合成通路,减少叶酸的合成。植物乳杆菌在发酵过程中(8~24 h)胞内和胞外的叶酸含量持续增加,菌体浓度达到9 mL-1(对数值)、pH值降低至5.0,此时叶酸产量达到最大值[47]。在合成速度上,植物乳杆菌受生长速度的限制慢于已报道的嗜热链球菌6 h达最大值[54]。另外,植物乳杆菌的叶酸合成具有明显的底物抑制特性,在含有叶酸的培养基菌株的产量为93 ng/mL,无叶酸培养基中产量为44 ng/mL[47]。食品基质中,植物乳杆菌在发酵乳中叶酸产量高于泡菜和谷物等食品[55]。另外,菌株间的共生作用也对植物乳杆菌叶酸产量有显著影响,费氏丙酸杆菌DF13与植物乳杆菌SM 39共培养,叶酸产量增加了20倍[56]。总体上看,目前对植物乳杆菌产叶酸的调控技术研究较少,针对特定培养基系统优化的数据也有限,需要进一步研究。
3 产钴胺素植物乳杆菌
3.1 产钴胺素植物乳杆菌的筛选与应用
钴胺素又称维生素B12,自然界中主要由微生物合成。钴胺素缺乏会导致贫血和神经系统脱髓鞘性疾病,严重贫血和吸收系统障碍患者,需要终生补充B12,大多数的钴胺素严重缺乏源于人体消化系统疾病导致的肠道内产钴胺素菌群减少和缺失[57],因此老年人为钴胺素缺乏的易发人群[58]。
植物乳杆菌是人体钴胺素的理想潜在供体。分离自母乳及婴儿粪便的59株乳杆菌产钴胺素能力进行了分析[59],发现仅植物乳杆菌BHM 10和BCF20产钴胺素,产量分别为(10.91±1.55)μg/L和(23.90±1.73)μg/L[59],优化后BCF20菌株的产量达到(102.549±11.857)μg/L,超过了相同培养条件下的瑞特乳杆菌DSM 20016((77.512±5.298)μg/L)和JCM 1112((22.5±0.9)μg/L),后二者是最常用的产钴胺素乳酸菌对照株。分离自婴幼儿粪便的屎肠球菌LZ 86钴胺素的产量更高达(499.8±83.7)μg/L[60]。但植物乳杆菌在已报道的植物食品中产量不高。印度草药kanjika中分离的植物乳杆菌钴胺素产量为13 ng/g(干细胞重量)[61]。日本泡菜中分离的植物乳杆菌CN-225钴胺素产量为2μg/L,相同培养的另外230株乳酸菌产量在0.2~2μg/L之间[6]。前述植物乳杆菌BHM 10在豆乳中优化后的产量为10μg/L,虽然这在已经高于已报道的发酵豆制品钴胺素质量分数0.7~8.0μg/100 g[62],但与在乳基质中20~100μg/L的产量相差较大,也有个别报道植物乳杆菌发酵椰汁饮料钴胺素质量浓度可达14 000μg/L[63]。目前筛选产钴胺素的植物乳杆菌目前主要采用三步法:第一,采用无钴胺素培养基培养,观察菌株生长情况;第二,在无钴胺素培养基中加入氯化钴培养,观察菌株生长情况;第三,检测菌株是否含有钴胺素合成基因。Bhushan等认为只采用第三步检测cbiK钴胺素合成基因的有无,就能有效确定乳杆菌的钴胺素合成能力[59]。
3.2 植物乳杆菌合成鈷安素的关键基因
钴胺素的微生物合成路径较为复杂。虽然NCBI数据库中已有多达57株植物乳杆菌完成了全基因组测序,但针对植物乳杆菌钴胺素合成基因的分析工作较少,通路目前还不完整。表1为已报道的植物乳杆菌与目前研究最清楚的瑞特乳杆菌钴胺素合成关键基因和酶的对比。之前LeBlanc比对了多种乳杆菌与瑞特乳杆菌基因组中钴胺素合成基因的差异,发现包括植物乳杆菌(WCFS1)在内的其它乳杆菌仅含有2-3个关键合成基因,缺失20个基因,错误认为其钴胺素合成能力可能较差[64]。但之后Bhushan的设计的5个钴胺素合成关键基因(cobT,cbiB,cbiA,cbiK和cbiP)引物在植物乳杆菌BHM 10和BCF20基因组中扩增到了目的基因片段[65],Turpin等也通过全基因组测序发现植物乳杆菌A6,含有cbiM和cobO基因[66]。与瑞特乳杆菌相比,虽然目前植物乳杆菌仍有多个合成关键基因有待研究确定,但植物乳杆菌与其它乳杆菌相比,并不缺少钴胺素合成基因。
培养条件研究发现,去除培养基中的异亮氨酸可导致乳杆菌停止合成钴胺素,添加半胱氨酸可以使瑞特乳杆菌的钴胺素产量提高20倍[67],这解释了为什么菌株在富含氨基酸的发酵豆制品中的钴胺素产量较高[68];加入钴胺素前体5-氨基乙酰丙酸和二甲基苯并咪唑可显著提高钴胺素产量[59];氯化钠、亚硝酸钠和乙醇的浓度,培养温度,初始p H值等条件与钴胺素的产量无显著相关性[6]。植物乳杆菌发酵肉制品产钴胺素研究较少。由于乳、肉等动物性食品是人体钴胺素的主要来源[69],未来也应开展植物乳杆菌在动物性食品中的钴胺素强化研究,满足多种饮食人群的摄入需求。
近期研究还发现,不同的植物乳杆菌产生钴胺素的组成不同,植物乳杆菌LZ95和CY2,钴胺素产量分别为(98±15)μg/L和(60±9)μg/L,但LZ 95培养物中同时检测到了腺苷钴胺素和甲基钴胺素,而CY2只检测到了腺苷钴胺素[60]。除了上述的核黄素,植物乳杆菌还能合成硫胺素(B1),烟酸(B3)和吡哆醇(B6)等B族维生素。
4 植物乳杆菌调节肠道菌群改善宿主维生素摄入水平
植物乳杆菌还具有众多优良益生特性,包括我国的植物乳杆菌ST-Ⅲ和P-8,及国外的299V,L-137,WCFS1,91,423,PH 04,28,p17630等;这些菌株具有抑菌[11]、抗炎[12]、增强免疫[13]、改善消化机能等多种生理活性[14]。肠道菌群是寄居在人体肠道内的微生物群落,参与人体食物的消化、能量的代谢等多种生理活动,是人体维生素的重要供应者[64],参与合成多种B族维生素,包括硫胺素(B1)、核黄素(B2)、烟酰胺(B3)、泛酸(B5)、吡哆辛(B6)、生物素(B7)、叶酸(B11)和钴胺素(B12)。因此,可以通过摄入产维生素菌株,增加肠道中产维生素菌群的丰度,提高肠道菌群维生素的产量,改善宿主的维生素缺乏状况,有研究证明这一方案有效[70]。但实际过程可能很复杂,与膳食性维生素在小肠内吸收不同,肠道菌群产生的维生素吸收主要在结肠部位[71],要求外源干预菌株要能在结肠中有效定植;另外,外源干预菌株产生的维生素有时并不能被宿主直接吸收,以维生素B12为例,宏基因组学研究发现,当肠道中出现B12时,肠道菌群会调动多个转运基因去识别B12分子,并竞争性的利用B12,改变自身的丰度。因此,要求干预肠道菌群的菌株在肠道内具有较强的定植和共生性,在成为优势菌群的同时,可能需要具备改变菌群整体代谢的能力才能有效供应宿主的维生素需求。

表1 已报道的乳杆菌钴胺素合成基因[57,62-64]
相比其它乳酸菌,植物乳杆菌在介导肠道菌群补充宿主B族维生素水平具有突出的优势。首先,植物乳杆菌是人体肠道内的高丰度菌株,外源摄入后具有突出的定植能力。美国65%素食和25%杂食人群的肠道内均能检出植物乳杆菌[9],北欧人群肠道内丰度最高乳杆菌是植物乳杆菌(52%),丰度比排在第二位鼠李糖乳杆菌高一倍,是干酪乳杆菌和瑞特乳杆菌的25倍[72]。本实验室的动物研究还发现,植物乳杆菌肠道定植能力很强,灌喂植物乳杆菌能显著改变小鼠结肠菌群的组成和结构[11],且在停止灌喂1周后,结肠内仍有较高丰度的植物乳杆菌[73]。摄入高产叶酸的植物乳杆菌发酵乳后,小鼠血清中的叶酸含量显著提高[48],植物乳杆菌在调节肠道菌群,改善宿主B族维生素缺乏方面具有良好的作用。目前对中国人群肠道菌群中植物乳杆菌的丰度,及产B族维生素植物乳杆菌干预肠道菌群的方式和机制仍知之甚少。
鉴于植物乳杆菌在产B族维生素方面的优势,良好的益生特性和肠道菌群定植、肠道菌群调节能力,未来在优化植物乳杆菌维生素合成的基础上,明确其肠道定植菌群调节机制、调控策略,开发富含B族维生素的发酵食品,防治B族维生素缺乏等方面具有良好的前景。

