贝莱斯芽孢杆菌DJB5的生物安全性评价
唐萍 代飞燕 吴毅歆 叶敏 何月秋





摘要:【目的】研究貝莱斯芽孢杆菌DJB5的生物安全性,为DJB5的开发和安全使用打下基础。【方法】参考微生物菌剂安全性的相关标准,通过灌胃DJB5菌体和发酵液的方式测定DJB5对昆明小鼠的急性经口毒性;通过腹腔注射菌体的方法研究DJB5的致病性;测试DJB5对昆明小鼠的急性眼刺激性、皮肤刺激性和溶血性;用纸片琼脂扩散法检测DJB5的抗菌药物敏感性。【结果】DJB5菌体对昆明小鼠的急性经口半致死剂量(LD50)>5000 mg/kg,灌胃菌体(5000 mg/kg BW)及5和10倍发酵上清浓缩液14 d后,昆明小鼠的体征、各脏器石蜡切片、血相和生化指标与对照组无显著差异(P>0.05,下同);腹腔注射DJB5菌体(500 mg/kg BW)后,处理组昆明小鼠的脏器系数和体重与对照组无显著差异;DJB5对昆明小鼠眼和皮肤无刺激性、无溶血性,且对受试的青霉素G、头孢唑林、丁胺卡那、庆大霉素、红霉素、诺氟沙星、环丙沙星、复方新诺明和氯霉素等9种抗菌药物敏感。【结论】贝莱斯芽孢杆菌DJB5及其发酵液的生物安全性高,具有开发成防治玉米贮藏期黄曲霉制剂的潜力。
关键词: 贝莱斯芽孢杆菌DJB5;生物安全性;抗生素;黄曲霉
中图分类号: S182 文献标志码: A 文章编号:2095-1191(2019)12-2720-08
Biosafety evaluation of Bacillus velezensis DJB5
TANG Ping1, DAI Fei-yan2, WU Yi-xin3,4, YE Min1*, HE Yue-qiu3,4*
(1College of Plant Protection, Yunnan Agricultural University, Kunming 650201, China; 2College of Animal Medicine, Yunnan Agricultural University, Kunming 650201, China; 3College of Agronomy and Biotechnology, Yunnan Agricultural University,Kunming 650201, China; 4National and Local Joint Engineering Center for
Screening and Application of Microbial Strains, Kunming 650217, China)
Abstract:【Objective】The biosafety of Bacillus velezensis DJB5 was studied to lay a foundation for the development and safe application of DJB5. 【Method】Based on standards of microbial agent safety, the acute oral toxicity was studied with stomach perfusion of DJB5 bacterial cells and fermentation supernatant, and pathogenicity was determined by the ways of intraperitoneal injections. Acute eyes, skin irritations and hemolytic tests were proceeded in Kunming mice. Antibiotic resistance was also tested by agar diffusion method. 【Result】The results displayed that its acute oral toxicity median lethal dose(LD50) was >5000 DJB5 cells/kg, stomach filling with maximum 5000 mg/kg BW DJB5 and 5 and 10 times of concentrated formulated suspension for 14 d did not cause significant differences of body sign, organs section, hemogram biochemical indicators with negative control(P>0.05, the same below). Intraperitoneal injection with 5000 mg/kg BW DJB5 did not cause any difference of Kunming mouse’s organ coefficient and weight with negative control. Strain DJB5 did not irritate Kunming mouse’s eyes and skin. It did not show hemolysis, but was sensitive to nine antibiotics including penicillin G, cefazolin, amikacin, gentamicin, erythrocin, norfloxacin, ciprofloxacin, selectrin, and chloramphenicol. 【Conclusion】Results indicates that strain DJB5 and its formulated suspension are biologically safe and has the potential to develop a biocontrol agent to control Aspergillus flavus.
Key words: Bacillus velezensis DJB5; biosafety; antibiotics; Aspergillus flavus
0 引言
【研究意义】一直以来,人类用化学农药防治作物病虫害,但长期使用化学农药带来的负面影响使人们把目光逐渐转向环境相容性好和生物选择性高的生物防治,生防物质的开发成为作物病虫害防治研究热点。随着科技的发展,人们对生物防治的理论认识逐渐深入,越来越多的生防物质被筛选出来并投入到环境中,在植物病虫害防治及作物促生长方面发挥了积极作用,减少了化学农药的使用。然而,随着研究的深入发现并非所有的生防物质都安全,人们开始质疑传统生物防治“无污染、无破坏、安全无毒”的概念。目前对于生防物质的研究主要集中在其产生的效应及作用机理方面,而忽略其生物安全性,如果投入到环境中的功能微生物对生态环境和人类不安全,该生防物质通过食物链和作物残留将成为新的污染物甚至是有毒物质,那么生防物质的筛选和研究将失去意义(Borriello et al.,2003;Skrobek and Butt,2005)。因此,在生防菌开发应用前对其进行安全性研究显得格外重要。【前人研究进展】来源于土壤的洋葱伯克氏细菌(Burkholderia cepacia,简称Bc)能促进植物生长,且能防治由卵菌及其他真菌引起的土传病害(Parke and Gurian-Sherman,2001),其作为有效的生防制剂已在国内外注册并使用,但研究发现很难区分洋葱伯克氏生防菌和人体致病菌,意味着分离于自然环境中的Bc生防菌存在对人体致病的潜在风险(罗远婵和谢关林,2005)。近年来,为降低Bc菌带来的致病威胁,美国环保署限制了Bc生防菌的使用方式和用量,并对其进行撤销登记和禁用管理(Jennifer,2000)。樊龙江等(2003)发现转Bt(苏云金芽孢杆菌,Bacillus thuringiensis)杀虫蛋白基因的水稻花粉漂落在桑叶上的数量为92.9粒/cm2时,会明显影响家蚕的生长发育,该研究认为南方养蚕地区推广转Bt基因水稻对蚕有负面影响。有研究表明,活体微生物作为益生菌,其耐药基因在肠道中转移给病原菌的风险会增大(Salyers et al.,2004;Mathur and singh,2005),明串珠菌(Leuconostobiaceae)和片球菌(Pediococcus)可获得来自乳酸菌(Lactococcus)的耐药性质粒(Sablon et al.,2000)。解淀粉芽孢杆菌(B. amyloliquefaciens)和枯草芽孢杆菌(B. subtilis)是常用的生物防治菌种,但研究发现部分菌株能产生对红细胞有溶血作用的溶血素(Sansinenea and Ortiz,2011;Nasir and Besson,2012),其溶血性限制了功能菌株的应用(Liu et al.,2010;Teixeira et al.,2013;Algburi et al.,2016)。马鸣超等(2016)收集了23株微生物肥料功能曲霉菌,并对其进行产黄曲霉毒素检测,结果发现寄生曲霉(Aspergillus parasiticus)CGMCC3.4407能產生至少1×103 μg/kg以上的黄曲霉毒素B1。由此可见,为保障人类健康和环境安全,必须对生物技术及其产品进行科学评价,采取严格的管理和控制措施,以降低其对人类和环境影响的风险(Qian et al.,2007)。【本研究切入点】芽孢杆菌具有许多有价值的性状和较好的生防功能(Ongena and Jacques,2008;Foster and Woodruff,2010),在过去的半个世纪里,从芽孢杆菌中分离到上百个具有生物活性的次生代谢产物,这些次生代谢产物使得芽孢杆菌在众多领域具有很强的应用潜力(Stein,2010;邹远军等,2017)。云南农业大学生物防治实验室(以下简称本实验室)从叠鞘石斛(Dendrobium aurantiacum)植株中分离到具有广谱抑菌作用的贝莱斯芽孢杆菌(B. velezensis)DJB5(以下简称DJB5),其对黄曲霉具有较好的抑制生长和降解毒素作用(袁远等,2019)。贝莱斯芽孢杆菌是芽孢杆菌属的一个种,其与很多芽孢杆菌一样能产生多种抗菌次生代谢产物,已有多株贝莱斯芽孢杆菌被筛选出来,在植物病害生物防治中具有极大的潜力(Palazzinia et al.,2016;孙平平等,2018),但目前关于DJB5生物安全性的研究尚无报道。【拟解决的关键问题】为明确DJB5的生物安全性,参考微生物菌剂安全性的相关标准,从急性毒性、致病性、眼部刺激性、皮肤刺激性、溶血性和抗菌药物敏感性等方面研究DJB5的生物安全性,为DJB5安全应用于玉米储藏期黄曲霉污染防治提供理论依据。
1 材料与方法
1. 1 试验材料
1. 1. 1 供试菌株 DJB5由本课题组从云南省普洱市叠鞘石斛中分离获得。
1. 1. 2 供试动物 体重18~22 g的SPF级昆明小鼠,雌雄各半,供试小鼠及饲料均购自昆明医学院试验中心(许可证号SCXK滇K2015-0002)。昆明小鼠健康,符合试验动物质量要求,在小鼠实验动物房适应性饲养5 d后投入试验,动物房室温控制在(22±3)℃,相对湿度35%~65%,换气次数10~20次/h,正常昼夜交替照明。
1. 1. 3 试验仪器 HC-3018R台式高速冷冻离心机、DIRUI CS-400B生化仪、mindray BC-2800vet血液细胞分析仪、FD5-series冷冻干燥机、Pannoramic 250/MIDI扫描仪、JJ-12J脱水机、JB-P5包埋机、Nikon Eclipse CI正置光学显微镜、Nikon DS-U3成像系统、1/10000 CP214 OHAUS分析天平、SYQ-DSX-280B高压灭菌器和SHZ-82气浴恒温振荡器。
1. 2 试验方法
1. 2. 1 供试菌粉制备 冷冻保存的DJB5甘油菌株在LB培养基上划线活化培养,挑取单菌落接种至LB液体培养基中,于37 ℃下180 r/min摇瓶培养,发酵液离心后弃上清液,沉淀菌体用灭菌水清洗离心,再经冷冻干燥制得DJB5菌粉,活菌含量为2.5×1014 CFU/g。
1. 2. 2 供试发酵液制备 DJB5在LB培养基上活化培养,挑取单菌落接种至LB液体培养基中,于37 ℃下180 r/min摇瓶培养7 d,发酵液离心后收集上清液,并通过0.22 µm水系滤膜过滤除去菌体,再经冷冻干燥制得DJB5发酵上清液干燥物,干燥物用0.9%生理盐水稀释成5和10倍浓缩液。
1. 2. 3 急性经口毒性检测
1. 2. 3. 1 DJB5菌体经口毒性试验 参照NY/T 1109—2017《微生物肥料生物安全通用技术准则》中的最大限量法,选择体重20 g左右的健康昆明小鼠20只,雌雄各半。昆明小鼠禁食6 h后,以5000 mg/kg BW剂量一次性灌胃DJB5,菌体用0.9%生理盐水配制,灌胃体积为40 mL/kg BW,灌胃后禁食2 h,之后正常饲养并连续观察14 d,记录昆明小鼠的中毒症状和死亡情况。检查昆明小鼠器官的形态、颜色等,制作心脏、肝脏、肾脏、脾脏和肺脏石蜡切片观察病变情况。
1. 2. 3. 2 DJB5发酵上清液经口毒性试验 昆明小鼠随机分成3组,分别为对照组、发酵上清液5倍液组和10倍液组,每组20只,雌雄各半。昆明小鼠处理前禁食6 h,每只昆明小鼠一次性灌胃0.8 mL发酵液,灌胃后禁食2 h,之后正常饲养。灌胃处理后3和14 d,取各处理组昆明小鼠10只,雌雄各半,采用眼球摘除法取血,测定血液相关生理生化指标和血相指标。同时立即解剖昆明小鼠,观察其内脏器官,并制作心脏、肝脏、肾脏、脾脏和肺脏石蜡切片观察病变情况。
1. 2. 4 生理生化指标检测方法 对昆明小鼠进行眼球摘除法采血,血液静置凝结后以3000 r/min离心2 min,取血清测定谷丙转氨酶(ALT)、谷草转氨酶(AST)和碱性磷酸酶(ALP)等生理生化指标。
1. 2. 5 血相指标检测方法 对昆明小鼠进行眼球摘除法采血,取0.3 mL血样,收集于EDTA抗凝管中,用血细胞分析仪测定白细胞数(WBC)、红细胞数(RBC)和血红蛋白(HGB)等血项相关指标。
1. 2. 6 昆明小鼠器官病变观察 取昆明小鼠心脏、肝脏、脾脏、肺脏和肾脏等器官,用4%甲醛溶液浸泡固定24 h,经石蜡包埋并制作切片,采用苏木精—伊红(H-E)染色,光学显微镜下观察病理改变并拍照。
1. 2. 7 致病性试验 采用腹腔注射的方法,选择体重18~20 g的健康成年昆明小鼠40只,雌雄各半,按500 mg/kg BW(活菌含量为2.5×1014 CFU/g)的剂量经腹腔注射DJB5菌液。腹腔注射后3、7和14 d分别取雌雄各3只解剖,并进行病理学观察。参照NY/T 2186.12012《微生物农药毒理学试验准则》、GB 15193.3—2014《食品安全国家标准 急性经口毒性试验》和NY/T 1109—2017《微生物肥料生物安全通用技术准则》,根据昆明小鼠有无死亡、中毒症状、病理学观察及病理组织学检查对病变进行分级。
1. 2. 8 溶血试验 用接菌环蘸取DJB5菌种,于血琼脂培养基上画蛇形线接种,置于(36±1)℃培养箱中培养,24±2 h后观察有无溶血环,用金黄色葡萄球菌标准菌株[CMCC(B)26003]作阳性对照。
1. 2. 9 一次破损皮肤刺激试验 取3只健康且皮肤完好的昆明小鼠,用手术刀片将小鼠背部脊柱两侧的毛去掉,去毛范围为2.5 cm×2.5 cm,用75%酒精清洁并消毒暴露皮肤,用无菌手术刀片在两块皮区域内各划一个“井”形的破损伤口。取0.5 mL DJB5(5.4×1010 CFU/mL)菌液部分滴于其中一块破损皮肤上,部分滴于2~4层无菌纱布上,并将纱布敷贴于破损皮肤表面,用医用胶布固定,另一侧破损皮肤用生理盐水同样处理作为对照,敷貼时间4 h。试验结束后,用温水洗去残留菌液,并于除去菌液后1、24和48 h观察皮肤局部反应。
1. 2. 10 急性眼刺激试验 将0.1 mL DJB5菌液(5.4×1010 CFU/mL)滴于昆明小鼠一侧眼结膜囊内,另一侧以生理盐水作同样处理为正常对照,滴菌液后,将眼被动闭合4 s,30 s后用生理盐水冲洗。于滴眼后1、24、48和72 h,肉眼观察昆明小鼠眼结膜、虹膜和角膜的损伤与恢复情况。
1. 2. 11 抗菌药物敏感性试验 参考NY/T 1109—2017《微生物肥料生物安全通用技术准则》采用纸片琼脂扩散法检测生防菌对抗菌药物的敏感性强度。药敏纸片S1098含有青霉素G、氨苄西林、头孢唑林、丁胺卡那、庆大霉素、红霉素、诺氟沙星、环丙沙星、复方新诺明和氯霉素等10种抗菌药物。
1. 3 统计分析
昆明小鼠生化指标、血常规、体重和脏器系数均以平均数±标准差表示,采用SPASS 19.0进行单因素方差分析(One-way ANOVA)。
2 结果与分析
2. 1 DJB5菌体对昆明小鼠的急性经口毒性
以最大剂量(5000 mg/kg BW)一次性灌胃DJB5菌体后,昆明小鼠表现为拒食和少动,6 h后发现昆明小鼠能正常饮食饮水,精神状态良好,未出现不良反应,连续饲养观察14 d,处理昆明小鼠与对照比较,表现正常。解剖昆明小鼠进行病理学检查发现,灌胃DJB5菌体的昆明小鼠器官无病变现象;制作心脏、肝脏、脾脏、肺脏和肾脏5个器官的石蜡切片并进行H-E染色,结果(图1-c1~图1-c5)显示处理组昆明小鼠的器官与对照组无差异,表明DJB5菌体对昆明小鼠的急性经口半致死剂量LD50>5000 mg/kg,DJB5的急性经口毒性属无毒级别。
2. 2 DJB5发酵上清液对昆明小鼠的急性经口毒性
通过给昆明小鼠灌胃5和10倍的DJB5发酵上清浓缩液,并于处理后3和14 d检查昆明小鼠的生理生化和血相指标,结果见表1~表4。处理后3 d,昆明小鼠的丙氨酸氨基转移酶(ALT)明显升高,其中10倍DJB5发酵上清液处理与对照组相比差异显著(P<0.05),其他几项指标与对照组相比无显著差异(P>0.05,下同)(表1);处理后14 d,昆明小鼠的各项生理生化指标均正常,与对照组相比无显著差异(表2);处理后3和14 d,昆明小鼠的白细胞、血小板和红细胞等血项指标无明显变化,与对照组相比无显著差异(表3和表4)。
处理后14 d,解剖昆明小鼠观察各脏器器官的颜色和形态,检查病变情况,同时制作心脏、肝脏、脾脏、肺脏和肾脏5个器官的石蜡切片,并用H-E染色,在显微镜下进行观察。结果(图1-b1~图1-b5)表明,各处理组昆明小鼠的心脏、肝脏、脾脏、肺脏和肾脏组织结构与对照相比无明显差异:昆明小鼠心肌细胞未见增大和萎缩,无炎症细胞浸润,无异常渗出物和出血现象;肝细胞形态正常,核圆、居中,细胞排列规则致密,以中央静脉为中心向四周呈索状排列;脾脏红髓和白髓分界清晰,脾索和脾血窦结构正常,脾脏淋巴细胞丰富;支气管、肺泡等结构清晰,细胞排列整齐,细胞核质比例正常,肺泡腔内无渗出物,肺泡壁毛细血管无充血,肺间质未见纤维组织增生;肾小体,肾小囊结构清晰可见,肾小球上皮细胞无充血现象,肾近曲小管上皮细胞核圆形,且结构正常。
2. 3 DJB5对昆明小鼠的急性腹腔注射致病性
腹腔注射DJB5菌体后,处理组昆明小鼠表现为少动和不食的中毒症状,12 h后处理组昆明小鼠逐渐恢复正常状态,连续观察14 d,无小鼠死亡。在处理后第3、7和14 d分别取昆明小鼠解剖,并进行病理学检查,结果显示昆明小鼠各脏器无肿胀、变色、充血等病变现象;同时称量小鼠体重及心脏、肝脏、脾脏、肺脏和肾脏等器官的重量,计算脏器系数,结果(图2)表明处理组与对照组的小鼠体重和脏器系数均无显著差异,生防菌DJB5对昆明小鼠无致病性。
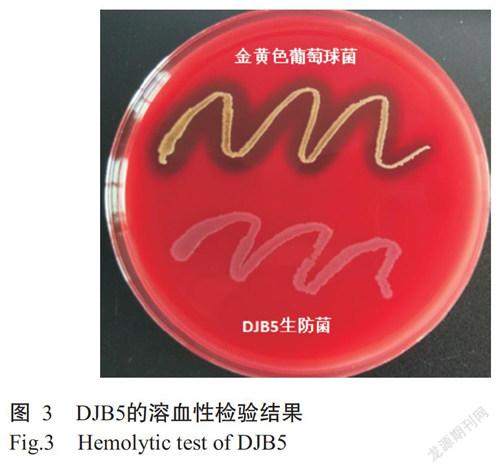
2. 4 溶血性
溶血试验结果(图3)显示,金黄色葡萄球菌在血平板培养基上培养24 h后出现明显的溶血圈,而生防菌DJB5无溶血圈。
2. 5 DJB5对昆明小鼠破损皮肤的刺激性
用DJB5菌液处理昆明小鼠1 h后,处理组伤口有轻微红肿,无红斑和水肿现象,处理后24和48 h,红肿消散,无感染迹象,新毛逐渐覆盖伤口,表明DJB5对昆明小鼠皮肤表现为无刺激性级别。
2. 6 DJB5对昆明小鼠的眼部刺激性
用DJB5菌液处理昆明小鼠眼部,于处理后1、24、48和72 h观察昆明小鼠的结膜、虹膜和角膜,发现虹膜正常,结膜未充血也无水肿,角膜无溃疡形成或浑浊,由此判断DJB5对昆明小鼠眼睛无刺激性。
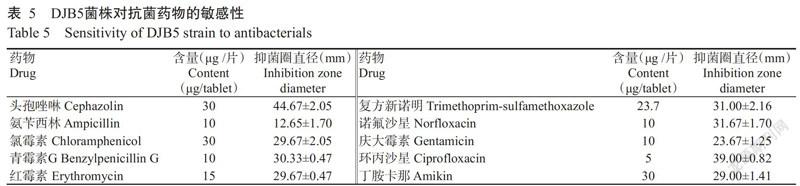
2. 7 DJB5对抗菌药物的敏感性
采用纸片琼脂扩散法检测发现,DJB5对头孢唑林、环丙沙星、诺氟沙星、复方新诺明、青霉素、氯霉素G、庆大霉素、红霉素和丁胺卡那等9种抗菌药物均表现出不同程度的敏感性,但对氨苄西林不敏感(图4和表5),DJB5对NY/T 1109—2017 《微生物肥料生物安全通用技术准则》规定的9种抗菌药物敏感,符合安全性要求。
3 讨论
在我国,有关生防菌的安全性研究报道较少,本研究首次报道了贝莱斯芽孢杆菌的生物安全性问题。本研究中,用10倍浓缩的DJB5发酵上清液处理昆明小鼠3 d后,丙氨酸氨基转移酶含量与对照组相比显著升高,表明发酵上清液干扰了小鼠的肝脏功能,但处理14 d后的生理生化指标与对照组相比无显著差异,可能是昆明小鼠可通过自身的代谢作用去除生防菌的有害影响;另外,处理组昆明小鼠3和14 d的血相指标均与对照组相比无显著差异,说明发酵液进入小鼠体内不会引起感染,DJB5对昆明小鼠较安全。DJB5菌液对昆明小鼠的皮肤和眼睛刺激性试验、腹腔注射试验、溶血试验和药敏试验也均显示该菌株符合安全性要求。以上研究結论将为该菌株在玉米储藏期作为黄曲霉生防菌剂的运用打下基础。
目前,我国对微生物菌剂的管理仍有待改进,虽然已对微生物肥料和环保用微生物的安全性问题发布了技术准则(导则),但微生物菌剂的安全性仍未得到重视,甚至出现采用土壤中筛选出的病原微生物进行污染防治研究的对象(田晔等,2011)。对于微生物农药的生物安全性,我国目前尚无相关的技术准则和标准,现行的NY/T 2186.1—2012《微生物农药毒理学试验准则》给出了毒理学方面的试验方法及其评价,但该准则并无微生物农药皮肤刺激性、溶血性及抗菌药物敏感性等方面的测试指导。前期试验发现,DJB5对玉米黄曲霉的防治效果高达92%,且能在玉米种子中长期定殖,具有在玉米贮存期防治黄曲霉的潜力(袁远等,2019),用于种子储藏期黄曲霉防治的DJB5最终将与饲料玉米一起进入动物体内,该生防菌的生物安全性决定了其是否能安全应用。微生物农药的安全性评价非常重要,因此,本研究主要参考了NY/T 1109—2017《微生物肥料生物安全通用技术准则》。另外,生防菌DJB5是否会在动物体内发生移位,对动物是否具有慢性毒性和生育影响,也是微生物农药安全需要考察的重要方面,本课题组将在后期开展相关研究,以期为该菌株的安全应用提供更全面的保障。芽孢杆菌是一种较理想的生防微生物,在植物病害的生物防治中广泛应用,但随着研究的深入,一贯被认为安全的生物物质不断被报道威胁环境和环境生物,为保障食品安全和生态环境的安全,生防物质的安全性评价不容忽视,期待国家层面尽快发布微生物农药生物安全评价相关的方法技术与标准,以保障生防物质在环境中的安全运用。
4 结论
贝莱斯芽孢杆菌DJB5对昆明小鼠无毒、无致病性和刺激性,无溶血性,且对受试的青霉素G、头孢唑林、丁胺卡那、庆大霉素、红霉素、诺氟沙星、环丙沙星、复方新诺明和氯霉素等9种抗菌药物敏感,表明贝莱斯芽孢杆菌DJB5及其发酵液的生物安全性高,具有开发成防治玉米贮藏期黄曲霉制剂的潜力。
參考文献:
樊龙江,吴月友,庞洪泉,吴建国,舒庆尧,徐孟奎,陆剑飞. 2003. 转基因Bt水稻花粉在桑叶上的自然飘落浓度[J]. 生态学报,23(4):826-833. [Fan L J,Wu Y Y,Pang H Q,Wu J G,Shu Q Y,Xu M K,Lu J F. 2003. Bt rice po-llen distribut ion on mulberry leaves near ricef ileds[J]. Acta Ecologica Sinica,23(4):826-833.]
罗远婵,谢关林. 2005. 洋葱伯克氏细菌是我们的敌人还是朋友?[J]. 微生物学报,45(4):647-652. [Luo Y C,Xie G L. 2005. Burkholderia cepacia: Our enemy or friend?[J]. Acta Microbiologica Sinica,45(4):647-652.]
马鸣超,姜昕,曹凤明,李力,关大伟,李俊. 2016. 微生物肥料产品质量安全风险因子识别及现状评价[J]. 农产品质量与安全,(5):8-12.[Ma M C,Jiang X,Cao F M,Li L,Guan D W,Li J. 2016. Identification and status evaluation of quality and safety risk factors of microbial fertilizer products[J]. Quality and Safety of Agro-products,(5):8-12.]
孙平平,崔建潮,贾晓辉,王文辉. 2018. 贝莱斯芽孢杆菌L-1对梨灰霉和青霉病菌的抑制作用评价及全基因组分析[J]. 微生物学报,58(9):1637-1646. [Sun P P,Cui J C,Jia X H,Wang W H. 2018. Complete genome analysis of Bacillus velezensis L-1 and its inhibitory effect on pear gray and blue mold[J]. Acta Microbiologica Sinica,58(9):1637-1646.]
田晔,张明旭,李朝品. 2011. 污染防治和农业用土壤微生物筛选的生物安全性问题与建议[C]//2011年环境污染与大众健康学术会议论文集. 武汉:美国科研出版社:492-494.[Tian Y,Zhang M X,Li C P. 2011. Problem and advice of biosafety assessment on soil microorganism in screening of microorganism for pollution control and agriculture in China[C]//Proceedings of conference on environmental pollution and public health(CEPPH2011). Wuhan: Scientific Research Publishing:492-494.]
袁远,张佩,何鹏飞,唐萍,范黎明,吴毅敖,何月秋. 2019. 黄曲霉毒素B1降解菌的筛选及在玉米贮藏中的应用[J]. 微生物学报,59(2): 395-404. [Yuan Y,Zhang P,He P F,Tang P,Fan L M,Wu Y A,He Y Q. 2019. Screening and application of an antagonistic bacterium against Aspergi-llus flavus[J]. Acta Microbiologica Sinica,59(2): 395-404.]
邹远军,宋欣沛,郑一敏,罗颉,钟猛,宋婷,胥秀英. 2017. 枯草芽孢杆菌SC-2产直链肽类代谢产物的分离纯化[J]. 现代食品科技,33(5):85-90. [Zou Y J,Song X P,Zheng Y M,Luo J,Zhong M,Song T,Xu X Y. 2017. Separation and purification of straight-chain peptide metabolites produced by Bacillus subtilis SC-2[J]. Modern Food Science and Technology,33(5):85-90.]
Algburi A,Volski A,Cugini C,Walsh E M,Chistyakov V A,Mazanko M S,Bren A B,Dicks L M T,Chikindas M L. 2016. Safety properties and probiotic potential of Baci-llus subtilis KATMIRA1933 and Bacillus amyloliquefaciens B-1895[J]. Advances in Microbiology,6(6):432-452.
Borriello S P,Hammes W P,Holzapfel W,Marteau P,Schrezenmeir J,Vaara M,Valtonen V. 2003. Safety of probiotics that contain lactobacilli or bifidobacteria[J].Clinical Infectious Diseases,36(6):775-780.
Foster J W,Woodruff H B. 2010. Antibiotic substances produced by bacteria[J]. Annals of the New York Academy of Sciences,1213(1):125-136.
Jennifer L P. 2000. Burkholderia cepacia: Friend or foe? The Plant Health Instructor[EB/OL]. [2019-03-20]. http: www.apsnet.org education feature Burkholderia cepacia top.html.
Liu J,Zhang Q,Fang C H. 2010. Deletion of the yhdT gene of Bacillus subtilis and its influence on hemolysis[J]. African Journal of Biotechnology,9(39):6470-6476.
Mathur S,Singh R. 2005. Antibiotic resistance in food lactic acid bacteria-A review[J]. International Journal of Food Microbiology,105(3):281-295.
Nasir M N,Besson F. 2012. Conformational analyses of bacillomycin D,a natural antimicrobial lipopeptide,alone or in interaction with lipid monolayers at the air-water interface[J]. Journal of Colloid and Interface Science,387(1):187-193.
Ongena M,Jacques P. 2008. Bacillus lipopeptides: Versatile weapons for plant disease biocontrol[J]. Trends in Microbiology,16(3):115-125.
Palazzinia J M,Dunlapb C A,Bowmanc M J,Chulze S N. 2016. Bacillus velezensis RC 218 as a biocontrol agent to reduce Fusarium head blight and deoxynivalenol accumulation: Genome sequencing and secondary metabolite cluster profiles[J]. Microbiological Research,192: 30-36.
Parke J L,Gurian-Sherman D. 2001. Diversity of the Burkholderia cepacia complex and implications for risk assessment of biological control strains[J]. Annual Review of Phytopathology,39(1):225-258.
Qian H F,Hu B L,Cao D,Chen W,Xu X Y,Lu Y C. 2007. Bio-safety assessment of validamycin formulation on bacterial and fungal biomass in soil monitored by real-time PCR[J]. Bulletin of Environmental Contamination & To-xicology,78(3-4):239-244.
Sablon E,Contreras B,Vandamme E J. 2000. Antimicrobial peptides of lactic acid bacteria: Mode of action,genetics and biosynthesis[J]. Advances in Biochemical Enginee-ring/Biotechnology,68:21-60.
Salyers A A,Gupta A,Wang Y. 2004. Human intestinal bacteria as reservoirs for antibiotic resistance genes[J]. Trends in Microbiology,12(9):412-416.
Sansinenea E,Ortiz A. 2011. Secondary metabolites of soil Bacillus spp.[J]. Biotechnology Letters,33(8):1523-1538.
Skrobek A,Butt T M.2005.Toxicity testing of destruxins and crude extracts from the insect-pathogenic fungus Metarhizium anisopliae[J]. FEMS Microbiology Letters,251:23-28.
Stein T. 2010. Bacillus subtilis antibiotics:Structures,syntheses and specific functions[J]. Molecular Microbiology,56(4):845-857.
Teixeira M L,Dalla Rosa A,Brandelli A. 2013. Characterization of an antimicrobial peptide produced by Bacillus subtilis subsp. spizezinii showing inhibitory activity towards Haemophilus parasuis[J]. Microbiology,159:980-988.
(責任编辑 麻小燕)

