青蒿琥酯脂质体的制备及抗肿瘤作用研究
苏玉娇,周 双,孙文璐,何 媛,刘 凯*,王永军*
青蒿琥酯脂质体的制备及抗肿瘤作用研究
苏玉娇1,周 双1,孙文璐1,何 媛2,刘 凯2*,王永军1*
(1. 沈阳药科大学 无涯学院,辽宁 沈阳 110016;2. 江苏恒瑞医药股份有限公司 研究院,江苏 连云港 222047)
制备青蒿琥酯脂质体,对其抗肿瘤作用进行研究。通过醋酸钙梯度法制备青蒿琥酯脂质体,考察制备的脂质体的粒径、物理稳定性、体外释放、体内药动学及药效学。制备的青蒿琥酯脂质体呈类球形,粒径为(134.8 ± 2.654) nm,PDI为7.8×10-2± 5.1×10-2,zeta电位为 (-19.4 ± 1.57) mV,包封率在95%左右。在4 ℃条件下放置40 d稳定性良好,体外释放实验表明青蒿琥酯脂质体具有缓释作用,药动学实验证明青蒿琥酯脂质体的体内消除半衰期(1/2)和药时曲线下面积(AUC0-t)分别是青蒿琥酯溶液剂组的4.6倍和9.2倍。药效学实验表明与青蒿琥酯溶液剂组相比,青蒿琥酯脂质体组具有显著的抗肿瘤效果,且安全性良好。青蒿琥酯脂质体能显著延长青蒿琥酯的体内半衰期,提高生物利用度,增强青蒿琥酯的抗肿瘤效果。
药剂学;脂质体;醋酸钙梯度;青蒿琥酯;药代动力学;抗肿瘤
青蒿琥酯(artesunate,ARS,图1)是青蒿素的衍生物,是一种有效的抗疟药,还具有抗炎[1]、抗纤维化[2]和免疫调节[3]等作用。一系列体内和体外实验表明,青蒿琥酯对胰腺癌、肝癌、乳腺癌、卵巢癌和肺癌细胞等具有杀伤作用[4],且耐受性良好,不具有耐药性,对一些易出现多药耐药的肿瘤细胞也具有一定的抑制作用。青蒿琥酯发挥抗肿瘤作用的机制主要有过氧桥产生有毒的自由基、细胞周期停滞、诱导细胞凋亡和抑制肿瘤血管生成[5]。但由于其水中溶解度较低[6],结构中的过氧桥不稳定,且体内半衰期短[7],大大限制了其应用。
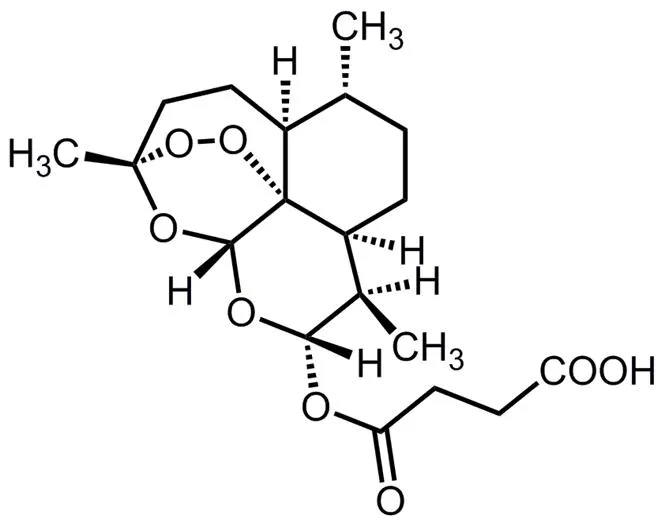
Fig. 1 The chemical structure of artesunate (ARS)
脂质体作为一种纳米药物载体,具有被动靶向性、且能提高药物的稳定性、增加难溶性药物的溶解度、降低药物的毒性和控制药物的释放速率[8]等优点。将脂质体表面进行PEG化修饰制备成长循环脂质体,可以显著提高药物的半衰期,延长脂质体在体内的循环时间,提高药物的疗效[9-10]。醋酸钙梯度法用于包载弱酸性药物,青蒿琥酯结构中含有一个羧基,pKa大约在4左右,显弱酸性[11]。但青蒿琥酯溶解度较低,所以需要采用溶剂辅助法帮助其载药,即载药时向脂质体中加入乙醇,乙醇不仅能够增加青蒿琥酯的溶解度,而且可以提高磷脂双分子膜的渗透性,帮助青蒿琥酯透过磷脂双分子膜进入脂质体内水相中[12]。
作者采用薄膜分散-主动载药法制备了青蒿琥酯长循环脂质体,体外释放实验表明脂质体能够延缓药物的释放,体内药动学证明脂质体能够延长药物的半衰期,药效学实验证明与青蒿琥酯溶液剂相比,脂质体能显著提高其抗肿瘤效果。
1 仪器与材料
RE-5203旋转蒸发仪(上海亚荣生化仪器厂),挤出整粒机(安拓思纳米技术有限公司),Malvern Zetasizer粒径分析仪(英国Malvern公司),超滤离心管(美国Millipore公司),聚碳酸酯膜(英国Whatman公司),透析袋(MWCO 1.2×104~1.4×104u,上海绿鸟科技发展有限公司),高效液相色谱仪(日本Hitachi公司),ACQUITY UPLCTM/Tandem Quadrupole Detector(TQD)超高效液相色谱串联质谱联用仪(MassLynx 4.1工作站,美国Waters公司),Model 500酶标仪(美国BioRed公司),Phenomenex C18色谱柱(美国Phenomenex公司)。
青蒿琥酯(artesunate,ARS,大连美仑生物技术有限公司),DSPC、胆固醇(Chol)、mPEG2000- DSPE(上海艾韦特医药科技有限公司),琼脂糖凝胶(Sephadex G-50,北京索莱宝科技有限公司),RPMI 1640培养液(美国GIBCO公司),胰酶、青霉素、链霉素(美国Amresco公司),胎牛血清(美国Hyclone公司)。
Sprague-Dawley 大鼠,雄性,体质量220~250 g,沈阳药科大学动物中心提供,动物许可证号 SCXK(辽)2015-0001。Balb/C小鼠,雌性,体质量18~22 g,沈阳药科大学实验动物中心提供,动物许可证号 SCXK(辽)2015-0001。鼠源乳腺癌4T1细胞(南京科佰生物科技有限公司)。
2 方法与结果
2.1 青蒿琥酯长循环脂质体的制备
将DSPC、Chol和mPEG2000-DSPE溶解于10 mL乙醇中,65 ℃减压蒸发成均匀的薄膜。加入200 mmol∙L-1醋酸钙溶液8 mL,65 ℃水化30 min,制备空白脂质体。制备好的空白脂质体于70 ℃下分别通过0.4 μm、0.2 μm和0.1 μm的聚碳酸酯膜挤出10次。然后通过Sephadex G-50凝胶柱色谱将空白脂质体外水相的200 mmol∙L-1醋酸钙溶液替换成200 mmol∙L-1硫酸钠溶液来形成梯度脂质体。
在空白脂质体中加入10 g∙L-1青蒿琥酯乙醇溶液,于55 ℃孵育30 min,冰浴10 min终止载药,即得青蒿琥酯长循环脂质体。将制得的青蒿琥酯脂质体于40 ℃减压旋转蒸发除去乙醇。
2.2 脂质体的粒径和zeta电位分析
青蒿琥酯脂质体用蒸馏水稀释至适宜浓度后,用Malvern Zetasizer粒径分析仪来测定脂质体的粒径、PDI和zeta电位。
由图2及表1可知,青蒿琥酯脂质体的粒径在130 nm左右, PDI小于0.2,说明脂质体的粒径分布较均匀。脂质体表面较高的负电产生静电排斥作用,避免了脂质体之间发生聚集现象,有利于脂质体的物理稳定性,包封率在95%左右。

Fig. 2 The size distribution(A) and TEM(B) of ARS-LPs
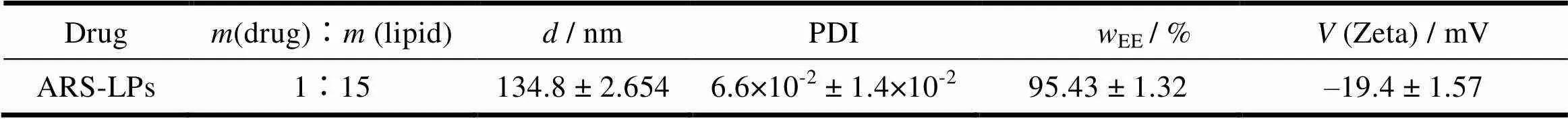
Table 1 Characterization of ARS-LPs (n = 3)
2.3 液相色谱条件
色谱柱:Kromasil 100-5 C18柱(150 mm × 4.6 mm,5 μm);柱温:30 ℃;检测波长:216 nm;流动相:乙腈-水(含体积分数0.1%磷酸)(体积比50∶50);流速:1 mL∙min-1;进样量:20 μL。
2.4 脂质体包封率的测定
使用超滤离心法对青蒿琥酯脂质体的包封率进行测定。首先,取青蒿琥酯脂质体300 μL加入截留分子质量为1×104u的超滤离心管上部,3 000 r∙min-1离心30 min,使得脂质体被截留在超滤管上部,而未包载的游离药物被离心至超滤管底部。向底部液体加入2 mL异丙醇-水(体积比80∶20),采用高效液相色谱法测定青蒿琥酯质量浓度(1)。另外取青蒿琥酯脂质体300 μL,加入异丙醇-水(体积比80∶20)2 mL,采用高效液相色谱法测定青蒿琥酯质量浓度(2)。根据公式EE=1-1/2×100%计算包封率。
2.5 青蒿琥酯脂质体的稳定性考察
将青蒿琥酯脂质体放置于4 ℃冰箱中,在规定的时间取样并测定其粒径、PDI和包封率。由图3可知,青蒿琥酯在4 ℃放置40 d内,粒径仍保持在130 nm左右,PDI小于0.2,包封率变化不明显,说明青蒿琥酯脂质体在4 ℃下40 d内的物理稳定性良好。
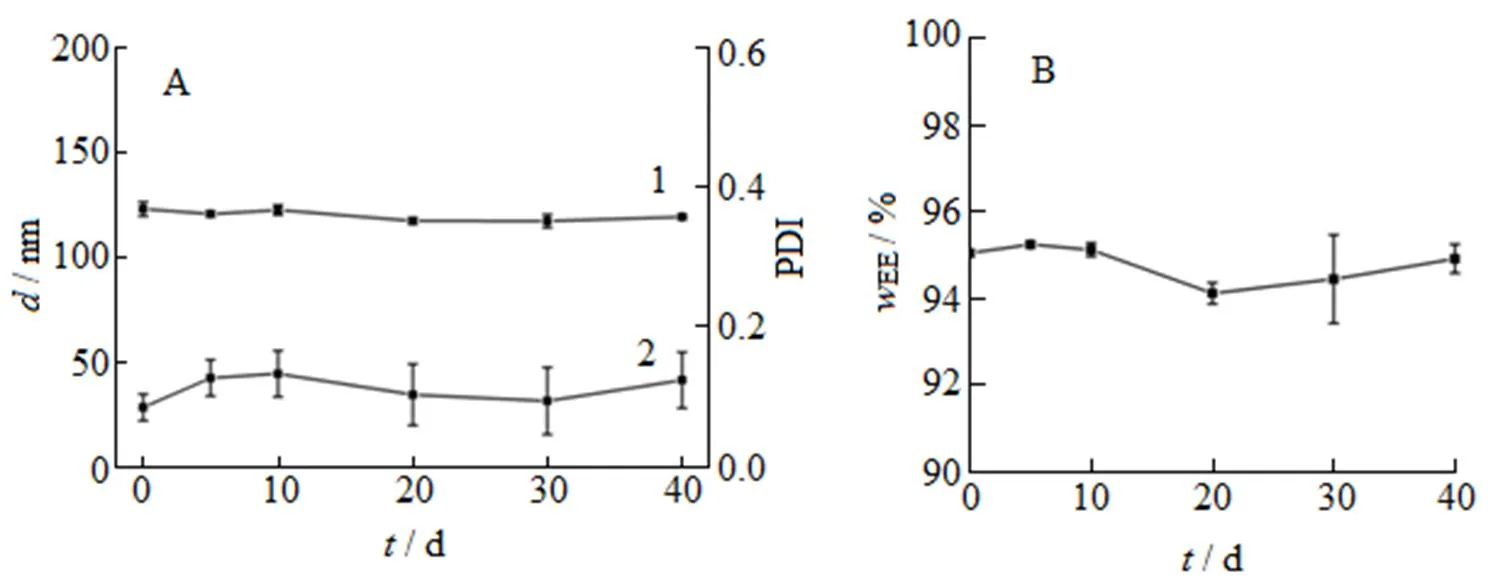
A—Changes of particle size and PDI;1—Particle size; 2—PDI; B—Changes of wEE
2.6 青蒿琥酯脂质体的体外释放行为
采用透析法。取青蒿琥酯脂质体2 mL置于透析袋中,将透析袋两端扎紧,浸没于30 mL含体积分数20%乙醇的pH值7.4 PBS的锥形瓶中,置于37 ℃、100 r∙min-1恒温水浴振荡器中,分别于规定时间点取样1 mL,并随即补加1 mL新鲜的空白释放介质,按“2.3”条色谱条件测定青蒿琥酯的含量,并计算青蒿琥酯的累积释放度。脂质体体外释放实验结果如图4所示。由图4可知,ARS solution 在前8 h 就已经释放了90%左右,ARS-LPs的释放速率明显慢于ARS solution,ARS-LPs在24 h内仅释放了39%的ARS,且不存在突释现象和药物降解现象,表明脂质体的双分子膜能大大延缓青蒿琥酯的释放速率,具有缓释作用。
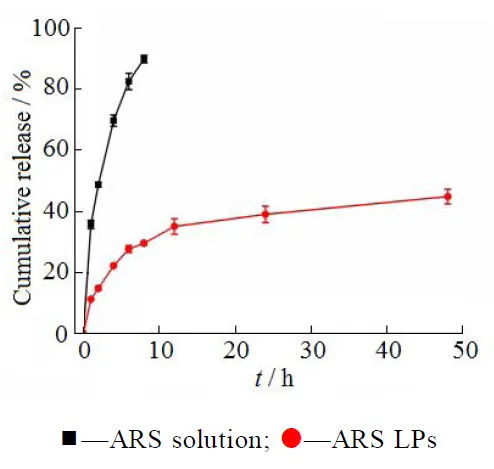
Fig. 4 In vitro release of ARS solution and ARS LPs ( n = 3)
2.7 青蒿琥酯脂质体的体内药动学行为
8只SD大鼠禁食12 h,自由饮水,实验前称质量并随机分为2组,每组4只,分别尾静脉注射给予ARS solution和ARS LPs,给药剂量为10 mg∙kg-1。并于给药后0.083、0.5、1、2、4、6、8、12和24 h眼眶取血0.4 mL,置于已涂肝素的离心管中,1.5×104r∙min-1离心5 min,取上层血浆保存于-80 ℃冰箱备用。
采用沉淀蛋白法处理血浆样品。取血浆样品50 μL,加入甲醇50 μL(含体积分数0.5%冰醋酸及体积分数0.6%过氧化氢)和250 μg∙L-1地西泮内标30 μL,涡旋30 s,加入100 μL甲醇(含体积分数0.5%冰醋酸及体积分数0.6%过氧化氢),涡旋3 min,1.5×104r∙min-1离心5 min,取上清,1.5×104r∙min-1离心5 min,取上清进样。
采用DAS 2.0软件计算药动学参数。药动学曲线如图5所示,游离的青蒿琥酯在血浆中快速消除,4 h 就已经检测不到了;而脂质体中青蒿琥酯的消除速率较慢,在各个时间点的血药浓度均高于青蒿琥酯溶液剂,表明脂质体能够增加青蒿琥酯在血浆中的稳定性,延长青蒿琥酯在血液中的循环时间。通过DAS软件求得的药动学参数见表2,与青蒿琥酯溶液剂相比,青蒿琥酯脂质体的1/2增加了4.6倍,MRT(0-t)提高了20 倍,AUC0-t提高了 9.2倍,CLz降低了9.4倍。
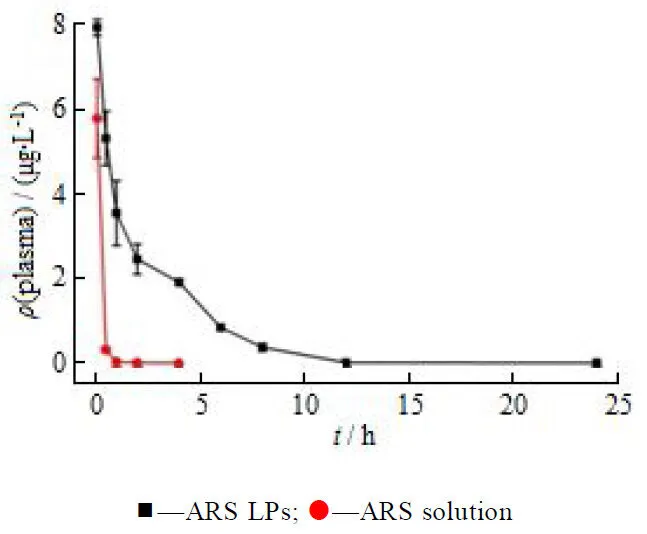
Fig. 5 Plasma concentration-time profiles of ARS solution and ARS LPs after a single intravenous administration (10 mg∙kg-1, mean ± SD, n = 4)
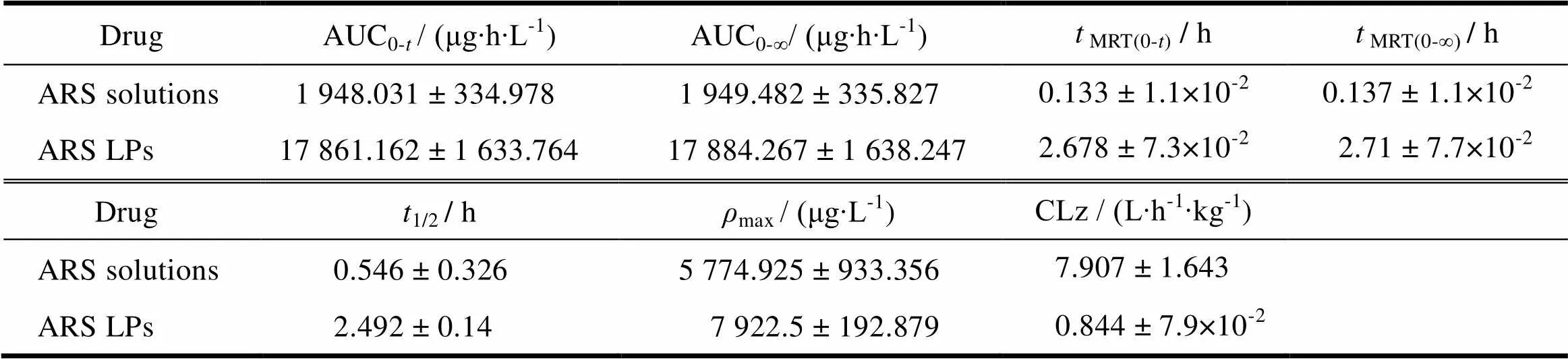
Table 2 Pharmacokinetics parameters of ARS solution and ARS LPs after intravenous administration at a dose of 10 mg∙kg-1 (n = 4)
2.8 青蒿琥酯脂质体的体内抗肿瘤效果
将生长状态良好的4T1细胞接种于Balb/C小鼠右后侧腰背部皮下组织内,建立鼠源乳腺癌肿瘤模型。当肿瘤体积达到150 mm3左右时,将小鼠随机分为4组(= 6):A组为生理盐水组;B组为ARS溶液剂组,给药剂量为15 mg∙kg-1;C组为ARS脂质体低剂量组,给药剂量为15 mg∙kg-1;D组为ARS脂质体高剂量组,给药剂量为45 mg∙kg-1。尾静脉注射给药,隔一天给药1次,每天测量小鼠体质量和肿瘤体积,按照下列公式计算肿瘤体积:=×2/2,其中为肿瘤的长径,为肿瘤的短径。
组间统计学差异采用Student’s-test 进行检验,< 0.05 表示具有显著性差异。
肿瘤生长曲线如图 6所示,生理盐水组不能抑制肿瘤生长,9 d后肿瘤体积达到1 100 mm3左右。相比之下,ARS solution 和ARS-LPs低剂量(15 mg∙kg-1)对肿瘤的生长有一定的抑制作用,在相同剂量条件下,ARS-LPs的抗肿瘤效果好于ARS solution。ARS-LPs高剂量(45 mg∙kg-1)表现出更明显的抑制肿瘤生长的作用,能将肿瘤体积维持在400 mm3以下。
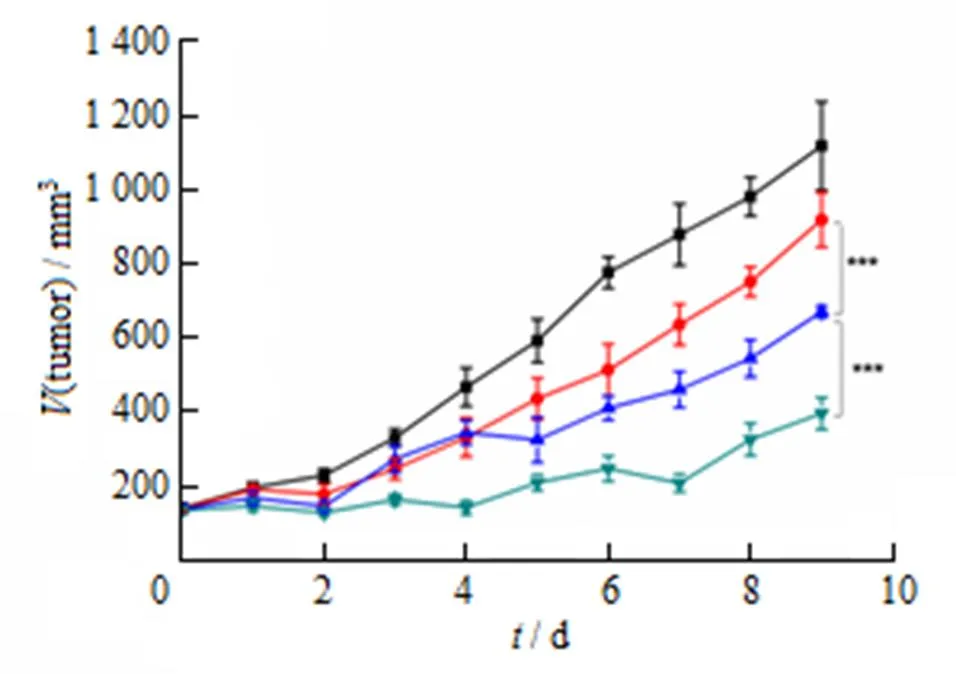
■—Saline; —ARS solution (15 mg∙kg-1); —ARS LPs (15 mg∙kg-1); —ARS LPs (45 mg∙kg-1); ***—P <0.001
每天测量小鼠的体质量变化,绘制小鼠的体质量变化曲线,结果见图 7。结果表明,生理盐水组、ARS solution组和ARS-LPs低剂量组(15 mg∙kg-1)体质量均未有明显下降,ARS-LPs高剂量(45 mg∙kg-1)组体质量有轻微下降,但不明显。药效学实验结果表明与青蒿琥酯溶液剂相比,青蒿琥酯脂质体的抗肿瘤效果更好,且安全性良好。
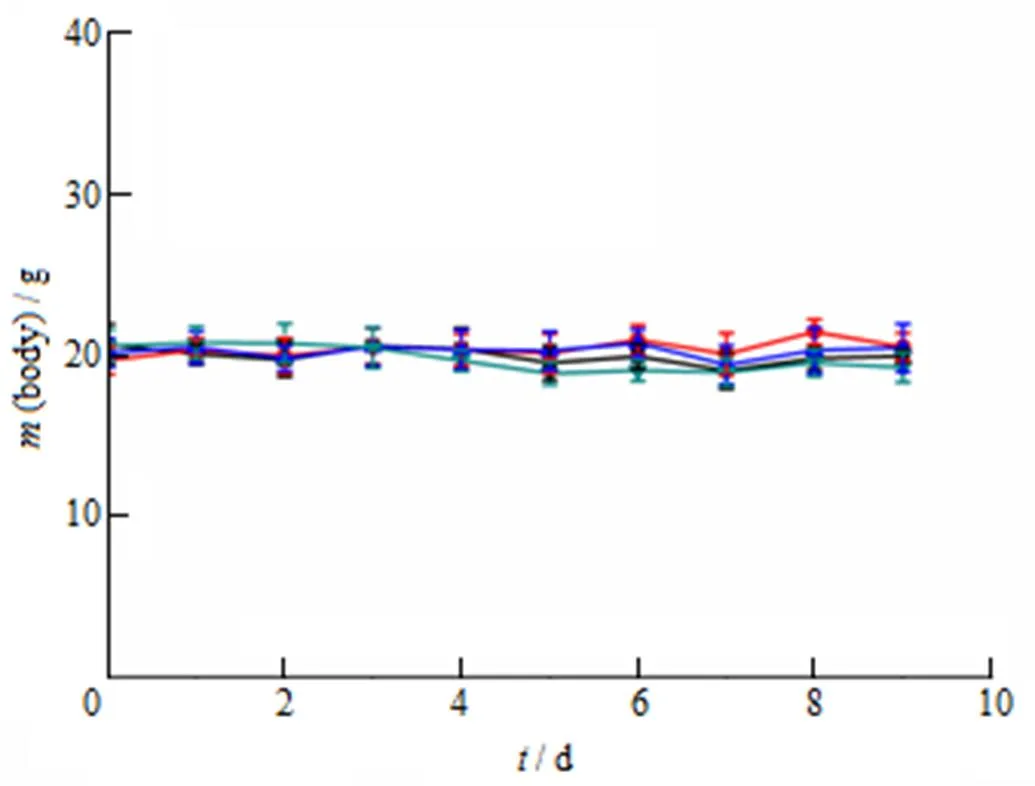
■—Saline; —ARS solution (15 mg∙kg-1); —ARS LPs (15 mg∙kg-1);—ARS LPs (45 mg∙kg-1); ***P <0.001
3 讨论
a. 中草药脂质体的研究是中药领域的研究热点之一,探索将中药脂质体应用于抗肿瘤具有很好的发展前景[13]。青蒿衍生物大多采用被动载药法制备成脂质体,包封率较低。青蒿琥酯显弱酸性,本研究中探索通过醋酸钙梯度法将青蒿琥酯包封入脂质体。在醋酸钙梯度法中(图8),脂质体内外水相pH梯度是驱使ARS载入脂质体内水相的关键。内水相中存在下面平衡:
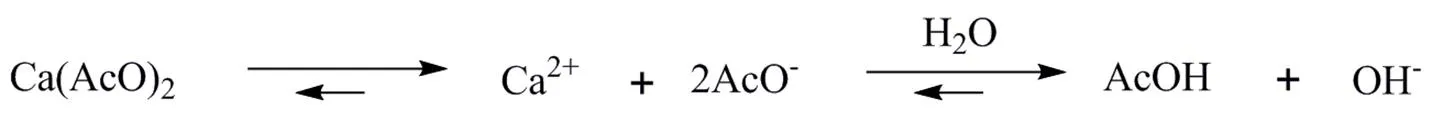
由于AcOH(P = 6.6×10-4)的跨膜速度是Ca2+(P = 2.5×10-11)的107倍,因此脂质体内水相中的AcO-转为化AcOH后可跨到脂质体外水相中,使得平衡向右进行,在此基础上也就形成了外酸内碱的跨膜pH梯度。Ca2+可以和包封到脂质体内水相的弱酸性药物形成溶解度更低的复合物,相当于从内外相平衡中消除了内水相中的弱酸分子,在脂质体内水相形成了漏槽条件,使弱酸性药物不断地从外水相进入内水相并累积在脂质体内部。Ca2+可以看作是一个储库,在相当长的时间内维持稳定的跨膜pH梯度。载药过程中加热会使脂质体由“胶晶态”变为“液晶态”,脂质双分子膜流动性增加,排列变得无序,乙醇的存在也会增加脂质膜的渗透性,脂质体外水相的乙醇将ARS完全溶解,使ARS以分子形式穿过磷脂双分子层进入内水相中。内水相中的碱性环境使ARS去质子化并以离子形式稳定包载在脂质体内水相中。通过主动载药法能够提高脂质体包封率和稳定性,使其发挥更好的抗肿瘤效果。
b.脂质体能够增加青蒿琥酯的消除半衰期,延长在血液中的循环时间,提高生物利用度。分析原因有两个:一个是脂质体双分子膜能够延缓药物的释放;二是对脂质体进行PEG化能够有效避免网状内皮系统(RES)的识别和摄取。
c. 药效学实验结果表明,脂质体能够增强青蒿琥酯的抗肿瘤效果,作者制备的青蒿琥酯长循环脂质体,在抗肿瘤方面具有广阔的发展前景,为后续对青蒿琥酯的探索提供了一定的参考价值。
[1] 张莹, 曹春辉. 青蒿琥酯治疗类风湿性关节炎的药理总用研究进展[J]. 山东中医杂志, 2019, 38(2): 201–204.
[2] 彭龙希, 高思楠, 方步武, 等. 青蒿琥酯在大鼠体内外抗肝纤维化的作用[J]. 中国药理学通报, 2016, 32(5): 658–663.
[3] LEE S H, CHO Y C, KIM K H, et al.Artesunate inhibits proliferation of naive CD4 (+) T cells but enhances function of effector T cells[J]. Arch Pharm Res, 2015, 38(6): 1195-1203.
[4] EFFERTH T, DUNSTAN H, SAUERBREY A, et al. The anti-malarial artesunate is also active against cancer [J]. Int J Oncol, 2001, 18: 767–773.
[5] LI Z, LI Q, WU J, et al. Artemisinin and its derivatives as a repurposing anticancer agent: What else do we need to do?[J]. Molecules, 2016, 21(10): 1331-1345.
[6] 沈硕, 刘淑芝, 杜茂波, 等. 青蒿琥酯平衡溶解度和表观油水分配系数的测定[J]. 中国实验方剂学杂志, 2013, 19(19): 9–12.
[7] HESS K M, GOAD J A, ARGUIN P M. Intravenous artesunate for the treatment of severe malaria [J]. Annals of Pharmacotherapy, 2010, 44(7): 1250–1258.
[8] ALLEN T M, CULLIS P R. Liposomal drug delivery systems: From concept to clinical applications[J]. Advanced Drug Delivery Reviews, 2013, 65(1): 36–48.
[9] WOODLE M C, LASIC D D.Sterically stabilized liposomes[J].Biochimica et biophysica acta,1992,1113(2): 171–199.
[10] 鲁晓雨, 方敏, 李宁, 等. 聚乙二醇修饰脂质小分子在胶束给药系统中的研究进展[J]. 药学研究, 2018, 37(7): 49–52.
[11] 岑彦艳, 赵祎博, 李攀, 等. 青蒿琥酯的药代动力学以及相关药理作用研究进展[J]. 中国中药杂志, 2018, 43(19): 3970–3978.
[12] TANG W L, TANG W H, SZEITZ A, et al. Systemic study of solvent-assisted active loading of gambogic acid into liposomes and its formulation optimization for improved delivery[J]. Biomaterials, 2018, 166: 13–26.
[13] 张志勤, 隋丽华, 韩国柱. 中草药脂质体的研究进展[J]. 中南药学, 2011, 9(10): 775–779.
[14] 杨艳芳, 谢向阳, 杨阳, 等. 粒径与表面电荷影响脂质体体内药物靶向递送的研究进展[J]. 药学学报, 2013, 48(11): 1644–1650.
Preparation and antitumor effect evaluation of artesunate liposomes
SU Yujiao1, ZHOU Shuang1, SUN Wenlu1, HE Yuan2, LIU Kai2*, WANG Yongjun1*
(1.,,110016,;2.,.,,222047,)
To prepare artesunate liposomes (ARS LPs) and evaluate its antitumor effect.ARS LPs were prepared by calcium acetate gradient method. The particle size, physical stability,release, pharmacokinetics andantitumor efficacy of the ARS LPs were investigated.The ARS LPs were spherical, the particle size was (134.8 ± 2.654) nm with PDI of 7.8×10-2± 5.1×10-2, the zeta potential was (-19.4 ± 1.57) mV, and the encapsulation efficiency was above 95%. The ARS LPs showed the good stability for 40d at 4 ℃.release experiment indicated that ARS LPs had a sustained release property.pharmacokinetic study revealed that ARS LPs exhibited significantly longer ARS plasma half-life (1/2, 4.6 fold) and higher bioavailability (AUC0-t, 9.2 fold) compared with that of ARS solution. Compared with ARS solution, the ARS LPs could enhance anticancer efficacy with good security.ARS LPs can significantly prolong thehalf-life of artesunate, improve bioavailability, and enhance the anti-tumor effect of artesunate.
pharmaceutics; liposome; calcium acetate gradient; artesunate; pharmacokinetics; antitumor
2019-03-11
苏玉娇(1993-), 女(汉族), 辽宁葫芦岛人, 硕士研究生, E-mail 1957588709@qq.com;
王永军(1977-), 男(汉族), 山东荣成人, 教授, 博士, 博士生导师, 主要从事新型抗癌药物纳米给药系统及药物制剂新剂型、新技术等研究, Tel. 024- 23986325, E-mail i_maple@163.com; 刘凯(1980-), 男(汉族), 山东烟台人, 博士, 主要从事新药制剂研发, Tel. 0518-81221551 , E-mail liukai@hrs.com.cn。
R94
A
(2019)05–0169–09
10.14146/j.cnki.cjp.2019.05.003
(本篇责任编辑:赵桂芝)

