胰岛素-磷脂复合物的制备及其理化性质的研究
毕洪书,房 燕,高 珊,杨东娟,石 凯
胰岛素-磷脂复合物的制备及其理化性质的研究
毕洪书,房 燕,高 珊,杨东娟,石 凯*
(沈阳药科大学 药学院,辽宁 沈阳,110016)
研究胰岛素-磷脂复合物的制备及理化性质。采用非水溶剂-冷冻干燥法制备胰岛素-磷脂复合物,并对其红外光谱、X-射线衍射以及表观油-水分配系数等理化性质进行表征。另外采用降血糖试验评价磷脂复合胰岛素生物活性的变化。通过三相图的绘制确定复合物形成的较优处方和工艺为(质量分数):二甲亚砜90%~100%,冰醋酸0%~10%,磷脂0%~5%。红外光谱显示胰岛素与磷脂结构中的某些基团发生了相互作用,但无新的特征吸收峰产生,即无新共价键生成。X-射线衍射分析显示,复合物呈现无定型特征。复合物中胰岛素的表观油-水分配系数与介质的离子强度及pH值有关,低离子强度和胰岛素等电点处的介质pH值有利于复合物在水相中的结合稳定性。大鼠降血糖实验表明,制备工艺对胰岛素的生物活性无明显影响,胰岛素复合物组和溶液组对大鼠的降血糖作用无显著性差异。胰岛素与磷脂形成复合物后,其理化性质发生显著变化,亲脂性增加并能较好地保持其生物活性。
药剂学;胰岛素-磷脂复合物;非水溶剂-冷冻干燥法;胰岛素;磷脂;复合物;制备;理化性质
胰岛素是胰脏细胞分泌的一种多肽类激素,由于其独特的降血糖作用,是目前治疗Ⅰ型糖尿病的首选药物。但其具有较高的亲水性,且分子量较大,因此不利于通过胃肠道黏膜进入血循环[1]。为改善药物的脂溶性,大量的共价修饰手段被采用,以促进胰岛素在胃肠道的通透性,提高其生物利用度[2-3]。但共价化学修饰手段通常会改变蛋白质的一级结构并导致其生物活性的损失[4-5],另外工艺复杂、成本高的因素也使该方法受到很大限制。
为此,作者从药物的结构入手,探索通过与两亲性物质—卵磷脂形成物理复合物,以期达到提高胰岛素的脂溶性和黏膜吸收的目的。对胰岛素磷脂复合物的制备条件进行了研究,确立了简便易行的制备工艺。在此基础上对胰岛素磷脂复合物的光谱学特征、晶体特征、脂溶性以及生物活性等理化性质进行了较为系统、深入的考察,这对预测磷脂复合胰岛素与疏水性载体的亲和性及其在体内的黏膜渗透性具有重要意义。
1 仪器与材料
IFS-55红外光谱仪(瑞士Bruker公司),D/MAX-rA型X射线衍射仪(日本理学制作所),Jasco高效液相色谱仪、UV-975紫外检测器(日本分光公司),SHA-B恒温振荡器(常州国化电器有限公司),TDL-40B台式离心机(上海安亭科学仪器厂),电子天平(北京赛多利斯仪器系统有限公司),RE-52A旋转蒸发仪(上海亚荣生化仪器厂),FD-1冷冻干燥机(北京博医康实验仪器有限公司),Kromasil ODS-1色谱柱(C18柱, 200 mm×4.6 mm,5 μm,大连化物所)。
猪胰岛素(效价27.5 IU∙mg-1,江苏万邦生化医药股份有限公司),卵磷脂(上海太伟药业有限公司),Triton X-100(美国Amresco公司),葡萄糖酶氧化试剂盒(北京北化康泰临床试剂有限公司),三氯化铁(分析纯,沈阳试剂五厂),硫氰酸铵(分析纯,天津化学试剂公司),乙醇、二氯甲烷、乙醚、乙腈、丙酮、正辛醇、二甲亚砜、冰醋酸等试剂(分析纯,市售)。
SD大鼠,雄性,体质量(200 ± 20)g,沈阳药科大学实验动物中心提供,动物许可证号 SCXK(辽)2017-0001。
2 方法与结果
2.1 胰岛素-磷脂复合物的制备
采用非水溶剂-冷冻干燥法:将胰岛素和卵磷脂共溶于二甲亚砜中,并加入微量冰醋酸作助溶剂,将此单相溶液在一定温度下孵育一定时间后,放入冷冻干燥机内,冷冻干燥12 h得到固体物。
2.1.1 三相图的绘制及冻干区域的选择
将磷脂溶于冰醋酸中,得到不同浓度的溶液;用二甲亚砜滴定此磷脂-冰醋酸溶液,直至出现浑浊,记录混浊点三组分的质量分数,绘制三相图(图1)。
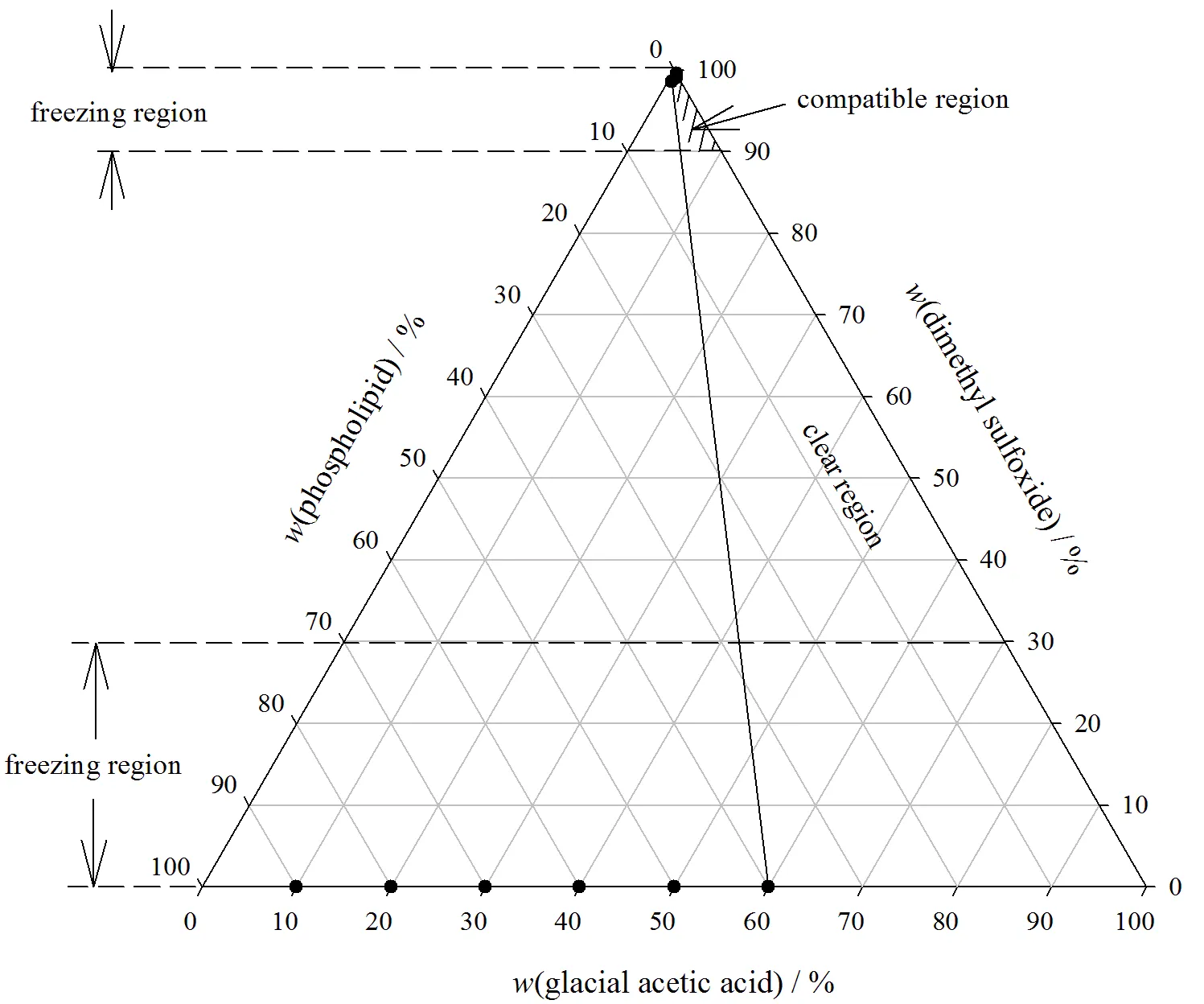
Fig. 1 Three-phase diagram for DMSO/acetic acid/phospholipid mixtures at 25 ℃
浑浊点可用浊度法确定:以相同浓度的磷脂-冰醋酸溶液作空白对照,测定磷脂-二甲亚砜-冰醋酸系统在400 nm可见光处的吸光度值,吸光度值大于0.05即可认为出现浑浊。为确定冻干区域,将二甲亚砜-冰醋酸系统的-50 ℃可冻区域同时标在图1上。从图1中可以看出,冻干范围为单相区与可冷冻区的重叠部分,即:二甲亚砜质量分数90%~100%,冰醋酸质量分数0~10%,磷脂质量分数0~5%。
2.1.2 投料比对复合物中药物含量的影响
精密称取胰岛素1.0~5.0 mg与卵磷脂5.0 mg溶于二甲亚砜-冰醋酸混合溶剂中,于30 ℃水浴中搅拌反应30 min,冻干得固体物。然后加入适量二氯甲烷,充分溶解其中的磷脂复合物,离心,收集上清液,减压蒸发除去二氯甲烷,收集固体,RP-HPLC法测定胰岛素含量[6],计算胰岛素与磷脂的结合比,结果见表1。结果表明:当胰岛素与磷脂投料质量比超过2∶5时,复合物中的药物含量增加不明显,已达到饱和。故选择2∶5作为胰岛素与磷脂的最佳投料比。

Table 1 Effect of weight ratio of insulin to phospholipid on drug content in the complex
2.2 复合物在水中的分散状态
称取适量胰岛素-磷脂复合物,分别分散于10 mL pH值2.0、蒸馏水及pH值7.4缓冲液中,搅拌使分散均匀。于光学显微镜下观察样品在各分散介质中的外观状态,结果如图2所示。

Fig. 2 Micrograph of insulin-phospholipid complex dispersed in pH 2.0 buffer(A), water(B) and pH 7.4 buffer(C)
从图2中可以看出,分散介质的pH值对复合物的分散状态有显著影响。复合物在pH值2.0、蒸馏水及pH值7.4缓冲液中分散后的平均粒径约为5、4及1 μm。卵磷脂中除主要含有磷脂酰胆碱外,还含有相当部分的酸性磷脂(磷脂酸),因此带有较多的负电荷。在酸性环境中磷酸基发生质子化,负电荷数量降低而使分散颗粒表面电性趋于中性,因此可以聚集导致粒径增大。而在碱性环境中,则由于静电斥力使头部基团分开,因此分散粒径较小。
2.3 红外光谱(IR)分析
采用KBr压片法分别对胰岛素、卵磷脂、胰岛素磷脂复合物及物理混合物在500~4 000 cm-1进行红外扫描,结果见图3。
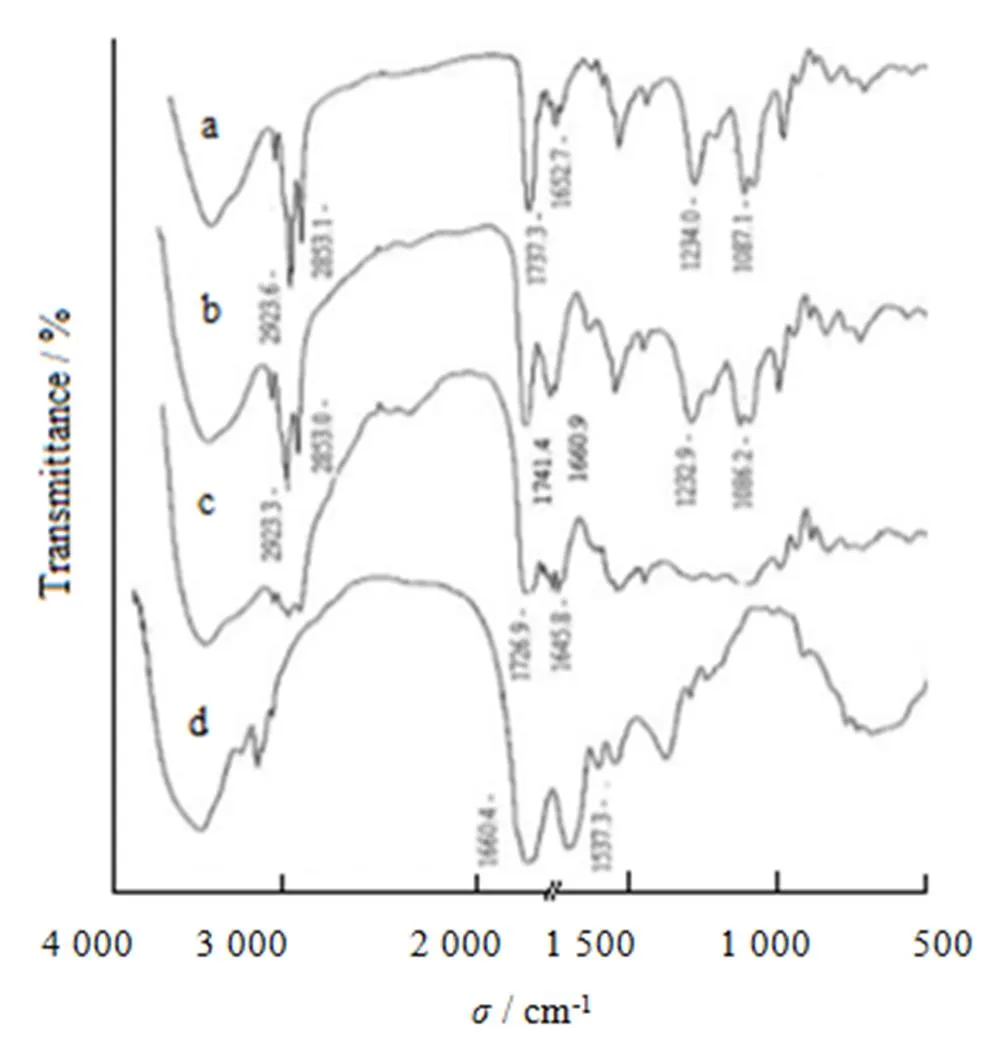
Fig. 3 Infrared spectra of phospholipid (a), physical mixture (b), complex (c) and insulin (d)
图3中卵磷脂与胰岛素混合物的IR(b曲线)基本是该两组分各自IR的叠加,其中:卵磷脂1 500~700 cm-1的吸收峰被胰岛素相应范围内较宽的吸收峰所掩盖而形成较宽的峰体,但其1 462 cm-1和1 087cm-1处的特征吸收峰仍能找到;而1 737 cm-1和1 652 cm-1处的特征吸收峰则因与胰岛素1 660 cm-1和1 537 cm-1处的特征吸收峰靠得较近而相互重叠在一起,形成混合物IR中1 726 cm-1和1 645 cm-1两处特征吸收峰。胰岛素磷脂复合物的IR(c曲线)则与混合物的IR明显不同,其中胰岛素的1 660 cm-1(-NH)吸收峰和磷脂1 737 cm-1(νC=O)、1 232 cm-1(νP=O)吸收峰的形状和强度均发生了一定的变化,说明胰岛素结构中的—NH2与磷脂分子中的极性磷酸基团发生了相互作用。卵磷脂1 737 cm-1(νC=O)吸收峰发生变化说明胰岛素分子有可能与其脂肪酸链产生了疏水相互作用。在胰岛素磷脂复合物的红外图谱中未出现新的特征吸收峰,表明两者之间没有形成共价键,未产生新的化合物,而是以物理相互作用结合的复合物。
2.4 X-射线衍射分析
分别将胰岛素、卵磷脂、胰岛素磷脂复合物及相同质量比的胰岛素磷脂物理混合物进行X-射线衍射分析。检测条件:石墨单色器单色化CuKα辐射,管电40 kV,管流60 mA,衍射范围5º<2<50º。分别对胰岛素、卵磷脂、胰岛素磷脂复合物及物理混合物进行X-射线衍射分析,结果见图4。
图4所示的X-射线衍射谱(a曲线)中,猪胰岛素在2<20º内有许多尖峰,其后出现一个大而宽的弥散峰,表明本实验所用的猪胰岛素为晶体和无定形的混合态;而卵磷脂(b曲线)则具有典型的无定形的特征,这与文献报道是一致的[7-8]。在胰岛素与卵磷脂的物理混合物的衍射图谱(c曲线)中仍能观察到胰岛素的晶体衍射峰,只是数量有所减少,强度也有所减弱。而在相同配比的胰岛素与磷脂复合物的衍射图谱中(d曲线),胰岛素的晶体衍射峰完全消失,使得该复合物呈现出无定型特征。
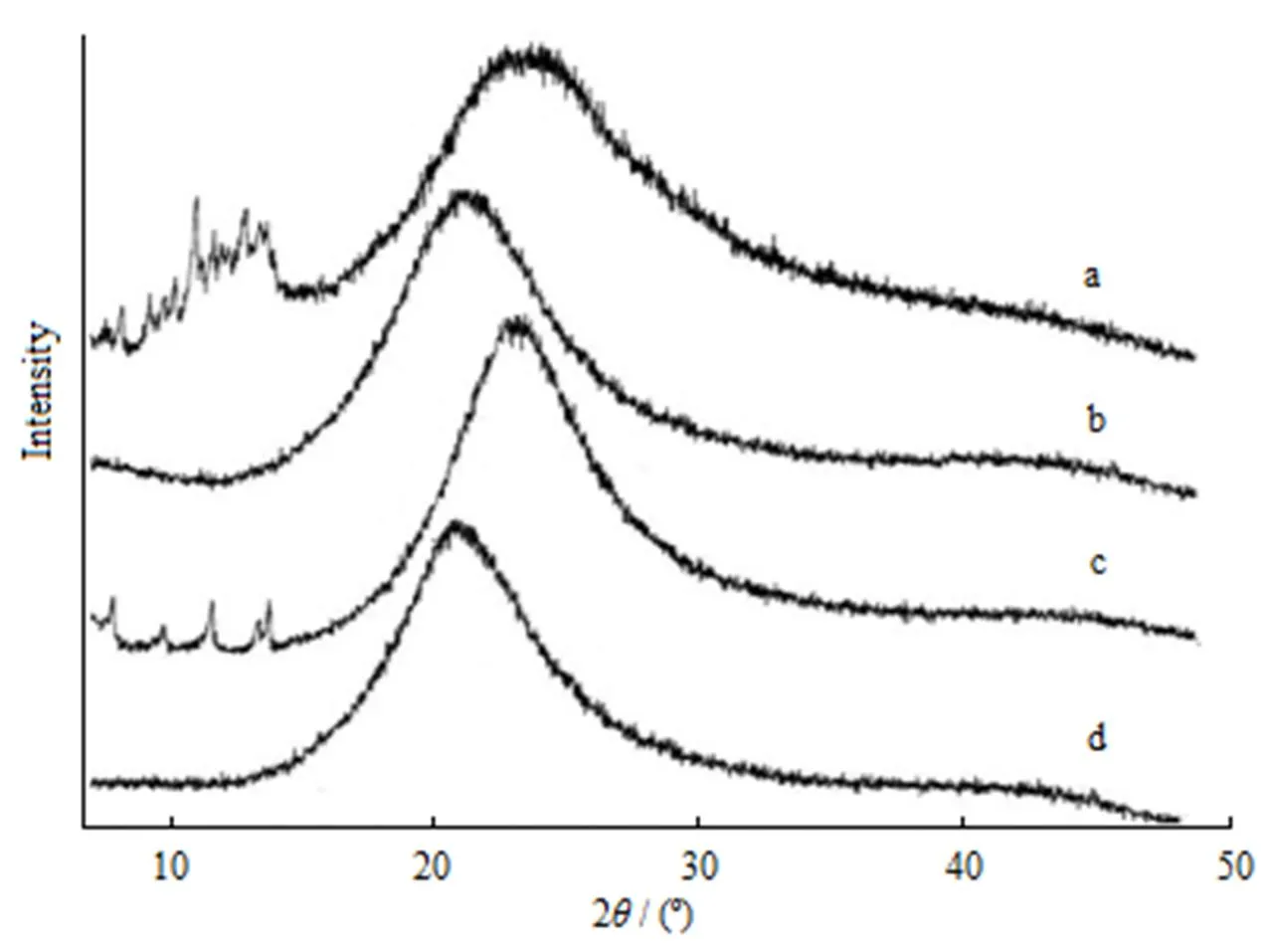
Fig. 4 X-ray diffraction patterns of insulin (a), phospholipid (b), their physical mixture (c) and complex (d)
2.5 复合物中胰岛素表观油/水分配系数的测定
采用摇瓶法测定[9]:分别配制pH值2.0、pH值5.0、pH值7.4磷酸盐缓冲液以及双蒸水。精密称取处方量的胰岛素磷脂复合物,分别溶于上述水溶液饱和的正辛醇中,然后加入等体积的正辛醇饱和的相应水溶液,于25 ℃下置于恒温振荡器中振摇24 h,静置30 min,吸取下层水溶液,稀释后RP-HPLC法测定胰岛素含量。按下式计算表观油水分配系数,结果见表2。
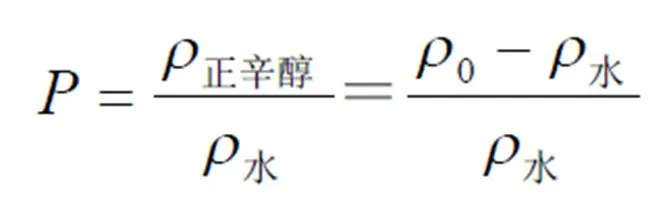
其中,正辛醇为正辛醇相中胰岛素的质量浓度(mg∙L-1),水为水相中胰岛素的质量浓度(mg∙L-1),0为分配前正辛醇相中胰岛素的质量浓度(mg∙L-1)。

Table 2 Apparent partition coefficient of insulin complex with phospholipid in the system of n-octyl alcohol and water (n=3)
2.6 胰岛素-磷脂复合物降血糖活性考察
将胰岛素及胰岛素磷脂复合物分别用含质量分数1% Triton X-100的pH值7.4磷酸盐缓冲液溶解并配制成71.4 mg∙L-1的溶液(相当于2 IU∙mL-1)。取禁食过夜的大鼠分为2组,每组5只,分别皮下注射供试溶液0.1 mL(相当于1.0 IU∙kg-1)。给药后30、60、120和180 min从眼角静脉丛取血0.3 mL,5 000 r∙min-1离心5 min,取20 μL血浆,用葡萄糖氧化酶法测定血糖浓度,计算不同时间的血糖浓度占初始血糖浓度的百分率。大鼠皮下注射胰岛素溶液及胰岛素磷脂复合物后血糖浓度及降糖变化百分率如图5所示。
结果表明,胰岛素溶液与复合物皮下注射后大鼠血糖浓度迅速下降,60 min达到血糖最低点,分别为初始血糖的28.53%和34.47%。两组样品对正常大鼠血糖均有明显的降低作用,在同等剂量下作用强度差异无显著意义(>0.05)。
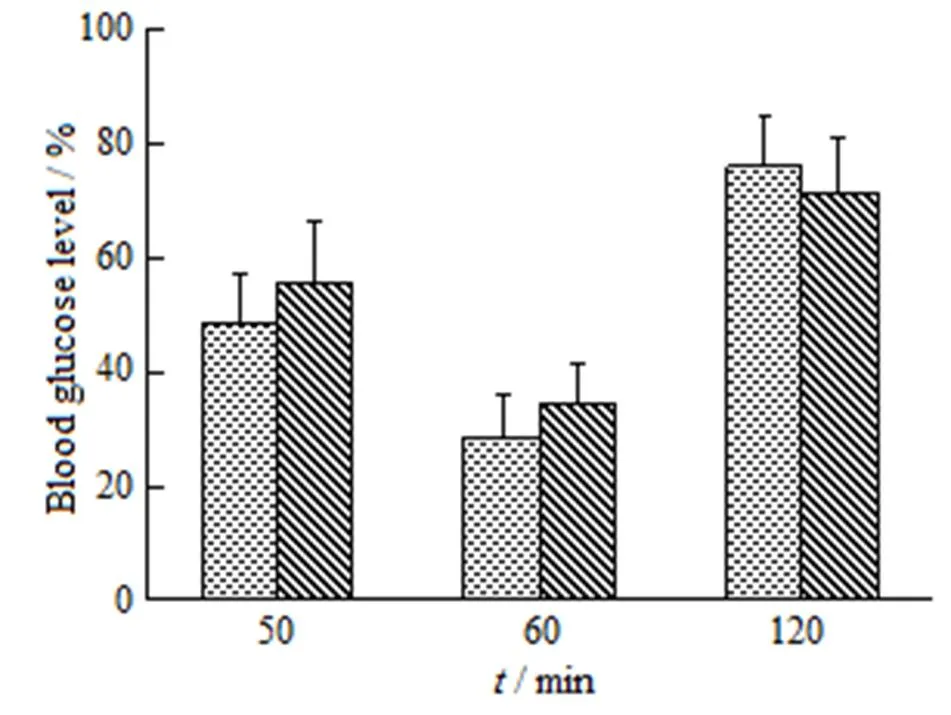
—Native insulin; —Insulin complex
3 讨论
a. 胰岛素分子量大、亲水性强及分子间易于聚集的本质极大地阻碍了其口服吸收效率。卵磷脂含有丰富的磷脂酰丝氨酸及磷脂酸等带有大量的负电荷酸性磷脂,可在一定条件下与胰岛素肽链N末端-氨基及侧链-氨基等碱性基团形成离子对复合物。复合物的形成可改善亲水性生物大分子的脂溶性并防止分子间聚集,提高小肠上皮细胞脂质双分子层的渗透能力,从而有利于药物的吸收[10]。
b. 目前国内外文献报道的有关天然活性成分磷脂复合物的制备大多是在非质子传递溶剂中进行,如丙酮、四氢呋喃、二氧六环等[11-12]。但胰岛素是一种生物活性大分子,其对外界环境非常敏感,与这类非水有机溶剂接触很容易失去活性[13]。由于二甲亚砜的生物相容性比较好,它是生命科学领域中常用的细胞、蛋白质等生物活性物质的冷冻保护剂;而且由于二甲亚砜具有较高的凝固点(18.4 ℃),且对胰岛素溶解性非常好,因此选择二甲亚砜作为溶剂系统,并采用冷冻干燥法除去有机溶剂。大鼠降血糖试验结果初步证明该法制备的复合物不会影响胰岛素的生物活性。
c. 胰岛素与磷脂之间主要通过分子间疏水作用等非共价键形成复合物。胰岛素分子中含有大量的疏水残基,如Phe、Tyr、Val等,在三级结构中这些疏水性基团都被包围在分子内部,而Gly等亲水基分布在分子表面,使整个胰岛素分子呈现亲水性质。当胰岛素分子中引入四氢呋喃、二甲亚砜等非质子有机溶剂后,胰岛素肽链被打开而使大量疏水残基外露,从而可与磷脂分子的疏水碳链相互结合。值得注意的是,胰岛素的疏水内核被打开后有可能造成其生物活性的不可逆损失。二甲亚砜具有良好的生物相容性,文献报道二甲亚砜虽可暂时改变胰岛素的构象,但除去后胰岛素的构象又会重新恢复[14]。作者在大鼠降糖试验中也初步证明了冷冻干燥除去二甲亚砜后,胰岛素的活性没有发生显著变化。
d. 复合物中胰岛素在pH值5.0磷酸盐缓冲液-正辛醇系统和双蒸水-正辛醇系统中的表观油/水分配系数较大,而在pH值2.0和7.4磷酸盐缓冲液中的表观油/水分配系数则较小。这表明胰岛素磷脂复合物在水溶液中的结合稳定性与介质的离子强度及pH有关。低离子强度有助于胰岛素与磷脂的结合,而缓冲液中的离子强度则会大大削弱两者之间的相互作用。另外,接近胰岛素等电点(pI 5.3)处的pH有利于磷脂与胰岛素的结合稳定性。
e. 本实验中制备的复合物是载有胰岛素的生物制剂,其生物活性稳定性是评价该类制剂稳定性的一个重要指标,小鼠血糖法[15]测定制剂中胰岛素的生物效价变化是评价胰岛素活性稳定性的一个最可靠的指标。由于本法较为繁琐,且耗资大,故本实验中采用正常大鼠为研究对象,评价皮下给药1 h后,制剂对正常大鼠的降血糖作用强度,从而间接反映制剂中胰岛素生物活性的变化。
[1] Mitragotri S, Burke P A, Langer R. Overcoming the challenges in administering biopharmaceuticals: formulation and delivery strategies[J]. Nat Rev Drug Discov, 2014, 13 (9): 655-672.
[2] Hashizume M,Douen T,Murakami M,et al. Improvement of large intestinal absorption of insulin by chemical modification with palmitic acid in rats[J]. J Pharm Pharmcol, 2011, 44 (7): 555-559.
[3] Lee E, Lee J, Jon S. A novel approach to oral delivery of insulin by conjugating with low molecular weight chitosan [J]. Bioconjug Chem, 2010, 21(10): 1720-1723.
[4] Chaturvedi K, Ganguly K, Kulkarni A R, et al. Oral insulin delivery using deoxycholic acid conjugated PEGylated polyhydroxybutyrate co-polymeric nanoparticles[J]. Nanomedicine, 2015, 10(10): 1569-1583.
[5] 崔福德, 石凯, 寸冬梅. 蛋白多肽类药物纳米粒口服给药系统的研究进展[J]. 沈阳药科大学学报, 2010, 27(12): 946-951.
[6] 吴珊珊, 熊富良, 宋豪源, 等. 羧甲基壳聚糖-聚乙二醇作为胰岛素载体的研究[J]. 中国医院药学杂志, 2017, 37(10): 906-910.
[7] Singh C, Bhatt T D, Gill M S, et al. Novel rifampicin-phospholipid complex for tubercular therapy: synthesis, physicochemical characterization andevaluation[J]. Int J Pharm, 2014, 460(1/2): 220-227.
[8] 单凤英, 钟莹, 宋旭, 等. 白藜芦醇磷脂复合物制备工艺的优化及理化性质的研究[J]. 华西药学杂志, 2014, 29(3): 241-244.
[9] 熊耀坤, 梁爽, 杜焰, 等. HPLC法测定洋川芎内酯Ⅰ的平衡溶解度和表观油水分配系数[J]. 药物分析杂志, 2012, 32(9): 1644-1647.
[10] OLIVEIRA M S, GOULART G C A, FERREIRA L A M, et al. Hydrophobic ion pairing as a strategy to improve drug encapsulation into lipid nanocarriers for the cancer treatment[J]. Expert Opin Drug Del, 2016, 14(8): 983-995.
[11] Li F, Yang X, Yang Y, et al. Phospholipid complex as an approach for bioavailability enhancement of echinacoside[J]. Drug Dev Ind Pharm, 2015, 41(11): 1777-1784.
[12] Fong S Y, Brandl M, Bauer-Brandl A. Phospholipid-based solid drug formulations for oral bioavailability enhancement: A meta-analysis[J]. Eur J Pharm Sci, 2015, 80: 89-110.
[13] Wang W, Martin-Moe S, Pan C, et al. Stabilization of a polypeptide in non-aqueous solvents[J]. Int J Pharm, 2008, 351(1/2): 1-7.
[14] Snavely W K, Subramaniam B, Rajewski R A, et al. Micronization of insulin from halogenated alcohol solution using supercritical carbon dioxide as an antisolvent[J]. J Pharm Sci, 2002, 91(9): 2026-2039.
[15] 李湛军.《中国药典》胰岛素生物测定简化方法及其快速检测的研究[J]. 中国药品标准, 2012, 13(5): 336-340.
Study on the preparation and physicochemical properties of insulin-phospholipid complex
BI Hongshu, FANG Yan, GAO Shan, YANG Dongjuan, SHI Kai*
(,,110016,)
To study the preparation and physicochemical properties of insulin-phospholipid complex.The insulin-phospholipid complex was prepared by non-aqueous solvent-freeze drying method, and its physical and chemical properties and apparent oil/water partition coefficient were characterized by infrared spectrum and X-ray diffraction. In addition, the hypoglycemic test was used to evaluate the changes in the biological activity of phospholipid-insulin complex.Through drawing the three-phase diagram, it is determined that the preferred formulation and process of the composite formation are: DMSO 90%-100%, glacial acetic acid 0-10%, and phospholipid 0-5%. Infrared spectra analysis showed that the interaction between insulin and phospholipid in the complex existed, but no new characteristic absorption peaks were observed, which indicated that no new covalent bonds were formed. X-ray diffraction analysis exhibited that the complex was in an amorphous form. The apparent partition coefficient of insulin complex with phospholipid was related to the ionic strength and pH of aqueous dispersion medium. Low ionic strength and pH closed to the isoelectric point of insulin will be favorable to the binding stability of complex. The hypoglycemic experiment in rats showed that the preparation process had no significant effect on the biological activity of insulin. There was no significant difference in the hypoglycemic effect between the insulin complex group and the solution group.After forming the complex of insulin and phospholipids, the physical and chemical properties of insulin change significantly, especially the lipophilicity increases and the biological activity is better maintained.
pharmaceutics; insulin-phospholipid complex; non-aqueous solvent freeze drying method; insulin; phospholipid; complex; preparation; physicochemical properties
R94
A
(2019)05–0149–08
10.14146/j.cnki.cjp.2019.05.001
2018-04-09
国家自然科学基金资助项目(31671020)
毕洪书(1976-), 女(汉族), 河北遵化人, 硕士研究生, E-mail bhongshu@163.com;
石凯(1977-), 男(汉族), 辽宁新金人, 教授, 博士, 主要从事蛋白质药物纳米给药系统的研究, Tel. 024-43520557, E-mail ashikai@163.com。
(本篇责任编辑:赵桂芝)

