核壳脂质聚合物混合纳米粒制备的研究进展
董 爽,陈巧巧,王东凯*
核壳脂质聚合物混合纳米粒制备的研究进展
董 爽,陈巧巧,王东凯*
(沈阳药科大学 药学院,辽宁 沈阳 110016)
介绍核壳脂质聚合物混合纳米粒的制备方法。以国外30篇相关文献为依据,综述了核壳脂质聚合物混合纳米粒的特点及优势,介绍了该制剂的结构类型、组分构成、制备方法及影响因素。核壳脂质聚合物混合纳米粒可以作为疏水性和亲水性药物及基因的载体。核壳脂质聚合物混合纳米粒作为药物递送系统具有广阔的应用前景,制备方法仍需继续探索。
药剂学;混合纳米粒;综述;核壳脂质聚合物;制备方法;两步法;一步法
在过去的几十年中,人们对纳米技术进行了广泛地探索,开发了无数功能性纳米结构载体[1],用以递送治疗剂和成像剂到靶部位[2],其中,脂质体和聚合物纳米粒作为两种主要的递送载体,虽然两种制剂具有许多的优点,但制剂本身的一些固有限制使其在应用上受到了限制[3-5]。聚合物纳米粒在结构完整性、储存期间的稳定性、制备方法的多样性和一定的控释能力等方面表现出较大的优势,但也具有一些局限性,包括在生产过程中使用有毒的有机溶剂、亲水性药物包封性较差、在到达靶组织之前药物泄漏、聚合物的细胞毒性和降解等问题。脂质体是临床上应用较多的一种制剂,由于其由天然磷脂、胆固醇和合成磷脂制备,基本上是生物膜的类似物,因此具有较好的生物相容性,但由于其缺乏结构完整性,容易导致内容物泄漏和储存期间的不稳定,脂溶性药物包载于脂质双层结构中,导致其包载脂溶性药物的空间有限,因此载药量受到限制。最近,已经开发出了一种新型纳米药物递送系统,称为核壳型脂质-聚合物混合纳米粒(core-shell-type lipid-polymer hybrid nanoparticles,CSTLHPN)[6],其结合了脂质体和聚合物纳米粒的优势,同时克服了它们的一些缺点。这种新的纳米粒以疏水聚合物为核心,以围绕聚合物核心的脂质及其亲水冠为壳,内部的疏水聚合物为脂溶性药物提供有效容载空间的同时,可以控制药物的释放,并且对外部的脂质膜具有一定的支撑作用,赋予制剂一定的机械强度,增加制剂的稳定性,外部的脂质层提供了较好的生物相容性,具有细胞膜类似性质,并起到分子栅栏的作用,其在CSTLHPN制备期间减少包封药物的泄漏,此外,内脂质层通过限制水向内扩散来减缓内部聚合物的降解速率,同时PEG化的磷脂可增加制剂表面的亲水性,允许纳米粒逃避免疫系统并赋予其长循环特性,还可以通过设计PEG末端基团修饰,实现制剂的主动靶向[7]。
1 载体结构类型
根据制备方法的不同,制得不同结构的CSTLHPN,结构类型如图1。
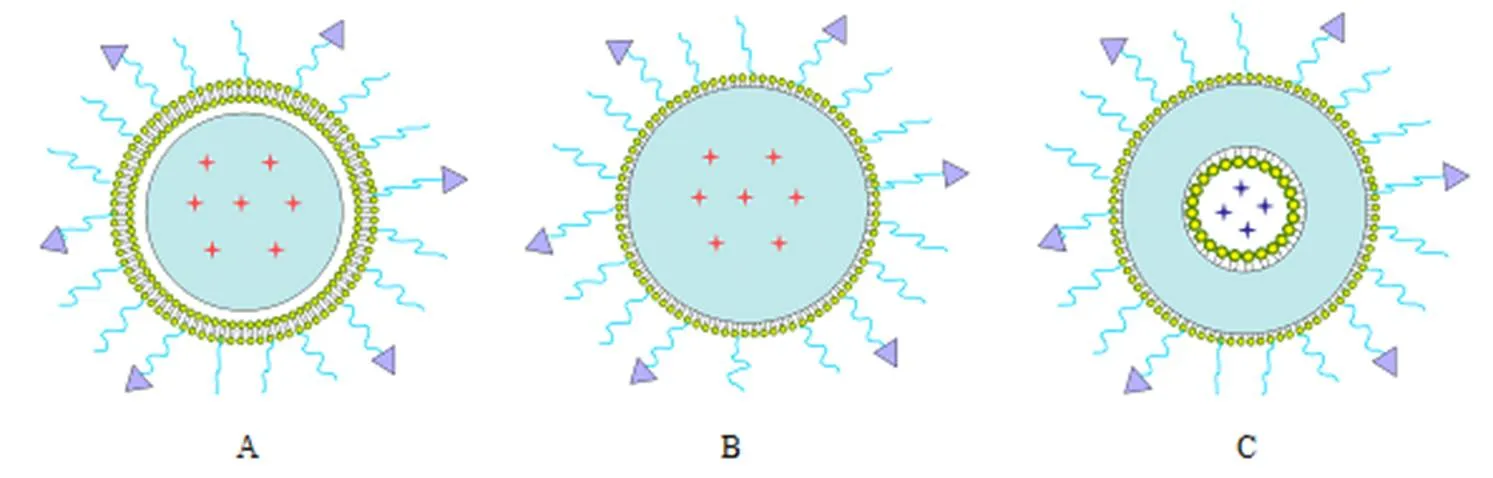
A—CSTLHPN prepared by two-step method; B—CSTLHPN prepared by one-step nanoprecipitation method or single emulsion/solvente vaporation method; C—CSTLHPN prepared by double emulsion/solvent evaporation method; —PEG; —Targetedligand; —Hydrophobic drug; —Hydrophilic drug;—Polymer
2 载体的组分构成
2.1 聚合物核心的构成
聚合物核心作为制剂中的疏水部分,目前,大多数制剂以生物可降解的材料为主,如聚(乳酸-共-羟基乙酸)(PLGA)[7-9]、聚己内酯(PCL)、聚乳酸(PLA)[10-11],有些采用聚乙烯亚胺(PEI)[12]、聚氨基酯(PAE)[13]、聚阳离子-聚赖氨酸作为聚合物核心,以吸附siRNA或DNA。药物包封在聚合物中使得药物具有缓慢释放的特征,这可以显著减少血液循环中的药物泄漏。核的疏水性使其能够通过疏水作用简单地包封和递送疏水性药物,这种方式往往由于作用力不强而导致负载量不高。然而,Santosh Aryal等将两种药物通过化学键和聚乳酸连接起来作为核心材料,得到了较高的负载率[14]。文献中使用多柔比星(DOX)和喜树碱(CPT)作为两种模型化疗药物,将各种比例的DOX-PLA和CPT-PLA缀合物加载到纳米颗粒中,具有超过90%的负载效率,但该种化学键不具有刺激敏感性,只发挥单纯的连接作用。李萌等将多西紫杉醇(DTX)通过单硫醚键与油酸(LA)连接起来,形成DTX-S-LA,使其具有刺激响应性[15]。
2.2 脂质外壳的构成
目前,文献中已经报道的脂质材料有,二油酰磷脂酰胆碱(DOPC)、磷脂酰胆碱(EPC)[9]、胆固醇(CHOL)、1,2-二月桂酰磷脂酰胆碱(DLPC)、1,2-二硬脂酰基--甘油-3-磷酸乙醇胺-聚乙二醇(DSPE-PEG)等。脂质可以在聚合物核心形成生物相容的保护层,以防止药物小分子自由扩散出聚合物核心,从而改善药物包封率和负载率,降低水进入聚合物核心的渗透速率,从而降低聚合物的水解速率,缓慢释放药物。在不同的制备方法中,两步法通常含有胆固醇,作为流动性调节剂,稳定脂质双分子层。胡云等研究表明,制剂中较高浓度的胆固醇可以促进纳米粒的体外细胞摄取,改善脂质层的稳定性,并且在长期储存期间保护纳米粒结构的完整性[16]。在脂质组成中,通常含有PEG修饰的脂质,亲水的PEG可以形成亲水性聚合物壳,以增强纳米粒的稳定性和全身循环半衰期。Rajendran JC Bose等研究了阳离子脂质对制剂特征的影响,随着阳离子脂质浓度的增加,CSTLHPN的粒径减小而表面电位增加,同时也增加了CSTLHPN的体外转染效率[17]。有些文献报道,可在PEG末端修饰配体以实现主动靶向[18-19]。
2.3 封装药物
文献中报道,CSTLHPN可以作为疏水性药物、亲水性药物以及基因的载体,是个有前途的载药平台。疏水的聚合物核心可以包封疏水性药物,如紫杉醇、多西紫杉醇、阿霉素、姜黄素[12,20-23]等,聚合物核心可包载一种药物,也可同时包封两种疏水性药物,可通过疏水作用也可通过化学连接方式。此外,也可将药物包封在脂质外壳中,文献中报道,将两种药物分别包载在聚合物核心和脂质外壳中,实现脂质层的药物先释放而聚合物核心的药物后释放的顺序释放。CSTLHPN除包封疏水性药物外,同时也可包封亲水性药物,如吉西他滨、左氧氟沙星、妥布霉素等,通常包封于聚合物内部的亲水性空心核当中,如图1中所示。同时,CSTLHPN也可包载DNA和siRNA[24-25],可包封在内部亲水核中,也可吸附在外部脂质层上。
3 制备方法
目前,出现的CSTLHPN制备方法主要有如下两种方法,两步法和单步法,本篇综述对于较常规的制备方法进行总结整理,由于其所用的仪器较普遍,适用性较强。对于非常规的制备方法,如利用微流体操作平台和喷雾干燥制备纳米粒的方法不予详述。
3.1 两步法
两步法是早期阶段最常用的方法[26]。在常规的两步法中,需要预先制备聚合物纳米粒和脂质囊泡,再将其混合,利用外力使脂质膜重组在聚合物纳米粒表面,形成脂质聚合物混合纳米粒。一般通过这种方法制备的CSTLHPN外层具有双层或多层脂质膜,聚合物纳米粒通常通过乳化-溶剂蒸发、纳米沉淀或高压均质化等合适的方法制备,脂质膜通过将脂质溶解在有机溶剂(例如氯仿)中,并在旋转蒸发器中蒸发除掉有机溶剂来制备,然后将纳米粒和脂质膜混合,有两种混合方式,可将先前形成的聚合物纳米粒混悬液直接添加到干燥的脂质膜中,也可加入到水合后制备的预制脂质囊泡中,然后通过在高于脂质相转变温度的温度下对混合的聚合物/脂质混悬液进行涡旋或超声处理来制备CSTLHPN,通过离心将CSTLHPN与未吸附的脂质囊泡分离,获得最终产品。两步法制备CSTLHPN的步骤图见图2。
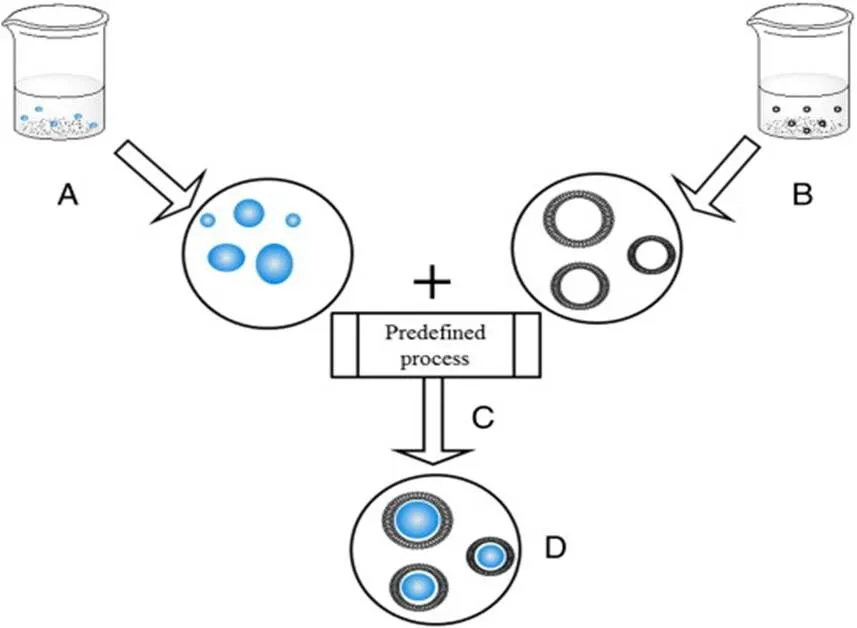
A—Polymeric nanoparticle cores (PNPs) are preparedseparately; B—Lipid shells (liposomes) are prepared separately; C—Both polymeric cores and lipid shells are mixed and incubated; D—Finally, lipoparticlesare obtained
Wang等将PLGA和多西紫杉醇完全溶解在丙酮中,通过乳液-溶剂蒸发技术制备PLGA纳米粒核, 将磷脂、胆固醇和芬戈莫德的混合物溶解在氯仿中,减压蒸发形成脂质膜。为控制最终产品的粒径,对制得的聚合物纳米粒进行了离心分级,并选取尺寸较小的PLGA纳米粒的水溶液添加到膜中,使用手持式挤出机将所得悬浮液通过200 nm膜挤出以产生脂质囊泡,获得PLGA核和CSTLHPN的大小分别为(88.4 ± 1.7)nm和(141.5 ± 1.2)nm,具有-29.9 mV的负表面电荷。所得制剂实现了多西紫杉醇与芬戈莫德(FTY720)(临床使用的鞘氨醇激酶1抑制剂)的共同包封,多西紫杉醇封装在核心,而芬戈莫德封载在脂质膜内,多西紫杉醇和FTY720在CSTLPHN中的包封分别为10%和70%,多西紫杉醇的低包封效率可能是由于选择了较小的PLGA核心作为制备原料[23]。
CSTLPHN不仅可以实现包封疏水性药物,同时还可以包封亲水性药物。此时,需要聚合物核心内部具有含水空腔,即需要用双乳液-溶剂蒸发法制备聚合物纳米粒核心。将聚合物溶于二氯甲烷等与水不混溶的溶剂中形成溶液,后将去离子水加入到有机溶液中,通过超声处理将混合物乳化形成乳液,将乳液加入到外水相中进一步超声处理乳化,形成水包油包水乳液,并在室温下搅拌或真空下蒸发除去溶剂,离心收集聚合物纳米粒,并再次分散在蒸馏水中。磷脂和胆固醇混合物溶解在二氯甲烷等溶剂中,然后在减压下除去有机溶剂形成脂质膜,再加入聚合物混悬液,超声处理后,脂质薄膜将包裹在聚合物纳米粒表面,在室温下离心,收集制品。赵等同时包封了亲水性药物和siRNA,这种制法可以提供包载亲水性药物的空间,亲水性的吉西他滨可以在第一次乳化中加载到聚合物纳米颗粒的亲水核心中,这产生油包水(W/O)乳液,然后加入阳离子-聚赖氨酸共聚物,接着进行第二次乳化,产生水包油包水(W/O/W)乳液,然后将乳液加入表面活性剂中以形成聚合物纳米粒,同时添加阴离子siRNA或DNA,它们可以通过静电相互作用结合在阳离子聚合物纳米粒的表面上。然后将脂质混合物形成脂质膜,通过在超声下自组装来形成脂质包被核壳脂质纳米粒,具有141.8 nm 的粒径,-34 mV的表面电位,其中吉西他滨的最高封装效率约为42%[27]。
3.2 单步法
为了简便实验操作,减少准备步骤,对制备方法进行了改进,开发了单步法,不需预先制备聚合物纳米粒和脂质囊泡,一步混合聚合物和脂质溶液,之后它们通过乳化-溶剂蒸发或纳米沉淀自组装形成聚合物脂质纳米粒,根据所用溶剂种类不同,分成两种方法。采用与水不混溶的有机溶剂溶解聚合物的是乳化-溶剂蒸发法,采用与水混溶的溶剂溶解聚合物的是纳米沉淀法,具体步骤见图3。
3.2.1 乳化-溶剂蒸发法
当待包封的物质可溶于与水不混溶的溶剂(即油相)时,采用单一的乳化-溶剂蒸发法。在该方法中,在恒定搅拌或超声波处理下,将含有聚合物和待包封物质的油相加入含有脂质的水相中,形成水包油(O/W)乳液。当通过蒸发除去有机溶剂时,形成聚合物核心,同时脂质在聚合物核心周围自组装形成CSTLPHN。刘等利用改进的乳化-溶剂蒸发法将PLGA和紫杉醇溶解在二氯甲烷中作为油相,通过超声分散DLPC来制备水相,然后,在搅拌下将油相与水相混合,通过探针超声波发生器对混合物进行超声处理,将制备的乳液置于磁力搅拌器上以中等速度蒸发二氯甲烷过夜,获得粒径244 nm的纳米粒,包封率56.1% ± 0.07% 。
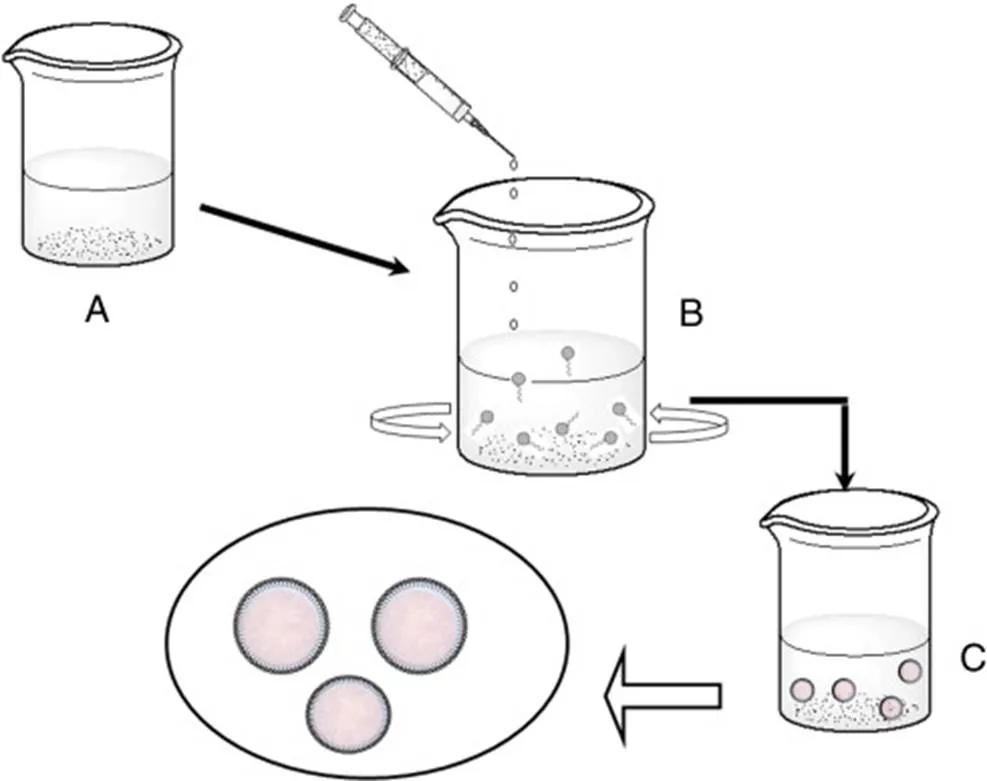
A—Drug, polymer dissolved in organicsolvent forming organic phase; B—The organic phase is added dropwise into the aqueous phase containing phospholipids; C—The resulting dispersion issonicated or homogenized to obtain CSLPHNs
当待包封的物质不溶于任何有机溶剂时,采用双乳化-溶剂蒸发法(W/O/W)。即将其溶解在水相中并在含有聚合物和脂质的油相中乳化,将得到的W/O乳液在含有脂质-PEG的水相中第二次乳化,形成W/O/W乳液,在有机溶剂蒸发后,产生CSTLPHN。对于双乳化-溶剂蒸发法,所产生的CSTLPHN在其结构方面略有不同,其中包括:围绕水性空心核的内脂层;中间聚合物层和外层的PEG,内部空心核可以作为水溶性药物的储存空间。Wean Sin Cheow等首次尝试使用双乳化-溶剂-蒸发(DESE)方法将不溶于油相的水溶性药物包封到混合纳米颗粒中,将PLGA溶解在与水不混溶的溶剂(二氯甲烷)(即油相)中,同时将抗生素分别溶解在去离子水(内部水相)中,将这两种溶液在超声波下乳化以形成 W/O纳米乳液,随后将其加入第二水相(外部水相)中以形成W/O/W 纳米乳液。
3.2.2 纳米沉淀法
在该方法中,聚合物和待包封的物质溶解在与水混溶的有机溶剂(例如乙腈或丙酮)中,而脂质和/或脂质-PEG分散于水中,形成均匀的分散体,脂质和/或脂质-PEG溶液通常需加热至约65~70 ℃,然后在连续搅拌下将聚合物溶液滴加到含脂质的水分散体中。由于水是聚合物和药物的不良溶剂,当溶解聚合物的溶剂可与水接触后,与水混溶,使得溶解聚合物和药物的溶剂减少,使其析出沉淀,同时,由于疏水相互作用,脂质在聚合物纳米颗粒周围自组装,其中脂质的疏水性尾部连接到聚合物核心,而亲水性头部伸出到外部水性环境,导致形成脂质聚合物纳米粒,为减小粒径,可将混合物均化或超声处理。
张等将PLGA聚合物和多西紫杉醇溶解在乙腈中,将卵磷脂和DSPE-PEG溶解在40 mg∙L-1的乙醇水溶液中,将卵磷脂和 DSPE-PEG溶液加热至65 ℃以确保所有脂质处于液相,然后在温和搅拌下将所得PLGA溶液滴加到预热的脂质溶液中,将混合溶液剧烈涡旋,促进聚合物与脂质相互接触,溶剂与水的混合,然后在室温下温和搅拌,使纳米颗粒完成自组装,同时除去有机溶剂,使用离心过滤器,除去剩余的有机溶剂和游离分子,制得的纳米粒子大小为70~80 nm,具有-30~-35 mV的表面电位,有59% ± 4%的多西紫杉醇包封到制剂中,而PLGA-PEG纳米粒和PLGA纳米粒的包封产率分别约为19% ± 3%和37% ± 4%,表明该制剂成功提高了载药量。
严等使用纳米沉淀技术制备多西紫杉醇(DTX)-姜黄素(CUR)CSTLHPN。首先将多西紫杉醇、姜黄素和PLGA溶解在乙腈中,将卵磷脂和PEG-DSPE溶解的40 mg∙L-1乙醇水溶液中,并加热至60 ℃,然后在温和搅拌下将药物和PLGA乙腈溶液逐滴加入预热的脂质水溶液中,最终获得CSTLHPN。获得粒径为169.6 nm,zeta电位为35.7 mV,DTX-CUR-CSTLHPN的DTX和CUR 包封率分别约为89%和82%,DTX-CSTLHPN和CUR-CSTLHPN 80%和73%,包封率没有明显差异,表明CSTLHPN对同时装载两种不同药物具有突出的药物包封能力[28]。
Diana Dehaini等使用改进的纳米沉淀法,通过仔细控制溶剂组成、聚合物浓度、脂质聚合物比例等条件,制备了超小的脂质-聚合物杂化纳米颗粒。方法是将DSPE-PEG2000溶解在氯仿中,蒸发溶剂,然后将所得薄膜用含有Tris-HCl pH值8的水水合,在乙腈中溶解羧酸封端的PLGA,快速加入到含有DSPE-PEG2000的水相中,制得的制剂粒径小于25 nm,具有−10 mV的表面电位[29]。
3.3 制备过程中的影响因素
3.3.1 聚合物和磷脂的比例
磷脂作为纳米粒表面的稳定剂,包裹在纳米粒表面,对纳米粒的形态特征和稳定性起着至关重要的作用。当脂质与聚合物的比例过高时,过量的脂质可能会增加到卵磷脂的临界胶束浓度(CMC),导致脂质体的形成,这些脂质体将增强混合纳米粒的总体测量大小并降低它们的表面电位。相反,当脂质与聚合物质量比太低时,缺乏脂质来覆盖聚合物核心的表面,导致高的表面电位值。因此应该调节聚合物和脂质比例,以确定合适的粒径和表面电位[6]。两步法中,则可通过调节制得的聚合物纳米粒和预制脂质囊泡的质量比获得较优的粒径和表面电位。同时,Anna Bershteyn等发现,两者比例还可影响脂质分子在聚合物纳米核心的堆积状态,当聚合物和脂质以25∶1的质量比制备制剂时,脂质以单层的双分子层排布在纳米粒子表面,而当以25∶9的质量比投料时,脂质分子在聚合物核心以多层的双分子层形式堆积,形似“洋葱”状,而当在两性脂质分子中掺入带电的脂质分子时,却发现再一次呈现单个双分子层结构,表明脂质在聚合物核心的堆积状态和聚合物脂质比例以及脂质组成有关[30]。
3.3.2 聚合物纳米核心和预制囊泡的尺寸
两步法中聚合物纳米核心和预制囊泡是两个中间体,可通过控制两者的质量以制备高质量的最终制剂,在制得纳米粒核心后可通过离心筛选出粒径较小的纳米粒,进入下一步制备中。与通过薄膜水合形成的囊泡相比,通过挤出制备的预制囊泡尺寸更小且更均匀,因此当将后者添加到聚合物纳米粒悬浮液中时易于形成单分散的纳米粒。
3.3.3 脂质组成
CSTLPHN的单分散性除与囊泡的大小有关外,还取决于脂质囊泡的电荷,即与脂质组成有关。通过仅使用一种脂质(例如仅含有阳离子DPTAP或两性离子DPCC)形成的囊泡不易聚集。相比之下,由一种阳离子DPTAP与另一种两性离子DPPC制得的囊泡,由于静电相互作用易于聚集。当脂质组成中含有PEG链修饰时,PEG链的长度会影响纳米粒的表面电位和稳定性。当PEG链的长度较长时,稳定性要比短链的更好,这可能是由于长链的空间稳定性更好。虽然PEG 链也可改变制剂的表面电荷,但研究表明,空间稳定作用对制剂的稳定性起着更加决定性的作用。
3.3.4 其他因素
除此之外,聚合物的分子量和浓度也会影响制剂性质,固定的聚合物脂质比和脂质-PEG分数下,由于更紧密的填充,分子量越大将形成更小的纳米粒,而聚合物浓度越大将形成更大的纳米粒。有机相与水相的比例、超声时间功率均对制剂的质量有影响。
4 结语
核壳脂质聚合物混合纳米粒作为一个新型的药物递送系统,人们对于其制备方法仍在不断开发中,最先出现的两步法制备过程繁琐,两步法可以通过控制聚合物核心和脂质囊泡的尺寸来控制最终制剂的大小,但需要多步的准备操作,变异性较大,不好控制每批产品的一致性,这种制备方法具有温育步骤,无意中降低了药物包封效率,这是由于在纳米颗粒表面上形成脂质包衣之前包封的药物,尤其是高度水溶性的药物可能已经泄漏出来减少了包封率。之后为简便制备过程,开发了一步法,文献中报道的大多数CSTLPHN通过一步法制备,特别是纳米沉淀法,虽然该方法简便快速,但该方法的适用性受到限制,因为该方法仅允许包封可溶于水混溶性溶剂(通常为丙酮或乙腈)的水不溶性药物。另一种制备方法是乳化-溶剂蒸发法,能够包封更广泛的药物,无论其溶解度和亲水性如何,均可包封在一个制剂内部,这是由于乳液的较大灵活性。但与纳米沉淀法相比,乳化-溶剂蒸发法制得的纳米粒粒径较大。目前已有的制备方法虽然可以制得稳定的制剂,但也都存在一些局限,新的制备方法仍然需要不断探索开发。
[1] ZHANG L, GU F X, CHAN J M, et al. Nanoparticles in medicine: Therapeutic applications and developments[J]. Clinical Pharmacology & Therapeutics, 2008, 83(5): 761–769.
[2] WAGNER V, DULLAART A, BOCK A K, et al. The emerging nanomedicine landscape[J]. Nature Biotechnology, 2006, 24(10): 1211-1217.
[3] FAROKHZAD O C, CHENG J, TEPLY B A, et al. Targeted nanoparticle-aptamer bioconjugates for cancer chemotherapy[J]. Proceedings of the National Academy of Sciences of the United States of America, 2006, 103(16): 6315-6320.
[4] TORCHILIN V P. Micellar nanocarriers: pharmaceutical perspectives.[J]. Pharmaceutical Research, 2007, 24(1): 1-16.
[5] TONG R, CHENG J. Anticancer polymeric nanomedicines[J]. Polymer Reviews, 2007, 47(3): 345-381.
[6] ZHANG L, CHAN J M, GU F X, et al. Self-assembled lipid-polymer hybrid nanoparticles: A robust drug delivery platform[J]. ACS Nano, 2008, 2(8): 1696-1702.
[7] HADINOTO K, SUNDARESAN A, CHEOW W S. Lipid–polymer hybrid nanoparticles as a new generation therapeutic delivery platform: a review[J]. European Journal of Pharmaceutics and Biopharmaceutics, 2013, 85(3): 427-443.
[8] MESSERSCHMIDT S K E, MUSYANOVYCH A, ALTVATER M, et al. Targeted lipid-coated nanoparticles: Delivery of tumor necrosis factor-functionalized particles to tumor cells[J]. Journal of Controlled Release, 2009, 137(1): 69-77.
[9] SENGUPTA S, EAVARONE D, CAPILA I, et al. Temporal targeting of tumour cells and neovasculature with a nanoscale delivery system[J]. Nature, 2005, 436(7050): 568-572.
[10] THEVENOT J, TROUTIER A L, DAVID L, et al. Steric stabilization of lipid/polymer particle assemblies by poly (ethylene glycol)-lipids[J]. Biomacromolecules, 2007, 8(11): 3651-3660.
[11] ARYAL S, HU C M J, ZHANG L. Polymeric nanoparticles with precise ratiometric control over drug loading for combination therapy[J]. Molecular Pharmaceutics, 2011, 8(4): 1401-1407.
[12] LI J, HE Y, LI W, et al. A novel polymer-lipid hybrid nanoparticle for efficient nonviral gene delivery[J]. Acta Pharmacologica Sinica, 2010, 31(4): 509–514.
[13] SU X, FRICKE J, KAVANAGH D G, et al.andmRNA delivery using lipid-enveloped pH-responsive polymer nanoparticles[J]. Molecular pharmaceutics, 2011, 8(3): 774-787.
[14] ARYAL S, HU C M J, ZHANG L. Polymeric nanoparticles with precise ratiometric control over drug loading for combination therapy[J]. Molecular Pharmaceutics, 2011, 8(4): 1401-1407.
[15] ZHANG D, YANG J, GUAN J, et al.tailor-made protein corona of a prodrug-based nanoassembly fabricated by redox dual-sensitive paclitaxel prodrug for the super selective treatment of breast cancer[J]. Biomaterials science, 2018, 6(9): 2360-2374.
[16] HU Y, HOERLE R, EHRICH M, et al. Engineering the lipid layer of lipid–PLGA hybrid nanoparticles for enhancedcellular uptake and improved stability[J]. Acta biomaterialia, 2015, 28: 149-159.
[17] BOSE R J C, ARAI Y, AHN J C, et al. Influence of cationic lipid concentration on properties of lipid-polymer hybrid nanospheres for gene delivery[J]. International Journal of Nanomedicine, 2015, 10: 5367–5382.
[18] ZHAO P, WANG H, YU M, et al. Paclitaxel loaded folic acid targeted nanoparticles of mixed lipid-shell and polymer-core:andevaluation[J]. European Journal of Pharmaceutics and Biopharmaceutics, 2012, 81(2): 248-256.
[19] WANG H, ZHAO P, SU W, et al. PLGA/polymeric liposome for targeted drug and gene co-delivery[J]. Biomaterials, 2010, 31(33): 8741-8748.
[20] CHAN J M, ZHANG L, YUET K P, et al. PLGA–lecithin–PEG core–shell nanoparticles for controlled drug delivery[J]. Biomaterials, 2009, 30(8): 1627-1634.
[21] LIU Y, LI K, PAN J, et al. Folic acid conjugated nanoparticles of mixed lipid monolayer shell and biodegradable polymer core for targeted delivery of docetaxel[J]. Biomaterials, 2010, 31(2): 330-338.
[22] WONG H L, BENDAYAN R, RAUTH A M, et al. A mechanistic study of enhanced doxorubicin uptake and retention in multidrug resistant breast cancer cells using a polymer-lipid hybrid nanoparticle system[J]. Journal of Pharmacology and Experimental Therapeutics, 2006, 317(3): 1372-1381
[23] WANG Q, ALSHAKER H, BÖHLER T, et al. Core shell lipid-polymer hybrid nanoparticles with combined docetaxel and molecular targeted therapy for the treatment of metastatic prostate cancer[J]. Scientific Reports, 2017, 7(1): 5901.
[24] SHI J, XIAO Z, VOTRUBA A R, et al. Differentially charged hollow core/shell lipid–polymer–lipid hybrid nanoparticles for small interfering RNA delivery[J]. Angewandte Chemie International Edition, 2011, 50(31): 7027-7031.
[25] TROUTIER-THUILLIEZ A L, THEVENOT J, DELAIR T, et al. Adsorption of plasmid DNA onto lipid/polymer particle assemblies[J]. Soft Matter, 2009, 5(23): 4739-4747.
[26] MANDAL B, BHATTACHARJEE H, MITTAL N, et al. Core–shell-type lipid–polymer hybrid nanoparticles as a drug delivery platform[J]. Nanomedicine: Nanotechnology, Biology and Medicine, 2013, 9(4): 474-491.
[27] ZHAO X, LI F, LI Y, et al. Co-delivery of HIF1α siRNA and gemcitabine via biocompatible lipid-polymer hybrid nanoparticles for effective treatment of pancreatic cancer[J]. Biomaterials, 2015, 46: 13-25.
[28] ZENG S Q, CHEN Y Z, CHEN Y, et al. Lipid-polymer hybrid nanoparticles for synergistic drug delivery to overcome cancer drug resistance[J]. New Journal of Chemistry, 2017, 41(4): 1518-1525.
[29] DEHAINI D, FANG R H, LUK B T, et al. Ultra-small lipid–polymer hybrid nanoparticles for tumor-penetrating drug delivery[J]. Nanoscale, 2016, 8(30): 14411-14419.
[30] BERSHTEYN A, CHAPARRO J, YAU R, et al. Polymer-supported lipid shells, onions, and flowers[J]. Soft Matter, 2008, 4(9): 1787-1791.
Preparation of core-shell lipid polymer hybrid nanoparticles
DONG Shuang, CHEN Qiaoqiao, WANG Dongkai*
(,,110016,)
To introduce the preparation methods of core-shell lipid polymer hybrid nanoparticles.According to 30 related literatures, the characteristics and advantages of core- shell lipid polymer hybrid nanoparticles were reviewed. The structure types, compositions, preparation methods and influencing factors of the preparation were introduced.Core-shell lipid polymer hybrid nanoparticles can be used as carriers to load hydrophobic/hydrophilic drugs or genes.Core-shell lipid polymer hybrid nanoparticles have broad application prospects as drug delivery systems, but the preparation methods still need to be explored.
pharmaceutics; hybrid nanoparticles; review; core-shell-type lipid-polymer; preparation method; two-step method; one-step method
2019-02-26
董爽(1994-), 女(汉族), 辽宁沈阳人, 硕士研究生, E-mail dongsh1109@foxmail.com;
王东凯(1962-), 男(汉族), 辽宁沈阳人, 教授, 博士, 博士生导师, 主要从事药物制剂新剂型及缓控释制剂研究, Tel. 024-43520529, E-mail wangdksy@126.com。
R94
A
(2019)05–0186–09
10.14146/j.cnki.cjp.2019.05.005
(本篇责任编辑:赵桂芝)

