透明质酸在靶向抗肿瘤药物递送系统中的应用
崔斯雯,姜 瑶,王东凯
透明质酸在靶向抗肿瘤药物递送系统中的应用
崔斯雯,姜 瑶,王东凯*
(沈阳药科大学 药学院,辽宁 沈阳 110016)
综述透明质酸在抗肿瘤药物递送系统中的应用。以“透明质酸”“药物递送系统”“靶向治疗”等为关键词,组合查询了在PubMed、Elsevier、SpringerLink、中国知网、万方、维普等数据库中的相关文献,并进行归纳、分析、总结。透明质酸是一种能够靶向CD44(一种在各种肿瘤细胞上过表达的受体)的高分子化合物,具有靶向抗癌药物的功能。透明质酸对多种药物靶向递送的几种方法:不同的位点可以对应连接不同的小分子、大分子药物,直接修饰不同的纳米剂型;通过自组装的方式形成纳米药物递送系统等。近年来,由于其有效的靶向选择性,在药物递送、疾病诊断及生物医学成像等方面有广泛的应用。基于HA的纳米药物递送系统在肿瘤靶向药物递送系统中有着广阔的应用前景。
药剂学;药物递送系统;综述;透明质酸;纳米剂型;肿瘤治疗
透明质酸(sodium hyaluronate,hyaluronic acid,HA)是一种线性大分子黏多糖,由葡萄糖醛酸和乙酰葡糖胺交替连接的2个糖单元组成[1](图1)。

Fig. 1 Chemical structure of hyaluronic acid
HA是滑膜液和细胞外基质的常见成分,不在高尔基体中合成,在结构上是唯一一种最简单的、与核心蛋白不共价结合的物质,也是唯一一种非硫酸化物质。HA在人体和其他脊椎动物中几乎无处不在,在软结缔组织的细胞外基质中HA的量是最多的。除脊椎动物外,HA还存在于一些细菌(例如菌株)中,但不存在于真菌、植物和昆虫中。Shiedlin等公布了可以提取HA的来源以及潜在杂质的全面概述。体内透明质酸的分子质量从5 000~2×107u,HA天然状态是高分子,但在肿瘤或炎性浸润部位为片段化的低分子形式,高分子质量HA和低分子质量HA均参与多种生物学功能[2]。HA具有的独特黏弹性和流变学特性使它在生物体中发挥重要的生理作用,并使其成为各种医学应用中有吸引力的生物材料。近年来,由于其有效的靶向选择性,在药物递送、疾病诊断及生物医学成像等方面有广泛的应用,基于此作者根椐国内外28文献就透明质酸的纳米药物递送系统在肿瘤靶向药物递送系统中的应用加以概述。
1 透明质酸的化学反应位点
在许多上皮来源的癌症中,存在CD44(一种在各种肿瘤细胞上过表达的受体)的上调,在其他一些癌症中也存在肿瘤基质中HA的过表达,HA和CD44之间的相互作用被认为是肿瘤侵袭和转移中的关键标志,所以HA在药物上的应用被广泛用于开发抗癌疗法,癌细胞上的CD44和基质中的HA都是抗癌疗法的靶标。虽然CD44在正常上皮细胞中也表达,并且HA是正常组织基质的一部分,但大分子载体会主要渗入肿瘤组织而非正常组织,所以它仍然可以选择性靶向癌症。通过干扰HA与细胞表面受体的相互作用,如用透明质酸酶降解HA或使用可溶性CD44蛋白干扰CD44-HA相互作用可以阻断肿瘤的发展。目前,HA已经可以用来物理包封或化学缀合各种药物,通过连接其他基团改进的HA也已被用作脂质体或纳米颗粒上的药物载体和配体。表1是Platt已经综述出的一些HA连接不同药物在各类肿瘤中的靶向治疗方案[3]。

Table 1 Targeted drugs and drug carriers in vitro
透明质酸共有5个常用的化学反应位点,Liu等阐述了透明质酸的反应位点和可以发生的反应(图2)[4]:(1)羧酸可以形成酰胺或酯键;(2)羟基可以形成酯键;(3)半缩醛,用于亚胺或随后的胺形成;(4)酶解可以生成一价胺的-乙酰基;(5)邻二醇可生成二醛,可用于进一步修饰。
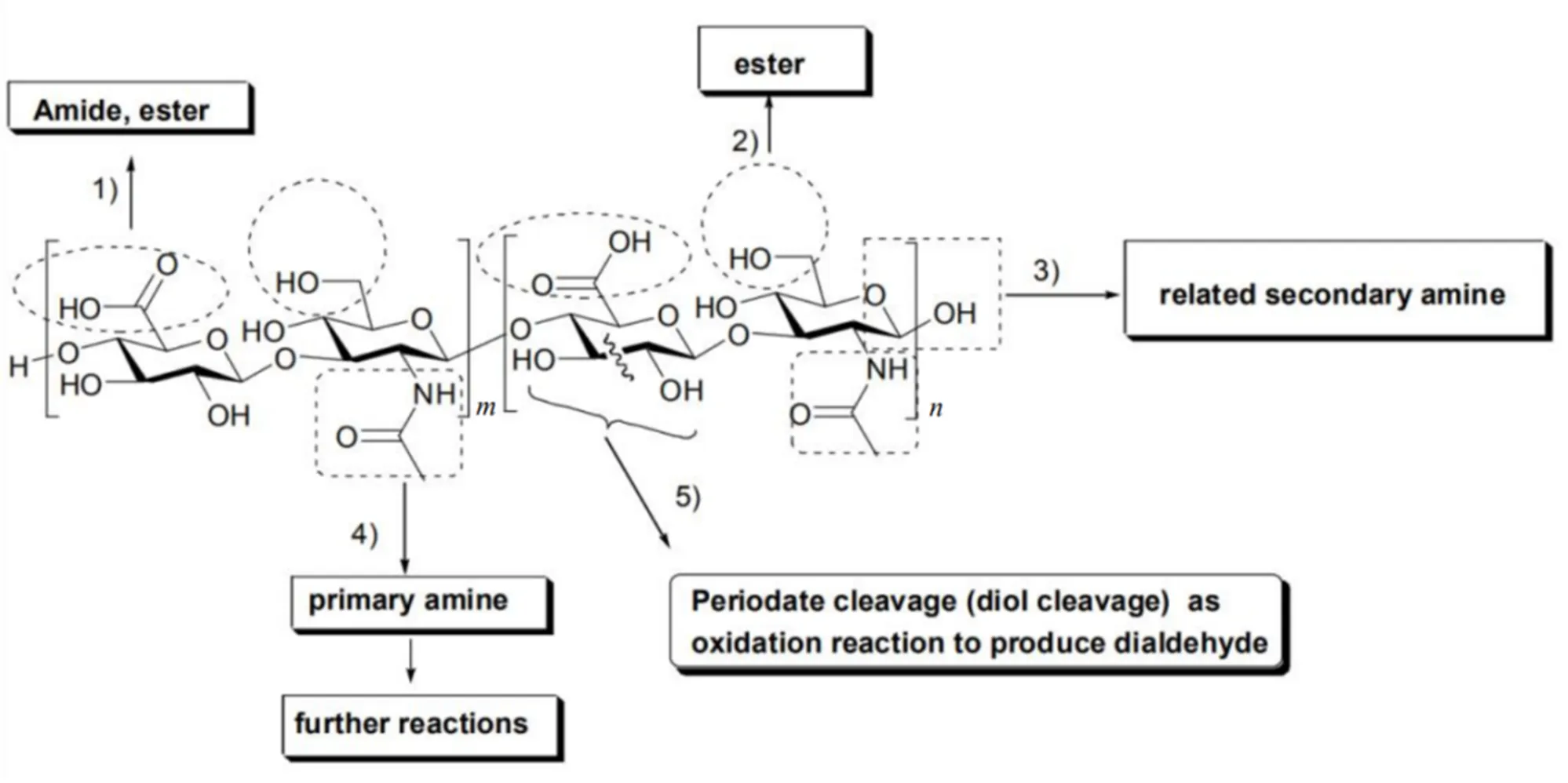
Fig. 2 Schematic diagram of the reaction sites of hyaluronic acid (HA) to construct hyaluronic acid nanocarriers
根据化学结构,有四种可能的化学改性在图2中:(1)葡糖醛酸部分上的羧酸酯官能团可以与一些带有伯胺或羟基官能团的药物、小分子或聚合物发生衍生物反应形成相关的酰胺或酯;(2)-乙酰葡糖胺羟基官能团可以与药物、小分子或聚合物上的羧酸官能团反应,形成相关的酯;(3)醛末端可以与药物、小分子或聚合物上的伯胺官能团反应,然后进行还原反应形成相关的仲胺;(4)-乙酰葡糖胺单元的乙酰基可以用酶促反应形成相关的伯胺,其可以进行进一步的相关反应。
2 HA直接与药物相连进行靶向递送
一些小分子抗癌药物可直接和透明质酸结合起来,透明质酸的高生物相容性和结合CD44的能力使药效更为优秀。Coradini等将丁酸钠与透明质酸结合,反应过程见图3[5]。结果表明,用作丁酸钠载体的透明质酸不会干扰药物的抗增殖活性,与单独的丁酸钠相比,透明质酸进一步增强了抑制作用。
Akima等通过透明质酸合成了HA-丝裂霉素C复合物和HA-表柔比星复合物[6],增强了抗肿瘤药物向区域淋巴结和癌组织的选择性递送。他们以14C标记的HA和荧光HA(FR-HA)来研究HA在区域淋巴结中的特定分布,并评估Lewis肺癌细胞上的HA受体。在大鼠中进行了14C-HA和HA-表柔比星复合物的代谢研究,通过体外荧光研究HA通过受体进入癌细胞(Lewis肺癌)的内化机制。论证出HA-丝裂霉素C对以极低剂量(10 μg∙kg-1)植入小鼠的Lewis肺癌表现出有效的抗转移作用,而游离丝裂霉素C没有作用。
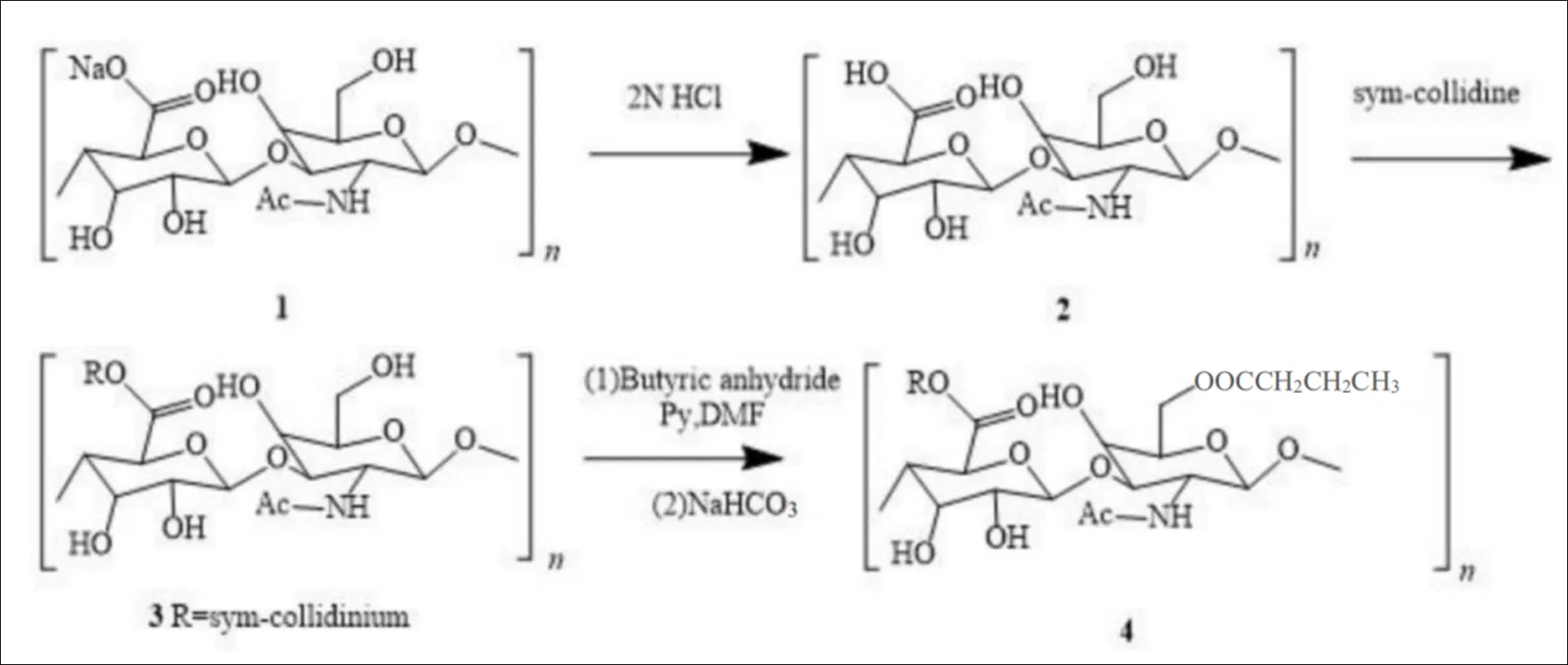
Fig. 3 Connection process between HA and butyric acid
3 HA用于修饰纳米粒子
Xu等将HA(带负电荷)和壳聚糖(CSH、带正电荷)相连接形成多糖纳米粒子(PSNPs),PSNPs与具有抗癌、抗肿瘤细胞多药耐药作用姜黄素(Cur)和在脑内具有很多乳铁蛋白受体的乳铁蛋白(Lf)相结合形成的Lf-Cur-PSNPs具有血脑屏障(BBB)渗透和脑靶向特性,被开发为治疗恶性神经胶质瘤的药物递送系统[7],并研究了制剂的物理化学特性、细胞毒性、摄取和BBB渗透。结果表明,Lf-Cur-PSNPs(Lf质量浓度为0.5 g∙L-1)相比于Cur-PSNPs可优先被脑毛细血管内皮细胞摄取,穿过BBB后,Lf-Cur-PSNPs基本保持完整,并且更有效地靶向胶质瘤细胞。小鼠的体内成像研究显示,Lf-Cur-PSNPs可以有效地渗透BBB并优先在脑中积累,其药效比PSNP大2.39倍。此外,在脑中检测到PSNP长达72 h。该研究表明,Lf-Cur-PSNPs在通过BBB后可有效靶向和积聚在胶质瘤内,因此可进一步探索其在恶性神经胶质肿瘤治疗中的潜力。
Thomas等制备的透明质酸(HA)涂层超顺磁性氧化铁纳米颗粒(SPION)用于磁共振(MR)成像和高温治疗,具有MR诊断功能。HA包被的SPION(HA-SPION)可靶向CD44过表达的癌细胞,并与PEG缀合来实现血液中的较长循环(HA-PEG10 SPION),合成过程见图4[8]。HA-PEG10-SPIONs的流体动力学尺寸测量值为176 nm,HA-SPIONs为149 nm。用TEM(显示形状)、DLS(测量尺寸)、ELS(测定表面电荷)、TGA(测定聚合物含量)和MRI(测定T2弛豫时间)等方法进行表征并计算HA-SPION和HA-PEG10-SPION的加热能力,用SCC7和NIH3T3细胞系进行细胞水平测试以确认细胞活力和细胞特异性摄取。将HA-SPION和HA-PEG10-SPION注射到携带SCC7细胞系的异种移植小鼠中,发现注射肿瘤的小鼠显示出近20%的MR T2对比度,相比之下HA-PEG10-SPION组的20%MR T2对比度是HA-SPION组的3倍。在SCC7细胞系中进行体外热疗研究显示,HA-SPION和HA-PEG10-SPION的细胞存活率低于40%,证明HA-SPION可特异性靶向CD44,并且HA-SPION和HA-PEG10-SPION的热疗功能对于未来的研究具有重要意义。
Oleic acid coated SPION is modified with dopamine (DOPA) by ligand-exchange reaction and further modifies with HA or mPEG-ss to finally have HA-SPION and HA-PEG10-SPION
Fig. 4 Synthesis of HA-SPION and HA-PEG10-SPION
图4 HA-SPION和HA-PEG10-SPION的合成
Wang等的新发现表明,HA包被的壳聚糖纳米粒子(NPs)可以有效转运到CD44过表达的肿瘤细胞中并增强药物积累,并且利用活性氧(ROS)的产生来诱导癌细胞的线粒体损伤[9]。与游离药物和未包衣的NPs相比,HA包被的壳聚糖NPs在CD44过表达的A549细胞中表现出更强的抑制率并明显诱导细胞凋亡。
除了靶向功能之外,HA修饰的药物递送系统也可以通过HA受体药物内吞作用途径更有效地进入细胞。Yu 等基于透明质酸(HA)修饰的介孔二氧化硅纳米粒子(MSN)开发了靶向药物递送系统[10]。他们使用-3-二甲基氨基丙基)--乙基碳二亚胺盐酸盐作为偶联剂,用-羟基琥珀酰亚胺(NHS)活化HA的羧基,活化的羧基与NH2-MSNs 的胺末端结合, 合成了HA-MSNs,并装载了抗癌药物盐酸多柔比星(Dox)。NH2-MSNs中没有和HA反应游离的NH2部分用于作荧光素FITC标记。HA-MSNs对特异性癌细胞系HCT-116(人结肠癌细胞)表面上过表达的CD44具有特异性亲和力。通过共聚焦显微镜和荧光激活细胞分选仪(FACS)分析评估了具有和不具有HA修饰的荧光标记MSN的细胞摄取性能。相比裸露的MSN,HA-MSNs经由HA受体介导的胞吞作用表现出更高的细胞摄取。由于HA-MSNs的细胞内化行为增强,负载Dox的HA-MSNs对HCT-116细胞显示出比游离Dox和Dox-MSNs更大的细胞毒性。提示HA-MSNs在向CD44过表达肿瘤靶向递送抗癌药物方面具有巨大潜力。
4 基于 HA的自组装纳米药物递送系统
4.1 HA和药物相连自助装成纳米递送系统
HA上具有很多位点,可以被许多大分子修饰。所得到的HA偶联物通常具有两亲性,因此可以自组装形成纳米药物传递系统,并在癌症治疗中发挥作用。由于它们的生物相容性和受体结合特性,HA-NP已经被广泛研究用于生物医学和药物应用。最近,Jun等在研究中发现一种本身不含任何药物的自组装HA纳米颗粒对脂肪组织炎症和胰岛素抵抗有治疗作用[11]。
Cho等制备了基于透明质酸-神经酰胺(HA-CE)的自组装纳米颗粒,用于静脉内多西紫杉醇(DCT)递送。他们首先将透明质酸(HA)和四正丁基氢氧化铵(TBA)反应合成活化的HA-TBA,再将用作接头的氯甲基苯甲酰氯通过酯化与神经酰胺缀合,最后通过醚键形成透明质酸-神经酰胺(HA-CE),具体过程见图5[12]。然后将HA-CE、Pluronic85和DCT自组装成纳米颗粒。Pluronic85能够克服MDR并稳定胶束结构的作用,P85的MDR克服作用可以通过细胞内ATP消耗和药物外排蛋白ATP酶活性的抑制来解释。
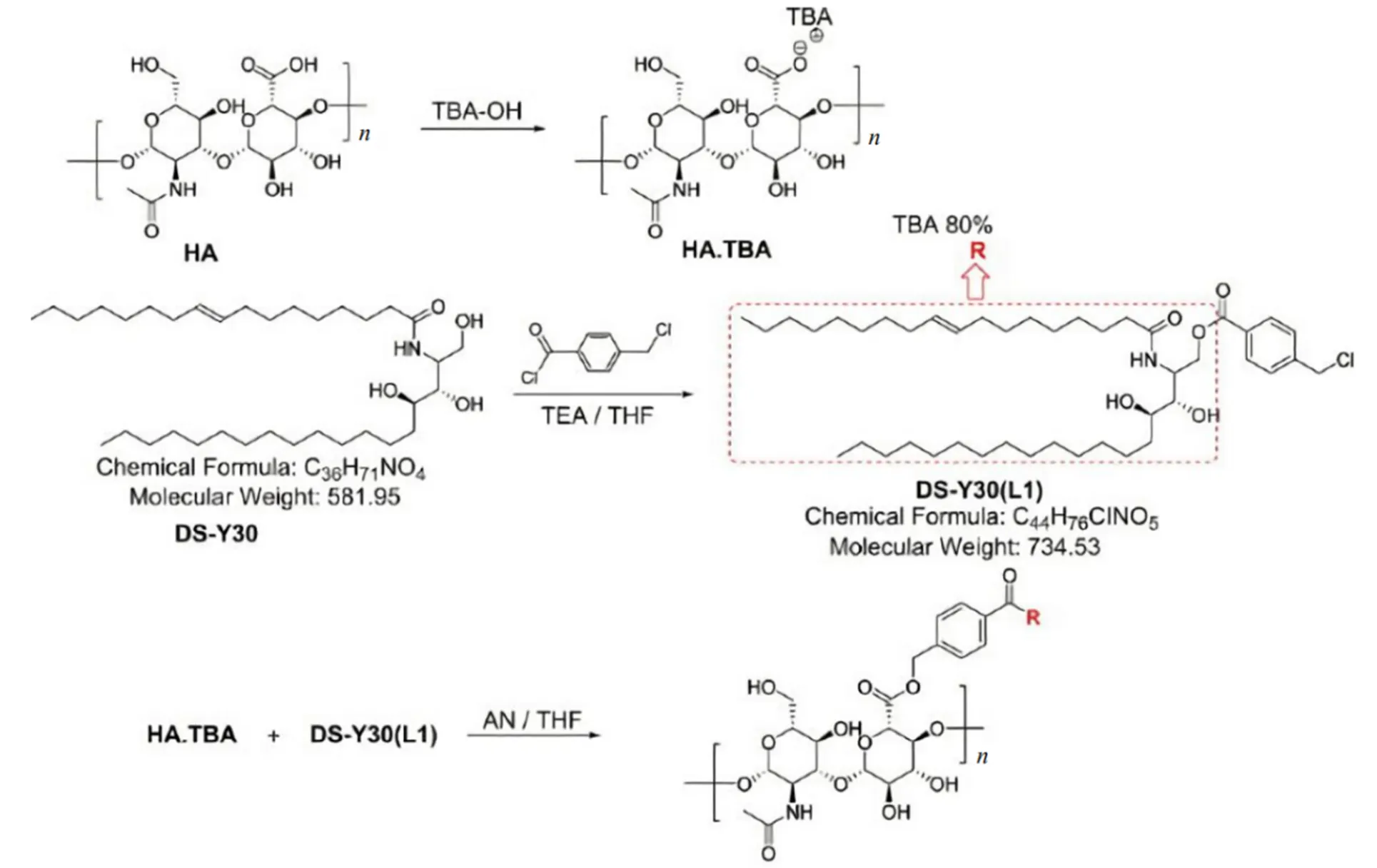
Fig. 5 Synthesis of hyaluronic acid-ceramide (HA-CE)
Lin等人通过亲水性HA与疏水性近红外荧光染料IR-780缀合,利用4-氨基苯硫酚(ATP)作为连接,形成HA-IR-780 缀合物。在水性条件下,HA-IR-780纳米颗粒疏水核和亲水壳自组装形成纳米粒子(NPs)[13],并研究了HA-IR-780 NPs的特性,使用共聚焦激光扫描和试剂盒CCK-8测定细胞摄取和体外光热毒性。将HA-IR-780 NP与MB-49膀胱癌细胞一起孵育,在C57BL/6小鼠中成功建立了原位膀胱癌模型,给小鼠静脉内注射HA-IR-780 NP,这些纳米粒子可通过增强的渗透性和保留效应(EPR效应)和HA受体介导的内吞作用在膀胱癌组织中有效积聚。通过NIR成像评估NPs的体内生物分布,在NIR激光照射后,肿瘤病变被完全消融并保留了膀胱,实验表明HA-IR-780纳米粒子可解决当前的临床挑战,治疗局部侵袭性病变以及保留膀胱,在临床上具有改善膀胱癌治疗策略的巨大潜力。
Upadhyay等使用“点击化学”作为一种简单而通用的合成策略,结合透明质酸和聚谷氨酸嵌段,制备了纳米囊泡(聚合物囊泡)透明质酸嵌-聚(-苄基谷氨酸)(PBLG-b-HYA)共聚物,合成过程见图6[14]。根据点击反应,通过单体的聚合制备出一个由叠氮基末端官能化的片段PBLG。具有3-叠氮基丙-1-胺的苄基--谷氨酸(BLG)作为引发剂,使用氰基硼氢化钠作为还原剂,通过透明质酸和炔丙基胺之间的亚胺还原获得另一个具有炔基端基的区段。使用CuBr作为催化剂、五甲基二亚乙基三胺(PMDETA)作为配体,Huisgen-1,3-偶极环加成(点击反应)得到目标PBLG-b-HYA嵌段共聚物[14]。体外评估基于PBLG-b-HYA的纳米囊泡具有可控的尺寸、优异的胶体稳定性和对阿霉素药物的高负载能力。
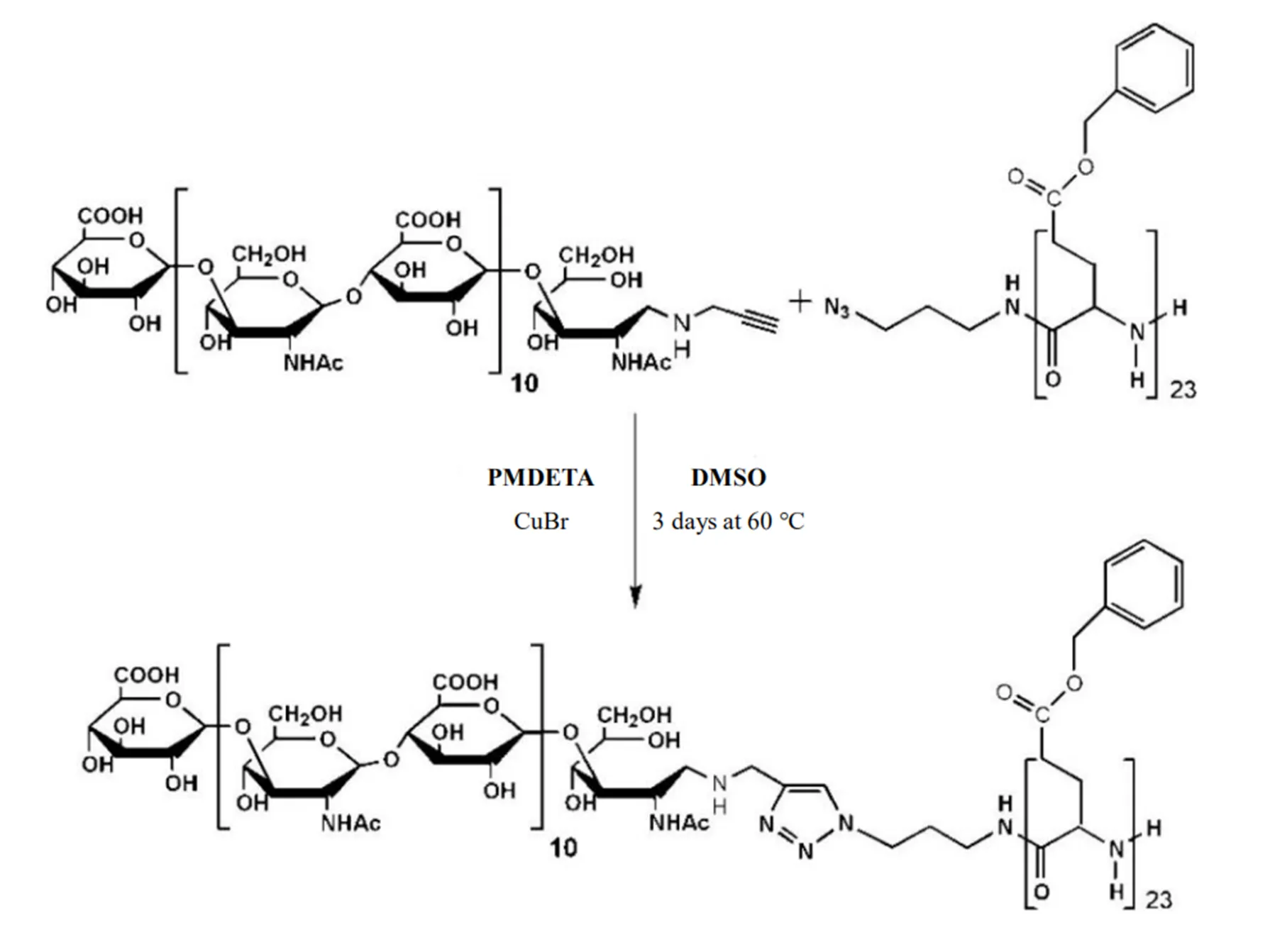
Fig. 6 Synthetic scheme for the formation of PBLG-b-HYA by Huisgen 1,3-dipolar cycloaddition or "click" chemical coupling
4.2 PEG化的HA自组装纳米递送系统
聚乙二醇(PEG)链通过酰胺键引入一些HA偶联物中,有效减少肝脏摄取,增加血液循环时间,从而使NPs选择性地聚集到肿瘤部位。
Ki等将疏水性5-胆甾酸通过碳二亚胺耦联HA骨架上,合成两亲性透明质酸缀合物。 HA缀合物再自组装得到纳米颗粒。将所得纳米颗粒用染料Cy5.5标记进行体外研究,证明CD44过表达的SCC7癌细胞能有效地吸收纳米颗粒(NPs)[15]。在体内研究中,大多数Cy5.5标记的HA- NPs存在于肿瘤和肝脏部位。进一步研究表明,HA-NPs通过EPR效应被动积累,通过HA与CD44的强受体结合亲和力主动靶向,特异性高,可选择性靶向肿瘤组织。
两年后,Ki等证明PEG化的HA-NPs在生理条件下形成表面带负电荷的自组装纳米颗粒(直径217~269nm)能够更有效地积聚到肿瘤组织中,比裸HA-NPs高1.6倍[16]。虽然HA-NP的聚乙二醇化降低了它们在体外的细胞摄取[17],但是过量表达CD44的癌细胞会比正常成纤维细胞摄取更多量的纳米粒子。同年,Ki合成了聚乙二醇(PEG)化的透明质酸纳米颗粒(P-HA-NP)装载阿霉素和喜树碱(CPT)[18]。P-HA-NPs 通过受体介导的胞吞作用在体外显示出肿瘤细胞特异性摄取,并在特定环境中释放抗癌药物。此外,运用活体成像技术证明CPT-P-HA-NPs在血液中延长了循环时间并增强了体内肿瘤靶向特征,肿瘤部位药物堆积清晰可见。与游离CPT相比, P-HA-NP 装载的CPT在体内显示出优异的抗肿瘤效力和高存活率,提示PEG化的HA-NP可以是疏水性抗癌药物的有效载体。
Pitarresi等合成了既有PEG又有PLA的改性HA。他们将疏水性部分聚乳酸(PLA)和逃避巨噬细胞吞噬的隐形部分聚乙二醇(PEG)分别通过酯键和酰胺键连接到HA上,然后选择能够在水性介质中形成胶束的共聚物来捕获抗肿瘤药物多柔比星[19]。通过荧光探针确定HA-g-PLA或HA-g-PLA-g-PEG的临界胶团浓度,而其形状和大小通过光散射、扫描和透射电子显微镜测量和评估。与受体缺陷的人皮肤成纤维细胞相比,载药胶束对过量表达HCT-116细胞的CD-44具有选择性细胞毒性。
4.3 HA通过静电作用结合纳米粒子
Lee等将疏水性极强的紫杉醇直接与HA缀合,不使用HA中的官能团和任何离子表面活性剂、盐和封闭剂,通过形成HA / PEG纳米复合物来完成HA-紫杉醇缀合物自组装,在水溶液中形成纳米尺寸的球形胶束。用动态光散射(DLS)、原子力显微镜(AFM)和透射电子显微镜(TEM)进行表征;用HCT-116和MCF-7癌细胞株进行体外实验,论证出HA-紫杉醇缀合物胶束与常规紫杉醇制剂相比对HA可识别的CD44过表达细胞表现出更大的细胞毒性。合成的过程是先用二甲氧基-PEG(dmPEG)将HA溶解在无水DMSO中,形成纳米级的复合物。然后使用DCC/DMAP作为偶联剂,紫杉醇的羟基与HA的羧基在单一有机相中直接缀合,得到具有在酸中可裂解酯键的HA-紫杉醇结合物(图7)[20]。其中,dmPEG用于在DMSO中代替二羟基-PEG溶解HA,以避免在HA-紫杉醇缀合期间羟基封端的PEG与HA发生副反应。
纳米粒子的大小在利用肿瘤EPR效应中起关键作用,其中大尺寸的纳米粒子具有良好的滞留性,但是渗透性差,而小尺寸的纳米粒子则相反。虽可以设计尺寸可缩小的纳米颗粒来克服这种困难,但是复杂的肿瘤微环境仍然限制了纳米颗粒的分布。Liu等用透明质酸(HA)和小型肾脏可清除的阳离子牛血清白蛋白来保护金纳米簇(AuNC @ CBSA),成功构建了尺寸可缩小的纳米粒子(AuNC @ CBSA @ HA)[21]。通过改变HA和AuNC @ CBSA的比例,制备了不同初始大小的AuNC @ CBSA @ HA,并评估了它们的肿瘤靶向效率和药代动力学特征,然后筛选出具有最佳EPR效应的200 nm的AuNC @ CBSA @ HA以进一步装载用于化学光热疗法的紫杉醇(PTX)、吲哚菁绿(ICG)以及用于调节肿瘤微环境和增强药物递送的一氧化氮(NO)。AuNC @ CBSA-PTX-ICG @ HA-NO3在透明质酸酶触发下可降低尺寸,并在肿瘤内分布均匀,抑制了95.3%的原位肿瘤生长和88.4%的肺转移生长。
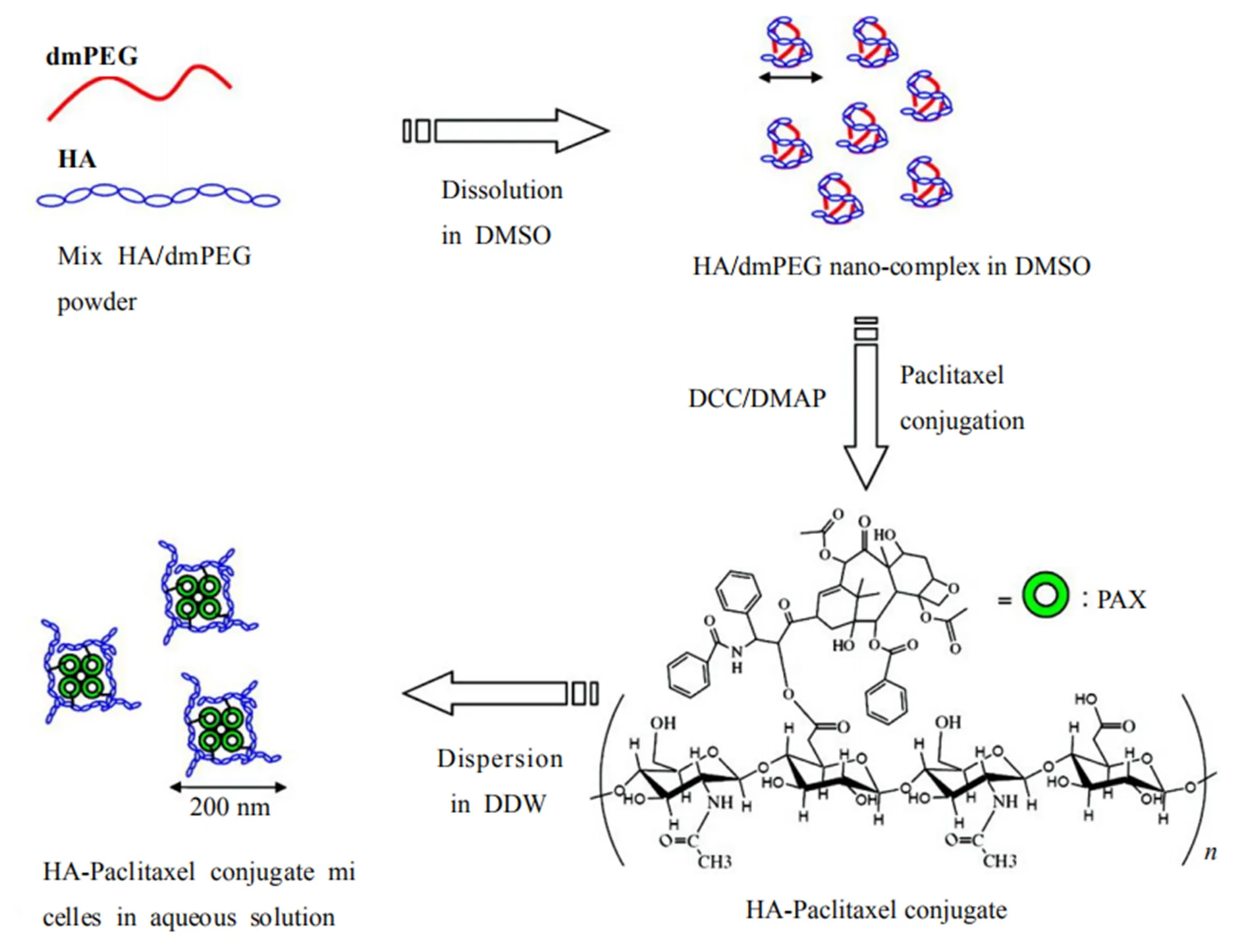
Fig. 7 Formation process of HA-paclitaxel self-assembly system
4.4 其他基于HA的纳米自组装药物递送系统
4.4.1 氧化还原敏感的两亲性给药系统
在现代癌症化疗中,靶向给药并刺激反应释放具有非常广泛的应用。氧化还原敏感的两亲性给药系统在细胞内氧化还原电位作用下引发运载药物的突释,对药物递送具有重要的意义。
Song等合成了由透明质酸-二硫化物-维生素E琥珀酸酯(HA-SS-VES,HSV)缀合物构建的氧化还原敏感纳米载体系统,并将紫杉醇(PTX)装载到递送系统中[22],同时表征了HSV纳米颗粒的物理化学性质,评估了HSV纳米颗粒的氧化还原敏感性、肿瘤靶向性和细胞内药物释放能力。此外,在CD44过表达的A549肿瘤模型中研究了负载PTX的HSV纳米颗粒的体外和体内抗肿瘤活性。
Jun等将“生物活性的”生育酚琥珀酸酯(TOS)通过二硫键连接到HA上,获得的HA-ss-TOS偶联物在体外可自组装成纳米胶束,当进入体内还原环境时可发生解离,过程见图8[23]。此外,负载紫杉醇的HA-ss-TOS 胶束可被过表达CD44的B16F10细胞有效摄取,表现出增强的细胞毒性。体内成像研究表示与游离药物组相比,HA-ss-TOS的肿瘤积累更多。体内抗肿瘤活性实验进一步确定了载有PTX的HA-ss-TOS胶束相对于载有PTX的HA-TOS胶束和游离紫杉醇具有更优异的抗肿瘤反应。这些实验结果表明,具有多功能特性和还原反应性PTX负载聚合物纳米胶束具有很强的抗肿瘤治疗潜力,可以进一步研究。

Fig. 8 Redox-sensitive micelles based on hyaluronic acid-TOS (HA-ss-TOS) conjugates
4.4.2 结合叶酸的双靶向药物自组装系统
Liu等在无水甲酰胺中用EDC、NHS将透明质酸钠的羧基活化,然后在无水DMF中连接上十八烷基胺。进一步连接上叶酸,合成了双靶向叶酸偶联HA-C18 (FA-HA-C18)。其体外抗肿瘤活性试验表明,负载紫杉醇的HA-C18和FA-HA-C18胶束对MCF-7和A549细胞具有明显的细胞毒性活性[24]。
5 基于HA的核酸(siRNA,质粒DNA)作为抗癌药物的两亲性传递系统
RNA干扰(RNAi)是RNA指导基因表达调控的天然细胞机制,如果能够开发出可以重现且安全有效的递送策略,它很可能成为新的治疗方式。为了应对这一挑战,科学家做出了许多努力,但收效甚微。这些方案大多数是基于阳离子制剂使RNA递送到细胞质中,然而,大多数这些制剂会引起不利的影响,例如线粒体损伤、干扰血液凝固、诱导干扰素应答、促进细胞因子诱导、激活补体等。
将核酸包裹在脂质体中,再用HA通过静电作用包被在脂质体外从而靶向携带核酸是一种常见的递送方式。Milo等将中性磷脂和胆固醇自组装成脂质基纳米颗粒(LNP),然后用糖胺聚糖、透明质酸(HA)包被这些LNP[25](HA-LNP)。与对照的未包衣颗粒相比,HA-LNP可以特异性地结合并内化到癌细胞中,与对照颗粒和载有对照的HA-LNP相比,装载了抗多药耐药挤出泵P-糖蛋白(P-gp)的HA-LNP可以有效且特异性地向siRNA靶向,降低mRNA和P-gp蛋白水平。当用人外周血单核细胞(PBMC)培养这些制剂时,未观察到细胞毒性或细胞因子诱导,证明HA-LNP可以成为基于阳离子脂质体制剂的替代材料,用于有效且安全地将RNAi递送至癌细胞中。Ran等合成了聚乙二醇化透明质酸(PEG-HA),并通过静电相互作用涂覆阳离子脂质体-siRNA复合物以形成PEG-HA-NP[26],并比较裸NP和HA-NP。由于增加的稳定性和延长的血液循环,PEG-HA包被的复合物可以在肿瘤组织中积累的更多。以上实验证明用HA修饰脂质体递送核酸药物在抗癌领域中是很具有潜力的。
Zhang等使用聚乙二醇化的HA进行质粒递送。他们合成了聚乙二醇化透明质酸(HgP)和聚乙二醇化聚谷氨酸(PGgP)两种聚乙二醇化阴离子聚合物,并以此聚合物分别包覆核-壳阳离子聚己内酯-接-聚甲基丙烯酸,-二甲基氨基乙酯纳米粒子/DNA复合物(称之为NP-D)。体外和体内评估了聚阴离子结构对粒径、zeta电位、细胞毒性、细胞摄取和转染效率的影响。体外研究表明,与PGgP包被的复合物相比,HgP包被的复合物在细胞摄取和转染方面显示出更好的效率[27]。在NP-D上涂覆HgP改善了生物相容性,没有降低细胞摄取和转染效率,并且注射后在肿瘤中发生了更多的积累和基因表达。红外荧光成像研究发现的体内肿瘤靶向能力表明,HA与CD44受体的相互作用以及EPR效应是肿瘤靶向的主要驱动力。HgP涂层的成功归因于透明质酸(HA)的受体介导内吞作用还有通过透明质酸酶催化的HA降解的外壳脱离。这些结果表明,HgP包被的NP-D的三元复合物具有治疗癌症的可能,并且HgP在涂覆聚阳离子/ DNA复合物上有很大使用潜力。
基于肿瘤坏死因子相关凋亡诱导配体(TRAIL)的联合治疗和基因治疗是克服单独的TRAIL治疗具有局限性的潜在新策略,但缺乏有效和低毒性载体是目前的主要问题。
Wang等开发了一种透明质酸(HA)修饰的聚乙烯亚胺-聚(,)-丙交酯-共-乙交酯纳米颗粒系统(PEI-PLGA-NP),用于在三阴性乳腺癌(TNBC)疗法中靶向共同递送TRAIL质粒(pTRAIL)和藤黄酸(GA)[28]。GA被包封在PEI-PLGA-NP的核心中,而pTRAIL通过电荷吸附被吸附到NP表面。PEI-PLGA-NP上的HA通过结合TNBC细胞的CD44受体而起到靶向配体的作用。得到的HA包被的共载pTRAIL和GA的PEI-PLGA-NP粒子呈球形(121.5nm),并且可以通过CD44依赖性内吞途径将装载的药物内化到TNBC细胞中。双重载药NPs 在体外显著增加细胞死亡并抑制TNBC肿瘤在体内生长,这种多功能NP系统有效地共同递送GA和pTRAIL,代表了一种具有潜力的治疗TNBC的策略,并提示在组合TNBC治疗中同时递送治疗性DNA和化学治疗剂的新策略。
以上实验证明,基于HA的核酸药物递送系统可能是实时诊断和治疗癌症的一个很有潜力的递送系统。
6 结语
a. 本文中综述了基于HA的纳米药物递送系统,总结了几种可以修饰HA并进行靶向抗癌药物递送的方式。由于HA可以靶向CD44受体,其过表达又与许多恶性肿瘤有关,因此,HA修饰NPs给药可以特异性靶向肿瘤,导致药物持续释放,从而减少化疗所产生的不良反应。
b. 由于其对CD44受体的靶向性以及其被组织透明质酸酶(HAase)降解的能力,基于HA的两亲性纳米药物递送系统对癌症治疗具有很大的潜力。然而,合理设计以HA为基础的NPs给药应进一步考虑健康器官的毒性,尤其是肝脏的毒性(清除HA的主要途径)。以HA为基础的NPs抗癌药物的临床应用,不应仅仅局限于体外和体内的研究。NPs的理化特性和药代动力学以及产品的生产过程对临床前试验的进行都很重要。其制备的复杂性和最终配方重现性的挑战可能限制其未来的临床应用。
c. 根据本综述中涉及HA的有关例子,可以促使科研工作者更加了解和掌握透明质酸的用途,有助于将其普遍化和工业化。
[1] HUANG Gangliang, HUANG Hualiang. Application of hyaluronic acid as carriers in drug delivery[J]. Drug Delivery, 2018, 25(1): 766-772.
[2] ALANIZ L, CABRERA P V, BLANCO G, et al. Interaction of CD44 with different forms of hyaluronic acid. Its rolein adhesion and migration of tumor cells[J]. Cell Commun Adhes, 2016, 9(2): 117-130.
[3] PLATT V M, SZOKA F C. Targeting macromolecules and nanocarriers to hyaluronan orCD44, a hyaluronan receptor molecular pharmaceutics[J]. Anticancer Therapeutics, 2008, 5(1): 474-486.
[4] LIU Kegang, JIANG Xiaohua, HUNZIKER P, et al. Carbohydrate-based amphiphilic nano delivery system for cancertherapy[J]. Nanoscale, 2016, 36(8): 16075-16156.
[5] CORADINI D, PELLIZZARO C, MIGLIERINI G, et al. Hyaluronic acid as drug delivery for sodium butyrate: Improvement of the anti-proliferative activity on a breast-cancer cell line[J]. International Journal of Cancer, 1999, 81(3): 411-416.
[6] AKIMA K, ITO H. Evaluation of antitumor activities of hyaluronate binding antitumor drugs: synthesis, characterization and antitumor activity[J]. Journal of Drug Targeting, 1996, 4(1): 1-8.
[7] XU Yurui, ASGHAR S, YANG Liu, et al. Lactoferrin-coated polysaccharide nanoparticles based on chitosan hydrochloride/hyaluronic acid/PEG for treating brain glioma[J]. Carbohydrate Polymers, 2017, 157(10): 419-428.
[8] REJU G T, MYEONG J M, LEE H, et al. Hyaluronic acid conjugated super paramagnetic iron oxide nanoparticle for cancer diagnosis and hyperthermia therapy[J]. Carbohydrate Polymers, 2015, 131(10): 439-446.
[9] WANG Tao, HOU Jiahui, SU Chang, et al. Hyaluronic acid-coated chitosan nanoparticles induce ROS-mediated tumorcell apoptosis and enhance antitumor efficiency by targeted drug delivery via CD44[J]. Journal of Nanobiotechnology, 2017, 15(7): 235-241.
[10] YU Meihua, JAMBHRUNKAR S. Hyaluronic acid modified mesoporous silica nanoparticles for targeted drug delivery to CD44-overexpressing cancer cells[J]. Nanoscale, 2013, 5(1): 178-183.
[11] JUN Girho,HWA Seunghan,JI Hyehan, et al. Self-assembled hyaluronic acid nanoparticles: Implications as a nanomedicine for treatment of type 2 diabetes[J]. Journal of Controlled Release, 2018, 279(7): 89-98.
[12] CHO H J, YOON H Y, KOO H, et al. Self-assembled nanoparticles based on hyaluronic acid-ceramide (HA-CE) and Pluronic®for tumor-targeted delivery of docetaxe[J]. Biomaterials, 2011, 32(12): 7181-7190.
[13] LIN Tingsheng, YUAN Ahu, ZHAO Xiaozhi, et al. Self-assembled tumor-targeting hyaluronic acidnanoparticles for photothermal ablation in orthotopic bladder cancer[J]. Acta Biomaterialia, 2017, 53(4): 427-438.
[14] KUMAR UPADHYAY K, LE MEINS J F, MISRA A, et al. Biomimetic doxorubicin loaded polymersomes from hyaluronan-block-poly(-benzyl glutamate) copolymers[J]. Biomacromolecules, 2009, 10(10): 2802-2808.
[15] KI Y, KYUNG H, JIN H, et al. Self-assembled hyaluronic acid nanoparticles as a potential drug carrier for cancer therapy: synthesis, characterization, andbiodistribution[J]. Journal of Materials Chemistry, 2009, 19(24): 4101-4107.
[16] KI Y, KYUNG H, HONG Y, et al. PEGylation of hyaluronic acid nanoparticles improves tumor targetability[J]. Biomaterials, 2011, 32(7): 1880-1889.
[17] RAN Rui, LIU Yayuan, GAO Huile, et al. Enhanced gene delivery efficiency of cationic liposomes coated with PEGylated hyaluronic acid for anti P-glycoprotein siRNA: A potential candidatefor overcoming multi- drugresistance[J]. International Journal of Pharmaceutics, 2014, 477(1): 590-600.
[18] KI Y, HONG Y, KIM J, et al. Smart nanocarrier based on PEGylated hyaluronic acid for cancer therapy[J]. ACS Nano, 2011, 5(11): 8591-8599.
[19] PITARRESI G, PALUMBO F S, ALBANESE A, et al. Self-assembled amphiphilic hyaluronic acid graft copolymers for targeted release of antitumoral drug[J]. Journalof Drug Targeting, 2010, 18(4): 264-276.
[20] ZHANG X, LI Y, CHEN X, et al. Synthesisand characterization of the paclitaxel/MPEG-PLA block copolymer conjugate[J]. Biomaterials, 2015, 26(3): 2121-2128.
[21] LIU Rui, XIAO Wei, ROU Chuanhu, et al. Theranostic size-reducible and no donor conjugated gold nanocluster fabricated hyaluronic acid nanoparticle with optimal size for combinational treatment of breast cancer and lung metastasis[J]. Journal of Controlled Release, 2018, 278(8): 127-139.
[22] SONG Yu, CAI Han, YIN Tingjie, et al. Paclitaxel-loaded redox-sensitive nanoparticles basedon hyaluronic acid- vitamin E succinate conjugates for improved lung cancer treatment[J]. Nanomedicine, 2018, 13(5): 1585–1600.
[23] XA Junping,DU Yunai,HUANG Liping,et al. Redox-responsive micelles from disulfide bond-bridged hyaluronic acid-tocopherol succinate for the treatment of melanoma[J]. Nanomedicine, 2018, 14(3): 713-723.
[24] LIU Yanhua,SUN Jin, CAO Wen, et al. Dual targeting folate-conjugated hyaluronic acid polymeric micelles for paclitaxel delivery[J]. International Journal of Pharmaceutics, 2011, 421(1): 160-169.
[25] DALITL M, MEIR G, SHANIL B,et al. Hyaluronan grafted lipid-based nanoparticles asRNAi carriers for cancercells[J]. Cancer Letters, 2013, 334(2): 221-227.
[26] RAN Rui, LIU Yayuan, GAO Huile, et al. Enhanced gene delivery efficiency of cationic liposomes coated with PEGylated hyaluronic acid for anti P-glycoprotein siRNA: A potential candidatefor overcoming multi- drugresistance[J]. International Journal of Pharmaceutics, 2014, 477(2): 590-600.
[27] ZHANG Wendi,CHENG Qiang,GUO Shutao, et al. Gene transfection efficacy and biocompatibility of polycation/DNA complexes coated with enzyme degradable PEGylated hyaluronic acid[J]. Biomaterials, 2013, 34(27): 6495-6503.
[28] JIAO Yan, PANG Xin, ZHAI Guangxi, et al. Advances in hyaluronic acid-based drug delivery systems[J]. Current Drug Targets, 2016, 17(6): 720-730.
Application of hyaluronic acid in targeting anti-tumor drug delivery systems
CUI Siwen, JIANG Yao, WANG Dongkai*
(,,110016,)
This article reviews the application of hyaluronic acid in anti-tumor drug delivery systems. Several methods of hyaluronic acid as a drug carrier are summarized, including different small molecules or macromolecular drugs connected at different sites, directly modifying different nanoparticles, and also promote forming self-assembled nanoparticles targeted delivering different drugs.Using "hyaluronic acid" "drug delivery system" "targeted therapy", etc. as the key words, relevant literatures were searched in the database such as PubMed, Elsevier, SpringerLink, CNKI, Wan fang, Weipu, etc. Then the literatures were summarized and analyzed.Hyaluronic acid as a high molecular polymer could target CD44 receptor which was over expressed in tumor cells, to achieve the function of targeting anticancer drugs. In recent years, due to its effective targeting selectivity, it had a wide range of applications in drug delivery, disease diagnosis and biomedical imaging.HA-based nano drug delivery systems have great potential in tumor-targeted drug delivery.
pharmaceutics; drug delivery system; review; hyaluronic acid; nanoparticles; tumor treatment
2019-02-19
崔斯雯(1994-), 女(汉族), 辽宁沈阳人, 硕士研究生, E-mail 646325173@qq.com;
王东凯(1962-), 男(汉族), 辽宁沈阳人, 教授, 博士, 博士生导师, 主要从事药物制剂新剂型及缓控释制剂研究, Tel. 024-43520529, E-mail wangdksy@126.com。
R94
A
(2019)05–0195–14
10.14146/j.cnki.cjp.2019.05.006
(本篇责任编辑:赵桂芝)

