缬沙坦片的溶出方法学研究
董伟昌,孙 进
缬沙坦片的溶出方法学研究
董伟昌,孙 进*
(沈阳药科大学 无涯学院,辽宁 沈阳 110016)
建立缬沙坦片溶出度的测定方法。以磷酸盐缓冲液(pH值6.8)1 000 mL为溶出介质,转速为50 r∙min-1,经30 min时取样,采用紫外-可见分光光度法在250 nm处测定吸光度,按外标法计算缬沙坦片的溶出度。通过耐用性、滤膜吸附实验、线性与范围、溶液稳定性、精密度试验、重复性试验、回收率试验等试验研究,对缬沙坦片的溶出方法进行验证。该溶出方法学验证结果良好。缬沙坦溶液质量浓度在1.61~17.71 mg∙L-1内线性关系良好,回归方程为=3.17×10-2-0.6×10-3,=0.999 9;方法的回收率、精密度、重复性符合要求,供试溶液在12 h内稳定。本方法能准确测定缬沙坦片的溶出度,控制缬沙坦片的质量。
药剂学;溶出度;浆法;紫外-可见分光光度法;缬沙坦片;验证
缬沙坦是由瑞士诺华公司开发的降压药,口服药品包括40、80、160、320 mg 四种规格,缬沙坦是一种高选择性Ⅰ型血管紧张素Ⅱ受体(AT1受体)拮抗剂,具有良好的抗高血压作用,其通过对肾素-血管紧张素-醛固酮系统(RAS)特异性阻断达到控制血压的效果,其降血压疗效和耐受性已在多个临床试验中得到证明[1-2]。
口服固体制剂的溶出行为的考察是评价药品质量的重要标准[3-4]。在仿制药研发中,溶出度试验为处方及工艺的开发提供方向,也是预测仿制药生物等效性的有效手段,还是评价药品质量稳定性的重要手段之一[5]。由于缬沙坦在水中溶解度小,溶出是限制其体内吸收的主要过程,所以建立溶出度的测定方法,使其准确反映产品质量,有利于控制和提高缬沙坦仿制药质量,提升其体内生物等效性试验的成功率。作者主要对160 mg规格产品进行溶出度的方法学研究,评价产品的质量。
1 仪器与材料
UV2300紫外-可见分光光度计(上海天美科学仪器有限公司),RC8MD溶出仪(天大天发科技有限公司),XSE205电子天平、FE-20 pH计(梅特勒-托利多仪器有限公司)。
缬沙坦片(规格160 mg,华北制药股份有限公司,批号XS1405001、XS1405002、ZS1405003),缬沙坦对照品,(中国药品生物制品检定所,批号100651-201203),缬沙坦参比制剂(规格160 mg,瑞士诺华制药有限公司,批号B8292YX)。磷酸二氢钾、磷酸氢二钾、氢氧化钠(分析纯,北京化工厂),水为纯化水(华北制药股份有限公司)。
2 方法与结果
2.1 溶出度方法的确定
缬沙坦片收载于《中华人民共和国药典》2015年版二部及《美国药典》USP39版[6-9]中,两者规定的溶出度检测方法均为以磷酸盐缓冲液(pH值6.8)1 000 mL为溶出介质,转速为50 r∙min-1,经30 min时取样,照紫外分光光度法在250 nm处测定吸光度,按外标法计算溶出度[8-9]。可见,该方法为大家所公认,所以缬沙坦片的溶出度研究仍采用该方法。
2.1.1 溶出介质的制备
pH值6.8磷酸盐缓冲液:取磷酸二氢钾3.60 g和磷酸氢二钾三水合物5.37 g,加水适量振摇使溶解,加水稀释至1 000 mL,摇匀,即得。
2.1.2 对照溶液的制备
取缬沙坦对照品适量,精密称定,加溶出介质溶解并制成每1 mL中约含16 μg的溶液。
2.1.3 供试溶液的制备
取溶出介质1 000 mL,置于溶出杯中,共6杯。设定温度为37 ℃,开启仪器。取供试品6片,分别投入6个溶出杯中,转速为50 r∙min-1,启动仪器,计时,经30 min取样,取样体积为5 mL,立即过滤,精密量取澄清滤液适量,用溶出介质稀释制成每1 mL约含缬沙坦16 μg的溶液,即得。
2.1.4 测定方法
照紫外-可见分光光度法,在250 nm处测定供试与对照溶液的吸光度,按照外标法以吸光度计算溶出度。
2.1.5 结果判定
计算每片的溶出量,限度为标示量的80%。
2.2 溶出度的检测方法研究
2.2.1 线性关系考察
取缬沙坦对照品约8 mg,置于250 mL量瓶中,用pH值6.8磷酸盐缓冲液溶解并稀释至刻度,摇匀,作为对照储备液;精密量取对照品储备液1、2、4、6、8、10和11 mL,分别置于20 mL量瓶中,加pH值6.8磷酸盐缓冲液稀释至刻度,摇匀,作为线性溶液。缬沙坦溶液质量浓度在1.61~17.71 mg∙L-1内线性关系良好,回归方程为=3.17×10-2-0.6×10-3,=0.999 9,轴截距为100%响应值的0.012%,不大于2.0%,响应因子的RSD值为1.8%,不大于2.0%,结果见表1。
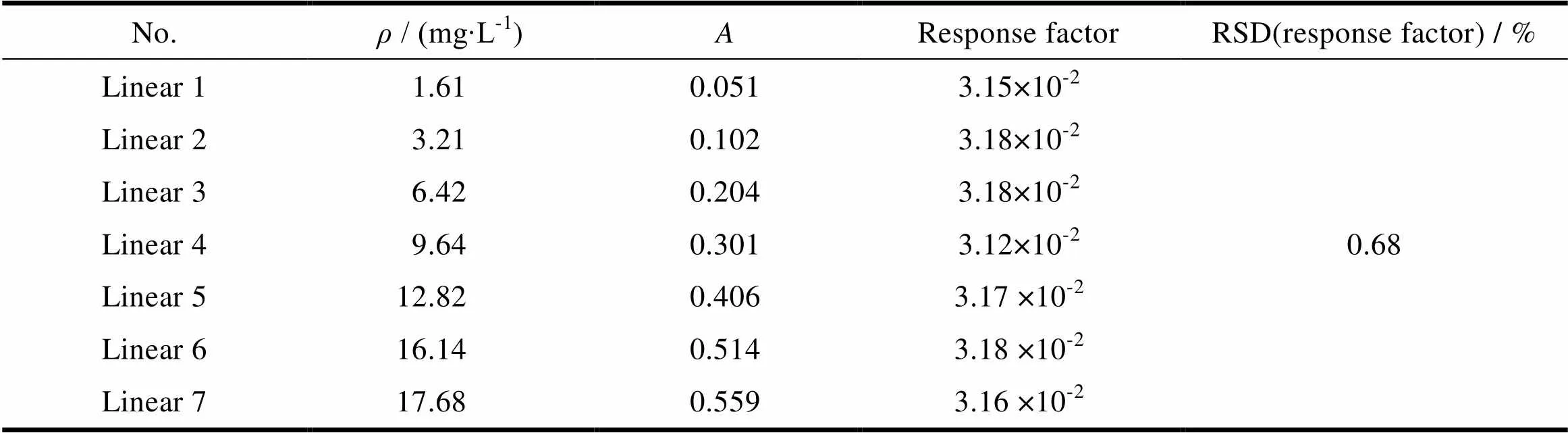
Table 1 The results of linearity and range
2.2.2 精密度试验
按“2.1.2”条配制1份缬沙坦对照溶液,连续测定6次,吸光度的相对标准偏差为0.11%,说明精密度良好,结果见表2。
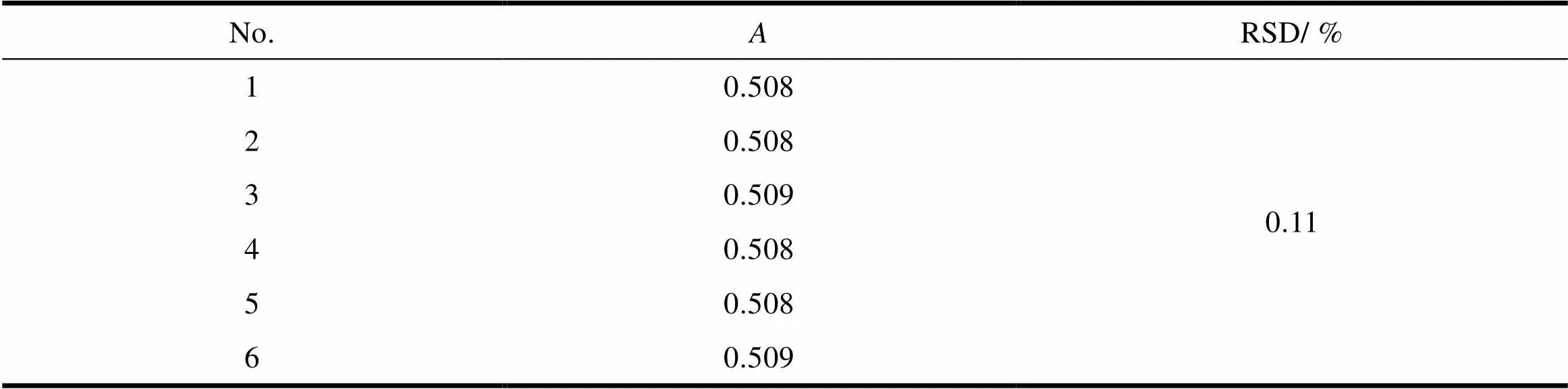
Table 2 The results of precision
2.2.3 滤膜吸附试验
取溶出液适量,分别采用过滤和离心的方式进行处理后测定吸光度,计算溶出度。取溶出液适量,采用转速为4 000 r∙min离心5 min,取上清液用溶出介质稀释成每1 mL约含缬沙坦16 μg的溶液,作为高速离心法制备溶液。另取溶出液适量,经0.45 μm滤膜滤过,取续滤液适量,用溶出介质稀释成每1 mL约含缬沙坦16 μg的溶液作为滤膜过滤液,照紫外-可见分光光度法,在250 nm处测定供试溶液与对照溶液的吸光度。过滤法和高速离心法结果基本一致,说明滤膜对本品无吸附,结果见表3。
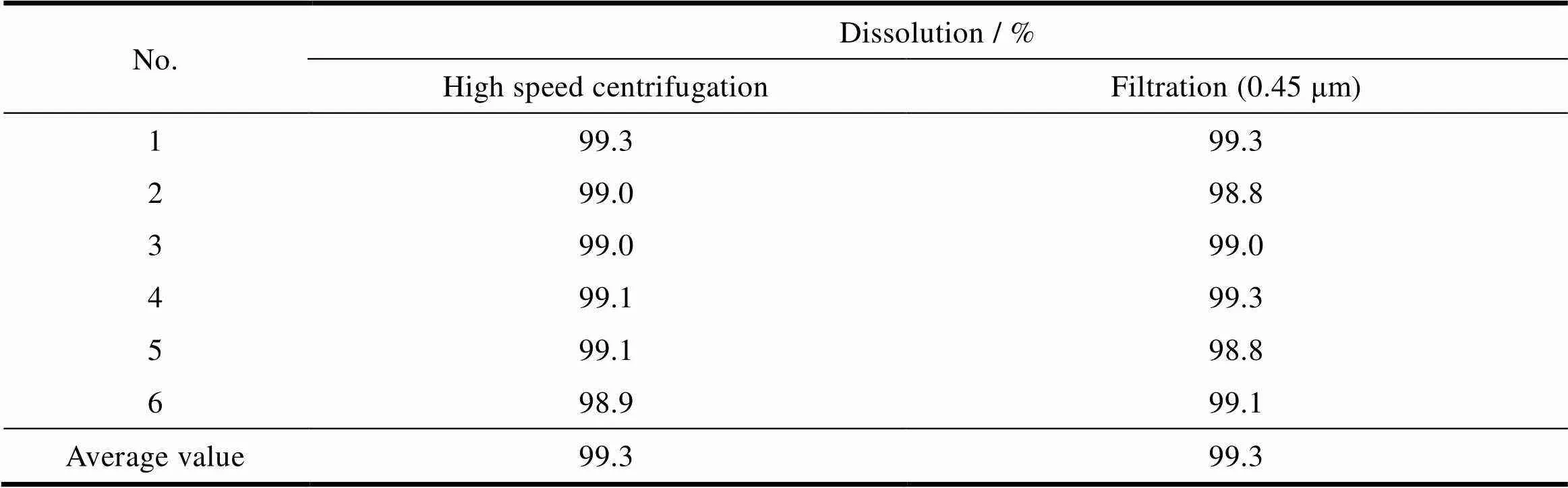
Table 3 Test results of membrane adsorption
2.2.4 回收率试验
配制限度浓度(16 mg∙L-1)的50%、80%和110%的供试溶液各3份,分别测定其含量,将实测值与理论值比较,计算回收率。称取混合空白辅料16 mg,共9份,分别置于1 000 mL量瓶中,分成3组,每组3份,称取缬沙坦对照品约8.0、12.8和17.6 mg各3份,精密称定,分别置上述1 000 mL量瓶中,加pH值6.8磷酸盐缓冲液溶解,过滤。照紫外-可见分光光度法,在250 nm处测定吸光度。本品平均回收率为99.6%,结果在98.0%~102.0%之间,9个回收率数据的相对标准差(RSD)为0.6,小于2.0%,说明本法回收率良好,准确度高,结果见表4。
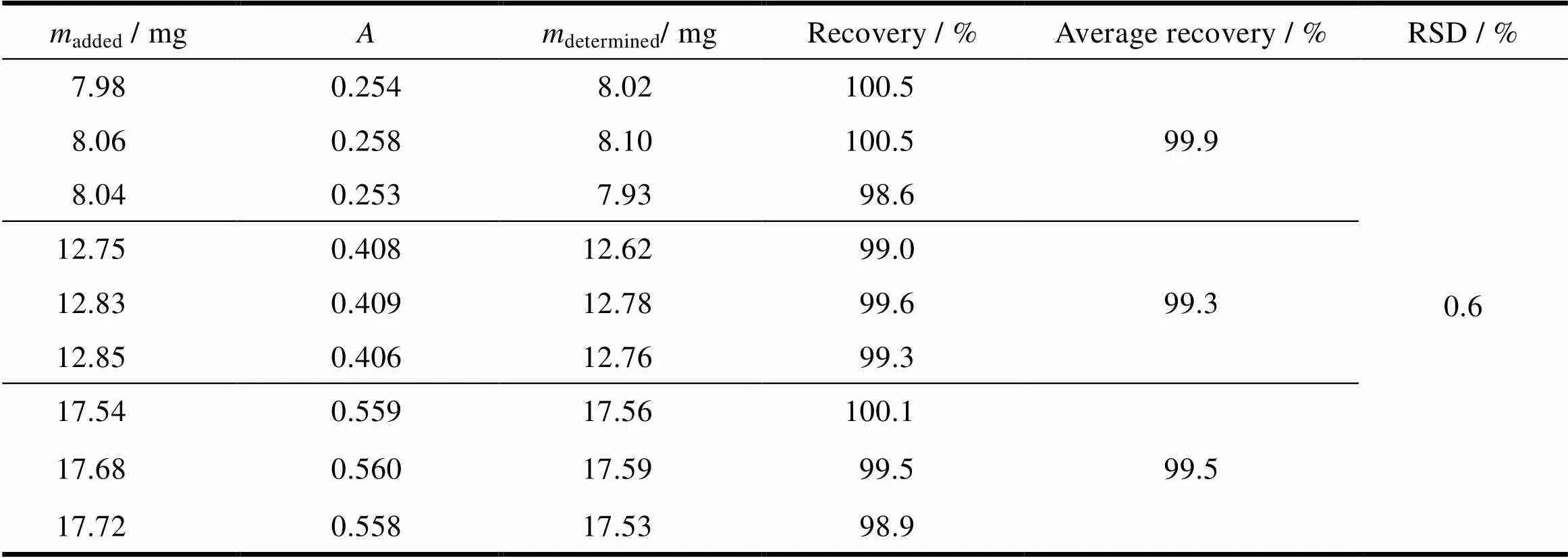
Table 4 The recovery of dissolution test
2.2.5 稳定性试验
取供试品适量,以pH值6.8磷酸盐缓冲液1 000 mL为溶出介质,转速为50 r∙min-1,依法操作,经30 min时,取溶液适量,滤过,滤液于室温条件下放置,于0、1、2、4、6、10和12 h精密量取滤液适量,用溶出介质稀释制成每1 mL含16 μg的溶液后取样测定。照紫外-可见分光光度法,在250 nm处测定吸光度。结果供试溶液室温放置的吸光度的RSD值为0.22%,不大于2.0%。说明此溶液在室温条件下12 h内稳定,结果见表5。
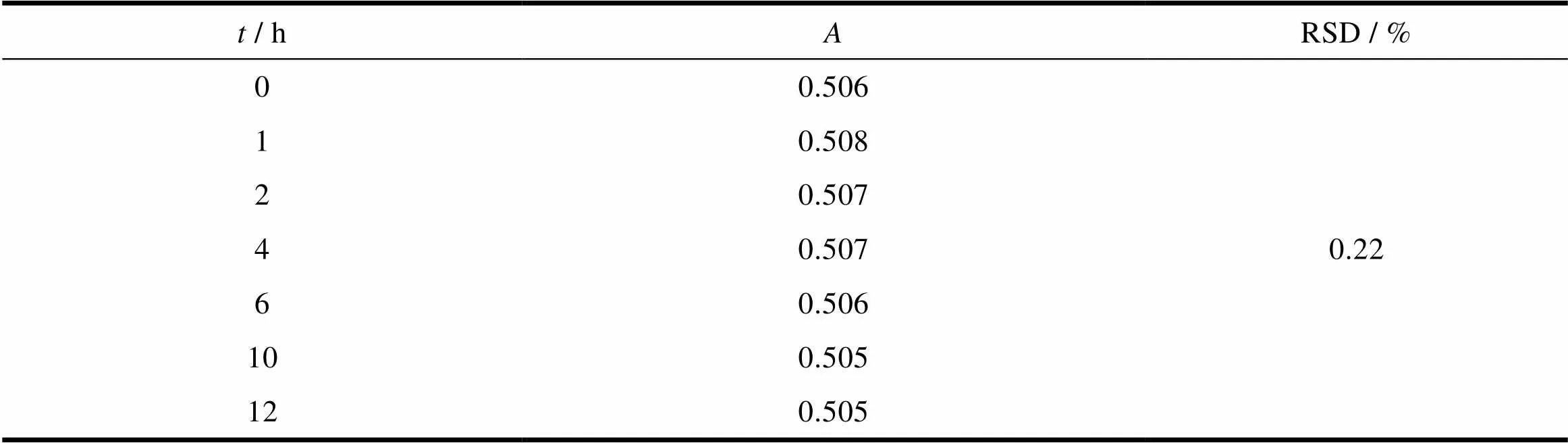
Table 5 The results of solution stability test
2.2.6 重复性试验
取样品6片,按照“2.1”条中的溶出度方法测定,每杯样品分别取样6次,分别过滤测定,各片样品溶出度6次测定结果的相对标准偏差均不大于2.0%,说明方法重复性良好,结果见表6。
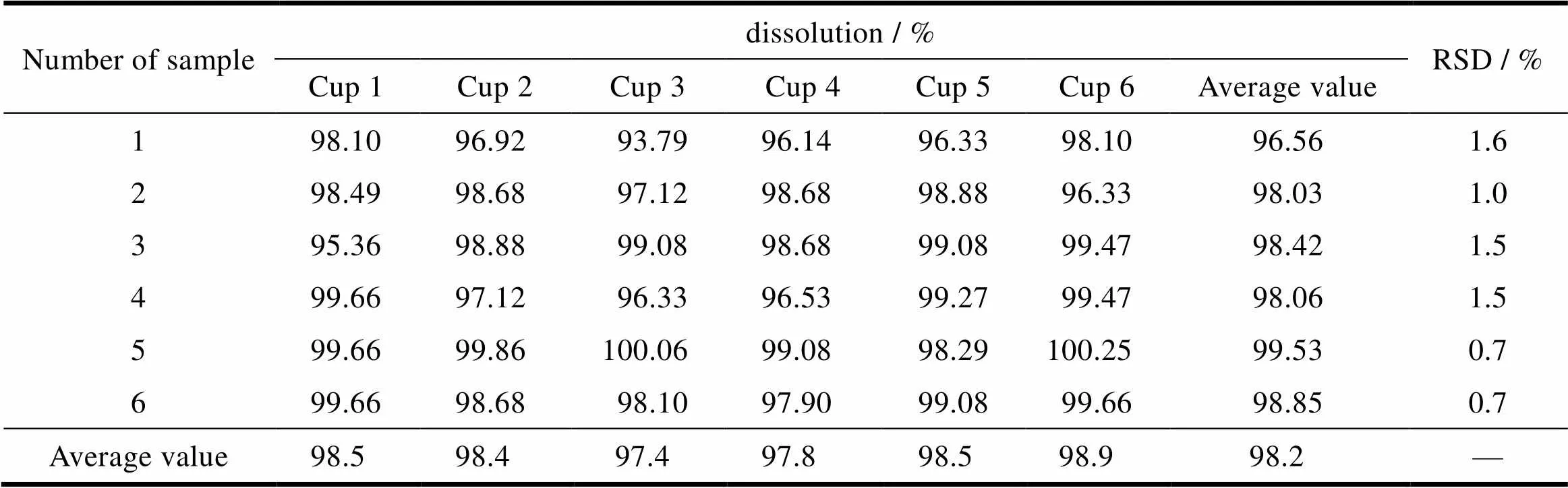
Table 6 The results of repeatability
2.2.7 中间精密度试验
由不同分析人员,不同时间使用不同的仪器对同一批样品进行测试,样品溶出度平均结果的偏差不大于5.0%,说明方法中间精密度良好,结果见表7。
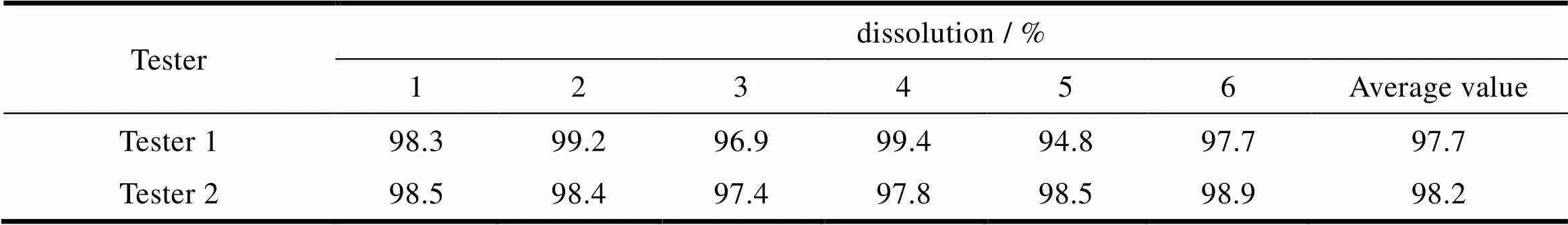
Table 7 Theresults of intermediate precision
2.2.8 耐用性试验
2.2.8.1 溶出条件的耐受性试验
考察溶出介质体积的变化约±5%,溶出温度变化±0.5 ℃、转速相对值变化±5 r∙min-1,进行测定时溶出度的变化情况。耐用性各条件项下的溶出数据的RSD值为0.42%,小于2.0%,耐用性良好,结果见表8。
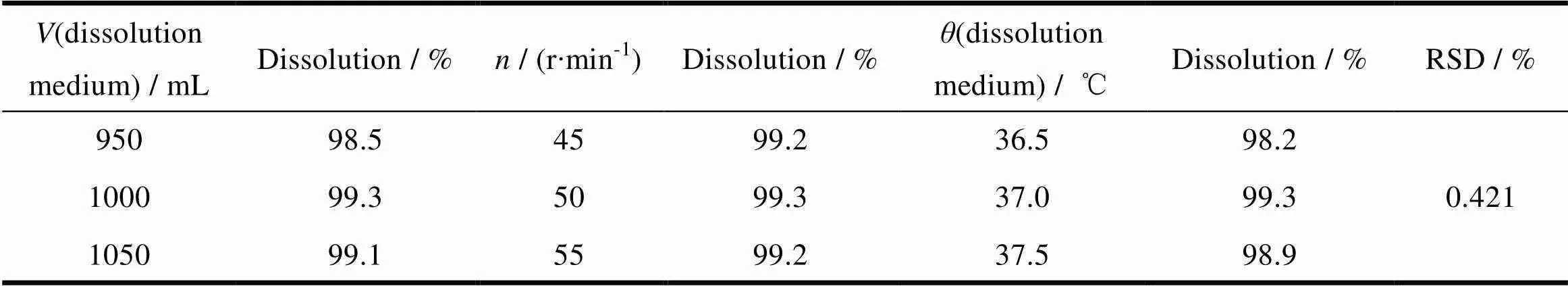
Table 8 Durability test results of dissolution condition
2.2.8.2 检测波长的耐用性试验
改变本品的检测波长(250 ± 2)nm,照紫外-可见分光光度法进行测定,耐用性各条件项下的溶出数据的RSD值为0.185%,小于2.0%,耐用性良好,结果见表9。
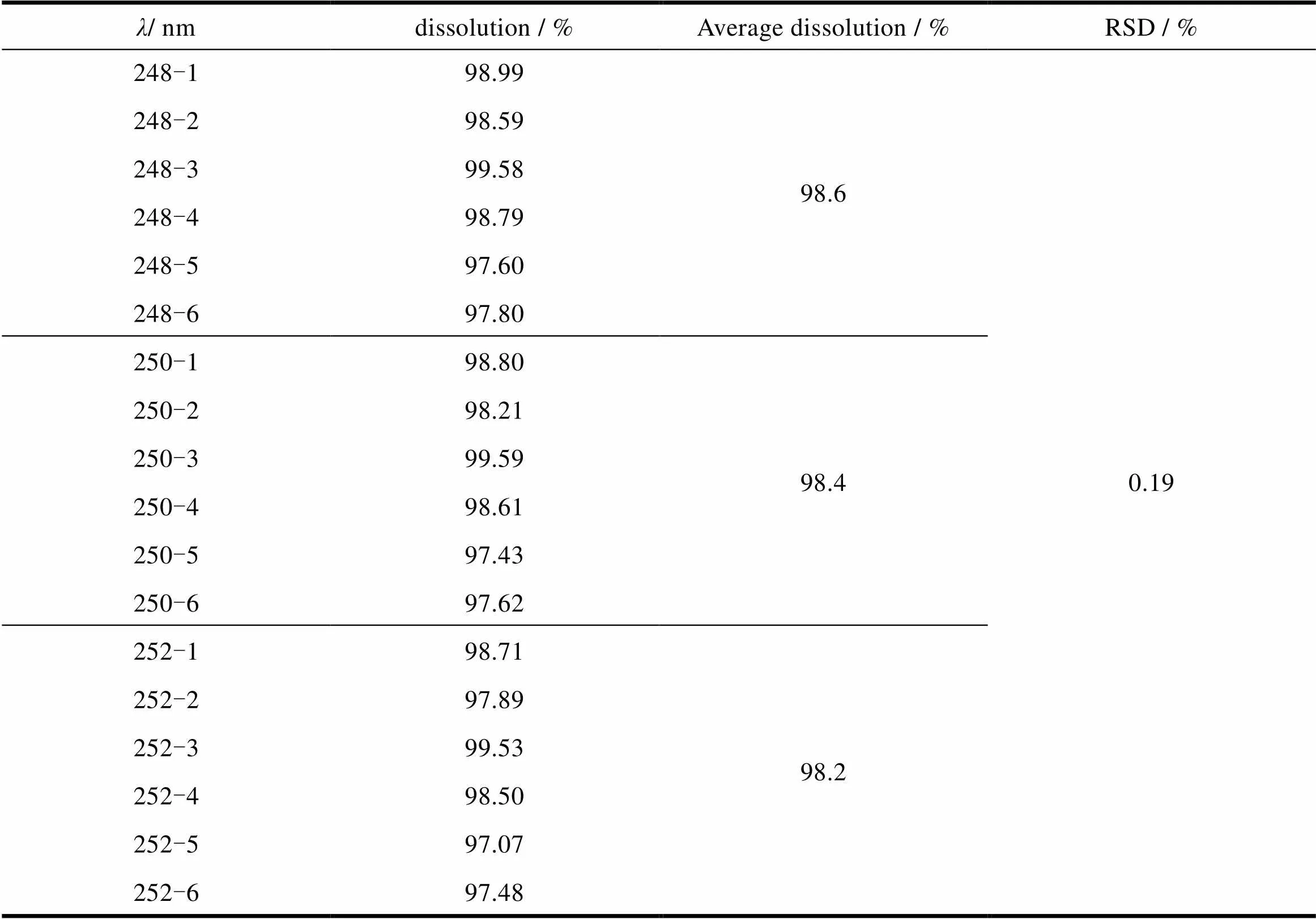
Table 9 Durability test results of detection wavelength
2.2.9 溶出均一性试验
取自制样品(批号XS1405001)6片,根据“2.1”条中的溶出度方法,分别在5、10、15、20、30和45 min取样,测定各样品的溶出曲线,确定其溶出均一性。样品在各个时间点的溶出RSD分别为1.8%、1.1%、1.0%、0.94%、0.93%和0.81%,测定结果见表10。结果表明,在pH值6.8介质中的本品溶出批内均一性良好。
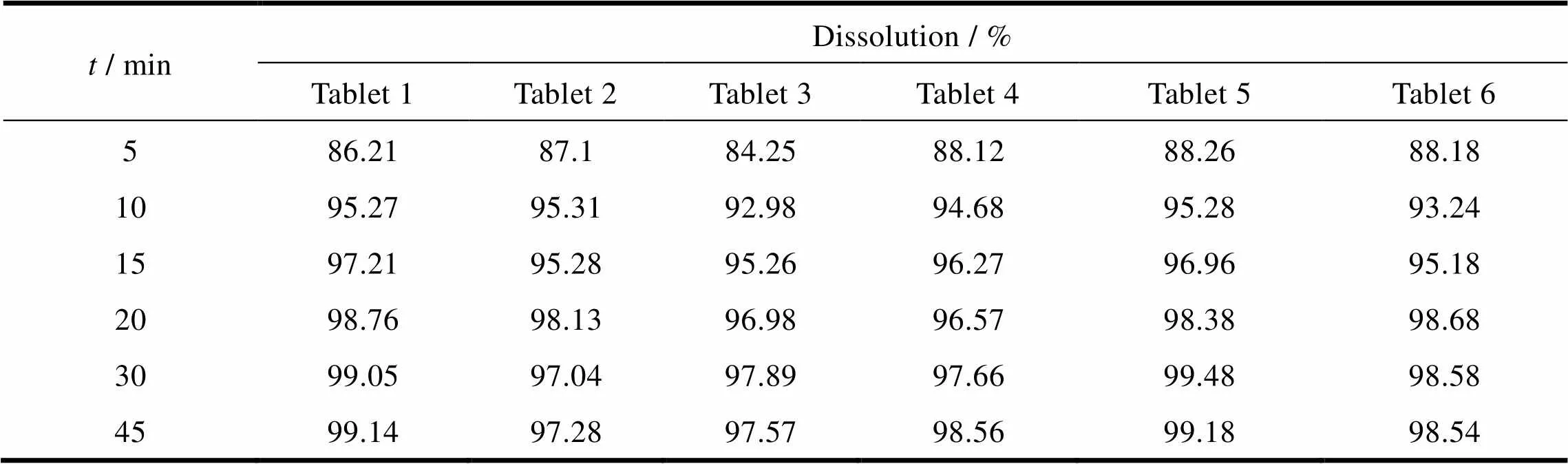
Table 10 The uniformity of dissolution test of self-product
2.2.10 溶出重现性试验
取中试样品XS1405001、ZS1405002、ZS1405003三批次供试品及上市品B8292YX,每批取6片,于5、10、15、20、30和45 min时吸取溶出液适量,测定溶出量,结果表明产品溶出重现性良好,与上市品相似。

Table 11 The reproducibility of dissolution test of self-product and listed product
3 结论
在《中华人民共和国药典》2015年版二部及《美国药典》USP39中,缬沙坦片均采用紫外可见分光光度法测定溶出度。作者根据两药典规定的溶出条件,采用紫外分光光度法建立了缬沙坦片溶出度的体外分析方法,并系统的进行了方法学研究,验证结果表明,该方法专属性、线性、重复性、准确度、耐用性均符合要求,为体外溶出度的检测提供科学合理的试验方法。
[1] 林旭升, 蒋海松, 周建平. 沙坦人鼠在体肠吸收动力学[J]. 中国药科大学学报, 2012, 43(2): 130-136.
[2] FOGARI R, ZOPPI A. A drug safety evaluation of valsartan[J]. Expert Opin Saf, 2011, 10(2): 295-303.
[3] 郁庆华, 谢冉行. 开展仿制药质量一致性评价的探讨[J]. 上海医药, 2014, 35(7): 49-53.
[4] 谢沐风, 张启明, 陈洁, 等. 国外药政部门采用溶出曲线评价口服固体制剂内在品质情况简介[J]. 中国药事, 2008, 22(3): 257-261.
[5] 张启明, 谢沐风, 宁保明, 等. 采用多条溶出曲线评价口服固体制剂的内在质量[J]. 中国医药工业杂志, 2009, 40(12): 946-955.
[6] 药审中心. 口服固体制剂溶出度试验技术指导原则[S]. 2009.
[7] 国家药典委员会. 中华人民共和国药典: 二部[M]. 北京: 中国医药科技出版社, 2010: 1173.
[8] 国家药典委员会. 中华人民共和国药典: 二部[M]. 北京: 中国医药科技出版社, 2015: 1548-1549.
[9] The United States Pharmacopeial Convention. USP39-NF34[M]. USA: 2015: 6325-6326.
Dissolution curve methodology validation of valsartan tablets
DONG Weichang, SUN Jin*
(,,110016,)
To establish a measuring method of the dissolution curve of valsartan tablets.Dissolution conditions: in the pH 6.8 phosphate buffer solution, with the Slurry method of 50 r∙min-1and the dissolution sampling time of 30 min. Through the experimental study of linear and scope, solution stability, precision test, repeatability, recovery test, etc., the dissolution method of valsartan tablets was validated.The results of the dissolution verification methodology were good. There was a good linear relationship when the concentration of valsartan tablets were in the range from 1.61 to 17.71 mg∙L-1. Linear equation was:=3.17×10-2–0.6×10-3. The test solution was basically stable in 12 hours.The method can accurately determine the dissolution of valsartan tablets.
pharmaceutics; dissolution; slurry method; ultraviolet-visible spectrophotometry; valsartan tablets; validation
2019-03-25
董伟昌(1984-), 男(汉族), 河北石家庄人, 高级工程师, 主要从事化学仿制药研究, Tel. 18531115802, E-mail dongwc2007@163.com;
孙进(1975-), 男(汉族), 安徽金寨人, 教授, 博士, 博士生导师, 主要从事药物新剂型和新技术研究, Tel. 024-23986325, E-mail sunjin0529@aliyun.com。
R94
A
(2019)05–0178–08
10.14146/j.cnki.cjp.2019.05.004
(本篇责任编辑:赵桂芝)

